2024年温州市八下科学第二单元微粒的模型与符号拔高培优训练卷(浙教版)
试卷更新日期:2024-03-27 类型:单元试卷
一、选择题(每小题2分,共40分)
-
1. 分析下列各组微粒结构示意图,其中与表示的意义一致的是( )A、
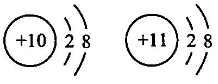 都属于阳离子
B、
都属于阳离子
B、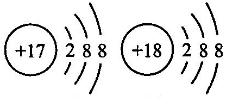 都属于阴离子
C、
都属于阴离子
C、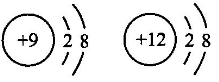 属于一种原子
D、
属于一种原子
D、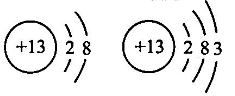 属于一种元素
2. 已知FeSO4、Fe2(SO4)3混合物中铁元素的质量分数为a%,则硫元素的质量分数为( )A、1-a% B、 C、 D、无法计算3. 如图是铜元素和硫元素常见的化合价坐标图,c表示的化合物的化学式是( )
属于一种元素
2. 已知FeSO4、Fe2(SO4)3混合物中铁元素的质量分数为a%,则硫元素的质量分数为( )A、1-a% B、 C、 D、无法计算3. 如图是铜元素和硫元素常见的化合价坐标图,c表示的化合物的化学式是( )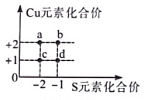 A、CuS B、Cu₂S₂ C、Cu₂S D、CuS₂4. 氕()、氘()、氚()是氢的三种同位素原子。 下列说法正确的是( )A、氕、氘、氚是三种不同的元素 B、三种原子的质量相等 C、三种原子的核外电子数不同 D、氕原子中的中子数为05. 宏观、微观、符号相结合是科学学科特有的思维方式。如图是某反应的微观示意图,下列有关说法正确的是……………( )
A、CuS B、Cu₂S₂ C、Cu₂S D、CuS₂4. 氕()、氘()、氚()是氢的三种同位素原子。 下列说法正确的是( )A、氕、氘、氚是三种不同的元素 B、三种原子的质量相等 C、三种原子的核外电子数不同 D、氕原子中的中子数为05. 宏观、微观、符号相结合是科学学科特有的思维方式。如图是某反应的微观示意图,下列有关说法正确的是……………( ) A、反应中,碳、氢元素的化合价发生了变化 B、物质甲、丙、丁是单质,物质乙是化合物 C、物质丁由两个原子构成 D、生成物丙和丁的质量比为1:16. 图甲模型表示失去一个电子的钠离子和得到一个电子的氯离子的组合,图乙模型表示失去两个电子的镁离子和得到一个电子的氯离子的组合,则丙模型可能表示下列哪一个化学式…( )
A、反应中,碳、氢元素的化合价发生了变化 B、物质甲、丙、丁是单质,物质乙是化合物 C、物质丁由两个原子构成 D、生成物丙和丁的质量比为1:16. 图甲模型表示失去一个电子的钠离子和得到一个电子的氯离子的组合,图乙模型表示失去两个电子的镁离子和得到一个电子的氯离子的组合,则丙模型可能表示下列哪一个化学式…( )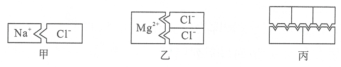 A、CO₂ B、Mg₃N₂ C、Al₂O₃ D、CaCO₃7. 在 CO、CH2O2、C2H2O3 组成的混合物中,氢元素的质量分数为 X,则碳元素的质量分数为( )A、 B、 C、 D、8. 科学家使用普通氧分子和带正电的氧离子,制造出了一种由4个氧原子构成的新型氧分子(O₄)。下列叙述正确的是……( )A、O₄是一种新型的化合物 B、O₄和O₂的性质完全相同 C、O₄和O₂混合后形成的是混合物 D、一个O₄分子中含有2个O₂分子9. 在一定温度下,某气体中可能含有一氧化碳、二氧化碳、氧气中的一种或几种,则该气体中碳元素的质量分数不可能是 ( )A、15% B、24% C、32% D、45%10. p克某结晶水合物A·nH₂O,受热失去全部结晶水后,质量变为q克,由此可以得知该结晶水合物的相对分子质量为 ( )A、 B、 C、 D、11. 科学家计划用质子数为20的钙原子,轰击核电荷数为98的镧元素靶,使两种元素的原子核合并在一起,合成核电荷数为118的新元素。对此理解正确的是…………………………………( )A、新元素的原子核外电子数为116 B、变化过程中元素种类没有发生改变 C、这个变化属于化学变化 D、新元素的质子数为11812. 将乙酸()和葡萄糖溶于水得到混合溶液,测得溶液中氢元素的质量分数为a,则溶液中碳元素的质量分数为………………………………………………( )A、1-9a B、1-8a C、12a D、8a13. 由C2H2和C2H4O组成的混合气体中,经测定其中碳元素的质量分数为72%,则混合物中氧元素的质量分数为( )A、32% B、22.65% C、19.56% D、2.14%14. CO2、P2O3、CaO、SO2四种物质中,与另外三种物质不同的是( )A、CO2 B、P2O3 C、CaO D、SO215. 达菲的主要制作原料是八角、茴香中的莽草酸(C7H10O5)。下列关于莽草酸的说法中,正确的是( )A、莽草酸中碳元素的质量分数约为 48.28% B、莽草酸由7个碳原子、10个氢原子、5个氧原子构成 C、莽草酸的相对分子质量为 174g D、莽草酸中碳、氢、氧三种元素的质量比为7:10:516. 硫隔绝空气加热后的蒸气中有一种物质的化学式为S8 , 关于S8的叙述不正确的有( )A、它是一种新型的化合物 B、它是一种单质 C、它的一个分子中有8个硫原子 D、相对分子质量为25617. 工业品盐酸中因含有Fe³+而显黄色,若某工业品盐酸中H+和Cl-的个数比为91:94,则该盐酸中Fe³+和Cl-的个数比为( )A、1:1 B、1:3 C、91:94 D、1:9418. 有三种不同的原子,A原子核内有6个质子和6个中子,B原子核内有7个质子和7个中子,C原子核内有6个质子和8个中子。下列说法正确的是( )A、A和C的核电荷数不同 B、B和C的核外电子数相同 C、A和C是同一种元素 D、B和C互为同位素原子19. 等电子体具有原子数目相同、电子数目相同的特征。下列各组中的物质属于等电子体的是( )A、NO和O2 B、CO和N2 C、NO2和CO2 D、SO2和ClO220. 人们发现自然界中有一系列与甲烷(CH4)结构、化学性质相似的有机化合物。它们分子中的碳原子数依次递增,如甲烷(CH4)、乙烷(C2H6)、丙烷(C2H6)、丁烷(C4H10)、戊烷(C3H12)⋯⋯依据它们分子组成变化的规律,下列推断不正确的是 ( )A、分子中含10个碳原子的癸烷分子式是 C10H24 B、这一系列化合物分子中碳原子数每增加1个,氢原子数随之增加2个 C、这一系列化合物分子组成可用CnH2n+2(n≥1)表示 D、这一系列化合物中相对分子质量最小的是甲烷
A、CO₂ B、Mg₃N₂ C、Al₂O₃ D、CaCO₃7. 在 CO、CH2O2、C2H2O3 组成的混合物中,氢元素的质量分数为 X,则碳元素的质量分数为( )A、 B、 C、 D、8. 科学家使用普通氧分子和带正电的氧离子,制造出了一种由4个氧原子构成的新型氧分子(O₄)。下列叙述正确的是……( )A、O₄是一种新型的化合物 B、O₄和O₂的性质完全相同 C、O₄和O₂混合后形成的是混合物 D、一个O₄分子中含有2个O₂分子9. 在一定温度下,某气体中可能含有一氧化碳、二氧化碳、氧气中的一种或几种,则该气体中碳元素的质量分数不可能是 ( )A、15% B、24% C、32% D、45%10. p克某结晶水合物A·nH₂O,受热失去全部结晶水后,质量变为q克,由此可以得知该结晶水合物的相对分子质量为 ( )A、 B、 C、 D、11. 科学家计划用质子数为20的钙原子,轰击核电荷数为98的镧元素靶,使两种元素的原子核合并在一起,合成核电荷数为118的新元素。对此理解正确的是…………………………………( )A、新元素的原子核外电子数为116 B、变化过程中元素种类没有发生改变 C、这个变化属于化学变化 D、新元素的质子数为11812. 将乙酸()和葡萄糖溶于水得到混合溶液,测得溶液中氢元素的质量分数为a,则溶液中碳元素的质量分数为………………………………………………( )A、1-9a B、1-8a C、12a D、8a13. 由C2H2和C2H4O组成的混合气体中,经测定其中碳元素的质量分数为72%,则混合物中氧元素的质量分数为( )A、32% B、22.65% C、19.56% D、2.14%14. CO2、P2O3、CaO、SO2四种物质中,与另外三种物质不同的是( )A、CO2 B、P2O3 C、CaO D、SO215. 达菲的主要制作原料是八角、茴香中的莽草酸(C7H10O5)。下列关于莽草酸的说法中,正确的是( )A、莽草酸中碳元素的质量分数约为 48.28% B、莽草酸由7个碳原子、10个氢原子、5个氧原子构成 C、莽草酸的相对分子质量为 174g D、莽草酸中碳、氢、氧三种元素的质量比为7:10:516. 硫隔绝空气加热后的蒸气中有一种物质的化学式为S8 , 关于S8的叙述不正确的有( )A、它是一种新型的化合物 B、它是一种单质 C、它的一个分子中有8个硫原子 D、相对分子质量为25617. 工业品盐酸中因含有Fe³+而显黄色,若某工业品盐酸中H+和Cl-的个数比为91:94,则该盐酸中Fe³+和Cl-的个数比为( )A、1:1 B、1:3 C、91:94 D、1:9418. 有三种不同的原子,A原子核内有6个质子和6个中子,B原子核内有7个质子和7个中子,C原子核内有6个质子和8个中子。下列说法正确的是( )A、A和C的核电荷数不同 B、B和C的核外电子数相同 C、A和C是同一种元素 D、B和C互为同位素原子19. 等电子体具有原子数目相同、电子数目相同的特征。下列各组中的物质属于等电子体的是( )A、NO和O2 B、CO和N2 C、NO2和CO2 D、SO2和ClO220. 人们发现自然界中有一系列与甲烷(CH4)结构、化学性质相似的有机化合物。它们分子中的碳原子数依次递增,如甲烷(CH4)、乙烷(C2H6)、丙烷(C2H6)、丁烷(C4H10)、戊烷(C3H12)⋯⋯依据它们分子组成变化的规律,下列推断不正确的是 ( )A、分子中含10个碳原子的癸烷分子式是 C10H24 B、这一系列化合物分子中碳原子数每增加1个,氢原子数随之增加2个 C、这一系列化合物分子组成可用CnH2n+2(n≥1)表示 D、这一系列化合物中相对分子质量最小的是甲烷二、填空题(每空1分,共 39 分)
-
21. 2013 年5月,某市自来水有股奇怪的味道,经专家多轮综合检测,基本认定引起此次异味的主要物质是邻叔丁基苯酚。将30克邻叔丁基苯酚完全燃烧,生成88克 CO2和25.2克 H2O(无其他产物)。已知邻叔丁基苯酚的相对分子质量为 150,则:(1)、30克邻叔丁基苯酚中含碳元素 克,氢元素克。(2)、邻叔丁基苯酚的化学式为。22. 模型可以反映客观现象,简单明了地表示事物。根据下图模型回答问题。
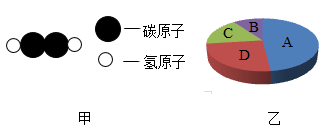 (1)、乙炔是一种简单的有机物,其分子结构模型如图甲所示,乙炔中碳、氢两种元素的质量比为(2)、尿素( )是一种常见的化肥,图乙是尿素中各元素质量分数的模型,则图中的B表示的是元素。(3)、若乙炔分子和尿素分子 的个数相同,则它们所含碳原子的个数比。23.(1)、地壳中含量最多的金属元素与非金属元素形成的物质的化学式为。(2)、元素X的原子获得2个电子,元素Y的原子失去1个电子后,所形成离子的所带电子数均与氖原子相同,由X、Y两元素的离子形成的化合物(具体物质)的化学式为。(3)、相同质量的 H2O2 和 H2O 中氢元素的质量比为。(4)、甲乙两种化合物都是由XY两种元素组成的,甲物质中X与Y元素的质量比为7:16,乙物质中X与Y元素的质量比为7:20,若甲的化学式为XY2 , 则乙的化学式为。24. 下列分别盛有不同物质的容器中,所盛物质属于单质的是 , 属于混合物的是 , 属于化合物的是(均填容器下的字母)。若C瓶中CO2和CO所含的氧元素的质量相等,则CO2和CO中碳元素的质量比为 , CO2和CO的质量比为。D瓶中保持冰化学性质的最小粒子是(填化学式)。
(1)、乙炔是一种简单的有机物,其分子结构模型如图甲所示,乙炔中碳、氢两种元素的质量比为(2)、尿素( )是一种常见的化肥,图乙是尿素中各元素质量分数的模型,则图中的B表示的是元素。(3)、若乙炔分子和尿素分子 的个数相同,则它们所含碳原子的个数比。23.(1)、地壳中含量最多的金属元素与非金属元素形成的物质的化学式为。(2)、元素X的原子获得2个电子,元素Y的原子失去1个电子后,所形成离子的所带电子数均与氖原子相同,由X、Y两元素的离子形成的化合物(具体物质)的化学式为。(3)、相同质量的 H2O2 和 H2O 中氢元素的质量比为。(4)、甲乙两种化合物都是由XY两种元素组成的,甲物质中X与Y元素的质量比为7:16,乙物质中X与Y元素的质量比为7:20,若甲的化学式为XY2 , 则乙的化学式为。24. 下列分别盛有不同物质的容器中,所盛物质属于单质的是 , 属于混合物的是 , 属于化合物的是(均填容器下的字母)。若C瓶中CO2和CO所含的氧元素的质量相等,则CO2和CO中碳元素的质量比为 , CO2和CO的质量比为。D瓶中保持冰化学性质的最小粒子是(填化学式)。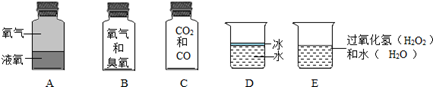 25. 嫦娥四号月球探测器登上月球背面,成为世界首个着落在月球背面的探测器。此后,嫦娥四号通过“鹊桥”中继星向世界展现了首张月背的完整风貌。其实看似荒凉的月球矿产资源极为丰富。以铁为例,仅月面表层5厘米厚的沙土就含有上亿吨铁。(1)、科学研究发现,月球上富含铁的同位素:Fe﹣57(一个原子内质子数与中子数之和为57)和Fe﹣54,已知铁元素为26号元素,则下列相关说法错误的是_________。A、Fe﹣57和Fe﹣54原子核外电子数相同,中子数不同 B、Fe﹣57和Fe﹣54在元素周期表中占同一个位置 C、Fe﹣57和Fe﹣54均属于铁元素,所以相对原子质量相同(2)、地球上的铁主要以氧化物形式存在,在Fe2O3、Fe3O4两种化合物中,与等质量铁元素相结合的氧元素的质量比为;某赤铁矿(主要成分为Fe2O3 , 且其它成分不含铁)探明含铁量为10.5%,则Fe2O3含量为(以百分数的形式表示)。26. 有水(H₂O)、双氧水(H₂O₂)、重水(D₂O)(“D”表示原子核中有一个质子和一个中子的氢原子)三种物质,从物质组成的角度看,这三种物质所含的元素共有种,18克水中含有的氧元素的质量与克双氧水中含有的氧元素质量相等。27. 下表所示是元素周期表中核电荷数从1-18的部分元素排列情况。据表回答下列问题
25. 嫦娥四号月球探测器登上月球背面,成为世界首个着落在月球背面的探测器。此后,嫦娥四号通过“鹊桥”中继星向世界展现了首张月背的完整风貌。其实看似荒凉的月球矿产资源极为丰富。以铁为例,仅月面表层5厘米厚的沙土就含有上亿吨铁。(1)、科学研究发现,月球上富含铁的同位素:Fe﹣57(一个原子内质子数与中子数之和为57)和Fe﹣54,已知铁元素为26号元素,则下列相关说法错误的是_________。A、Fe﹣57和Fe﹣54原子核外电子数相同,中子数不同 B、Fe﹣57和Fe﹣54在元素周期表中占同一个位置 C、Fe﹣57和Fe﹣54均属于铁元素,所以相对原子质量相同(2)、地球上的铁主要以氧化物形式存在,在Fe2O3、Fe3O4两种化合物中,与等质量铁元素相结合的氧元素的质量比为;某赤铁矿(主要成分为Fe2O3 , 且其它成分不含铁)探明含铁量为10.5%,则Fe2O3含量为(以百分数的形式表示)。26. 有水(H₂O)、双氧水(H₂O₂)、重水(D₂O)(“D”表示原子核中有一个质子和一个中子的氢原子)三种物质,从物质组成的角度看,这三种物质所含的元素共有种,18克水中含有的氧元素的质量与克双氧水中含有的氧元素质量相等。27. 下表所示是元素周期表中核电荷数从1-18的部分元素排列情况。据表回答下列问题①
He
C
②
F
③
Al
Si
④
Cl
Ar
(1)、①③④中属于金属元素的是(填编号)。(2)、②代表的元素和Al元素形成化合物,则这种化合物的化学式为。(3)、与Ar的核外电子排布相同,则X的元素符号是。28. 探测月壤是“嫦娥一号”的主要任务之一。因为月壤中蕴藏着丰富的He-3,其原子结构如图所示。He-3是一种安全、高效的清洁燃料,它的应用前景十分广阔。请回答下列问题。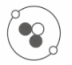 (1)、图中微粒“●”是(填“质子”“中子”或“电子”)。(2)、He-4是He-3的同位素原子,则He-4中质子有个,中子有个。(3)、α粒子是带两个单位正电荷的氦原子核,则氦原子转化为α粒子时,两个电子。29. 儿童缺锌会引起食欲不振、发育不良,如图为某种补锌口服液说明书的一部分,请回答下列问题。
(1)、图中微粒“●”是(填“质子”“中子”或“电子”)。(2)、He-4是He-3的同位素原子,则He-4中质子有个,中子有个。(3)、α粒子是带两个单位正电荷的氦原子核,则氦原子转化为α粒子时,两个电子。29. 儿童缺锌会引起食欲不振、发育不良,如图为某种补锌口服液说明书的一部分,请回答下列问题。 (1)、该口服液中的锌属于(填“常量”或“微量”)元素;葡萄糖酸锌中的碳、氢元素的质量比为。(2)、每支口服液中锌元素的质量分数为(1克=1000毫克)。(3)、若儿童1千克体重每日需要0.5毫克锌,每天从食物中只能摄入所需锌的一半;体重为20千克的儿童每天还须服该口服液支,才能满足身体的需要。30. 为探究原子结构,1911年英国科学家卢瑟福进行了著名的α粒子(一个α粒子内含2个质子)轰击金箔实验,发现以下现象,如图甲。
(1)、该口服液中的锌属于(填“常量”或“微量”)元素;葡萄糖酸锌中的碳、氢元素的质量比为。(2)、每支口服液中锌元素的质量分数为(1克=1000毫克)。(3)、若儿童1千克体重每日需要0.5毫克锌,每天从食物中只能摄入所需锌的一半;体重为20千克的儿童每天还须服该口服液支,才能满足身体的需要。30. 为探究原子结构,1911年英国科学家卢瑟福进行了著名的α粒子(一个α粒子内含2个质子)轰击金箔实验,发现以下现象,如图甲。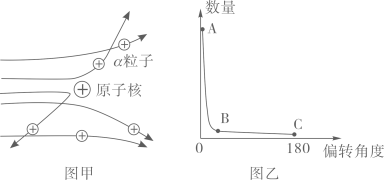
现象1:大多数α粒子能穿透金箔而不改变原来运动方向;现象2:少部分α粒子改变原来的运动方向;
现象3:极少数α粒子被弹了回来。
(1)、请分析现象3的原因。(2)、根据α粒子散射实验,统计不同偏转角度的α粒子数量,并绘制成图像(如图乙)。其中能说明原子内部绝大部分是空的数据是点(用字母表示)。(3)、卢瑟福构建了核式原子结构模型,若以O、●和 分别代表电子、质子与中子,则下列各示意图所描述的微粒不属于同一类原子的是______。 A、
分别代表电子、质子与中子,则下列各示意图所描述的微粒不属于同一类原子的是______。 A、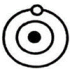 B、
B、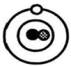 C、
C、 D、
D、 31. 1886年,法国化学家莫瓦桑第一次制得了氟的气态单质,并确定其化学式为F。
31. 1886年,法国化学家莫瓦桑第一次制得了氟的气态单质,并确定其化学式为F。它几乎可以与所有金属直接化合,且在化合物中氟几乎都呈-1价。
(1)、F元素属于(填”金属”或”非金属”)元素。(2)、科学家还用Xe(氙气)和PtF6首次合成了含稀有气体元素的化合物XePtF6 , 其中PtF6。为带一个单位负电荷的原子团,XePtF6中Pt元素的化合价为。32. 守恒思想是科学中重要的学科思想,电荷守恒便是其中之一。电荷守恒是指溶液中所有的阳离子所带正电荷之和等于所有阴离子所带负电荷之和。例如:某Na2SO4溶液中有x个Na+ , 有y个SO42- , 则该溶液电荷守恒可表示为x=2y。现有一混合溶液,组成如表所示。请回答:
离子
K+
Mg2+
Cl-
SO42-
个数
a
B
c
d
(1)、该混合液的电荷守恒可表示为(用a、b、c、d表示)。(2)、若该溶液中有两种溶质,这两种溶质可以是KCl和MgSO4 , 也可以是(填化学式)。三、实验探究题(每空1分,共10 分)
-
33. 隔夜菜是否能吃,主要在于烧熟后的隔夜菜中亚硝酸盐含量的变化是否符合食品安全要求。蔬菜中的硝酸盐来自生长过程中所施氮肥,空气中微生物(如硝酸盐还原菌)进入到蔬菜中,会产生一种还原酶,使蔬菜中的部分硝酸盐还原成亚硝酸盐。烧熟后的菜在食用和保存阶段都会有一些细菌进入:做熟的蔬菜更适合细菌生长。
某研究小组对烧熟的菜中亚硫酸盐含量做了测试,数据如下表:盖有保鲜膜的菜肴在4℃的冰箱中放置不同时间的亚硝酸盐含量(单位: )
菜肴
半小时
6小时
18小时
24小时
炒青菜
0.6861
0.7982
4.3333
5.3624
韭菜炒蛋
1.8153
1.9249
2.8390
5.6306
红烧肉
2.4956
4.2558
4.0668
5.5188
红烧鲫鱼
/
2.0948
3.2300
7.2397
将一份红烧鲫鱼样本(不盖保鲜膜)在常温下放置4小时,测定其亚硝酸盐含量为8.9483 。
请根据以上材料,回答下列问题:
(1)、亚硝酸盐中含有亚硝酸根离子 , 其中氮元素的化合价是价。(2)、根据表中的数据,菜中的亚硝酸盐含量变化的共同规律是:。(3)、要使烧熟后的隔夜菜中亚硝酸盐含量尽可能低,保存的条件应该是。(4)、用多种菜做实验的目的是。34. 某兴趣小组做以下实验探究分子的运动。已知碱性溶液能使酚酞变红,而氨水呈碱性, 当闻浓氨水时可闻到强烈刺激性气味。请回答实验中的有关问题: (1)、实验Ⅰ:在盛有少量蒸馏水的小烧杯中滴入 2—3 滴酚酞试液,再向其中滴加浓氨水。观察到的现象是。(2)、实验Ⅱ(如图中甲所示):烧杯 B 中的现象是;产生这一现象的原因是。(3)、为使实验结论准确可靠,该兴趣小组设计实验Ⅲ(如图中乙所示)作为对比实验。你认为有无必要,并说明理由。。35. 光合作用产生的氧来自二氧化碳还是水?鲁宾和卡门在实验中利用了同位素对这个问题进行了研究。他们首先选择一种碳酸氢盐,制备出含有不同比例18O的该种物质,即18O在该物质氧元素中所占比例不同。同样方法,制备出含有不同比例18O的水,然后配成三种质量分数相同的碳酸氢盐溶液。碳酸氢盐溶解在水中能生成二氧化碳并保持水中的二氧化碳浓度不变,同时不会产生水。将小球藻放入这三种溶液并用阳光进行照射。分析产生氧气中18O的比例,得出结论:光合作用产生的氧来自水。(1)、18O和16O属于同位素原子,它们的原子结构中 相同。A、质子数 B、中子数 C、电子数 D、核电荷数(2)、根据实验结论,在虚线框内补充第三次实验碳酸氢盐和氧气中18O百分比的条形图。
(1)、实验Ⅰ:在盛有少量蒸馏水的小烧杯中滴入 2—3 滴酚酞试液,再向其中滴加浓氨水。观察到的现象是。(2)、实验Ⅱ(如图中甲所示):烧杯 B 中的现象是;产生这一现象的原因是。(3)、为使实验结论准确可靠,该兴趣小组设计实验Ⅲ(如图中乙所示)作为对比实验。你认为有无必要,并说明理由。。35. 光合作用产生的氧来自二氧化碳还是水?鲁宾和卡门在实验中利用了同位素对这个问题进行了研究。他们首先选择一种碳酸氢盐,制备出含有不同比例18O的该种物质,即18O在该物质氧元素中所占比例不同。同样方法,制备出含有不同比例18O的水,然后配成三种质量分数相同的碳酸氢盐溶液。碳酸氢盐溶解在水中能生成二氧化碳并保持水中的二氧化碳浓度不变,同时不会产生水。将小球藻放入这三种溶液并用阳光进行照射。分析产生氧气中18O的比例,得出结论:光合作用产生的氧来自水。(1)、18O和16O属于同位素原子,它们的原子结构中 相同。A、质子数 B、中子数 C、电子数 D、核电荷数(2)、根据实验结论,在虚线框内补充第三次实验碳酸氢盐和氧气中18O百分比的条形图。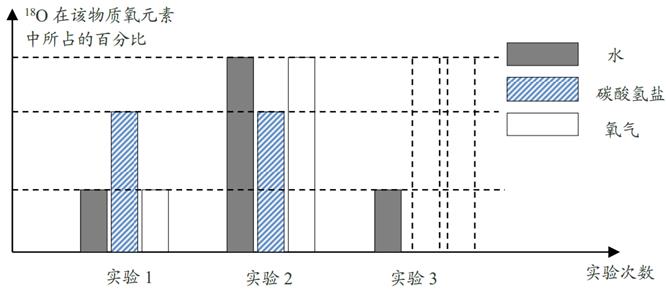 (3)、鲁宾和卡门是通过测量生成氧气的密度确定氧气中18O的含量。如果有一种氧气,18O占50%,即18O和16O的个数比为1:1。根据以下资料计算,在标准状况下该种氧气的密度为kg/m3。(保留两位小数)
(3)、鲁宾和卡门是通过测量生成氧气的密度确定氧气中18O的含量。如果有一种氧气,18O占50%,即18O和16O的个数比为1:1。根据以下资料计算,在标准状况下该种氧气的密度为kg/m3。(保留两位小数)资料:I.在相同的温度和压强下,相同体积的气体具有相同的分子数。
II.18O的相对原子量为 18,16O的相对原子量为 16。
III.自然界的氧气在标准状况下的密度为1.43 kg/m3 , 16O 占所有氧原子的比例可近似看作 100%。
四、解答题(每小题或者每空1分,共11分)
-
36. 人体中钙元素主要以羟基磷酸钙晶体 形式存在于骨略和牙齿中,而牛奶是含钙丰富又易吸收的理想食品,下图为某乳业公可纯奶包装标签:
配料:鲜牛奶
净含量: /盒
营养成分(每 )
蛋白质
钙
保质期:8个月
(1)、羟基磷酸钙由种元素组成;(2)、羟基磷酸钙中钙、氧元素的质量比为多少(写出计算过程)(3)、若人体每天至少需要 钙,每天已从食物中摄入所需钙的一半,则每天至少要喝这种牛奶盒。(4)、除了喝牛奶以外,青少年还可以通过服用含碳酸钙 的钙片来补钙。求 碳酸钙 和多少质量的氢氧化钙 所含的钙元素质量相等?(写出计算过程)37. 在现代生活中,人们越来越注重微量元素的摄取。碘元素对人体有着至关重要的作用,如图是某地市场销售的一种“加碘食盐”包装袋上的部分说明,根据图回答下列问题。 (1)、“食用碘盐”属于(填“纯净物”或“混合物”)。(2)、碘酸钾中碘元素的化合价为。(3)、上述“含碘量”中的碘是指。(填序号)。
(1)、“食用碘盐”属于(填“纯净物”或“混合物”)。(2)、碘酸钾中碘元素的化合价为。(3)、上述“含碘量”中的碘是指。(填序号)。①碘酸钾 ②碘元素 ③碘单质 ④碘分子
(4)、由上述“文字说明”可推测碘酸钾的一种化学性质是。(5)、碘酸钾中钾元素、碘元素的质量比是 , 碘酸钾中碘元素的质量分数是(结果精确到0.1%)。(6)、通过计算说明,上述“加碘食盐”1000克中含碘酸钾的最低质量为多少毫克?