内蒙古呼和浩特市2023-2024学年高三上学期期末教学质量检测化学试卷
试卷更新日期:2024-03-21 类型:期末考试
一、单项选择(本题共17小题,每小题3分,共51分)
-
1. 2023年我国科技取得新突破,实现“上天、入海、探月”.下列有关说法不正确的是( )A、探月卫星需要火箭发送,火箭动力源于氧化还原反应 B、神舟十六号太阳敏感器上的石英玻璃主要成分是硅 C、国产大飞机“”实现商飞,其中使用的铝锂合金具有硬度大,质量轻等优点 D、首艘国产大型邮轮“爱达·魔都号”下水,邮轮常用镶嵌锌块的方法来防止外壳被海水腐蚀2. 化学用语是学习化学的重要工具.下列化学用语表达正确的是( )A、次氯酸的结构式: B、的电子式: C、丙烷的球棍模型:
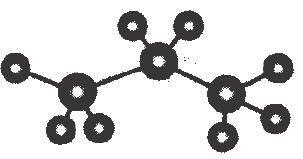 D、的结构示意图:
D、的结构示意图: 3. 物质X能实现下列物质间的转化,则X不可能是( )
3. 物质X能实现下列物质间的转化,则X不可能是( )氧化物酸(或碱)盐
A、 B、 C、C. D、4. 利用下列装置(夹持装置已省略)进行对应实验.下列说法正确的是( )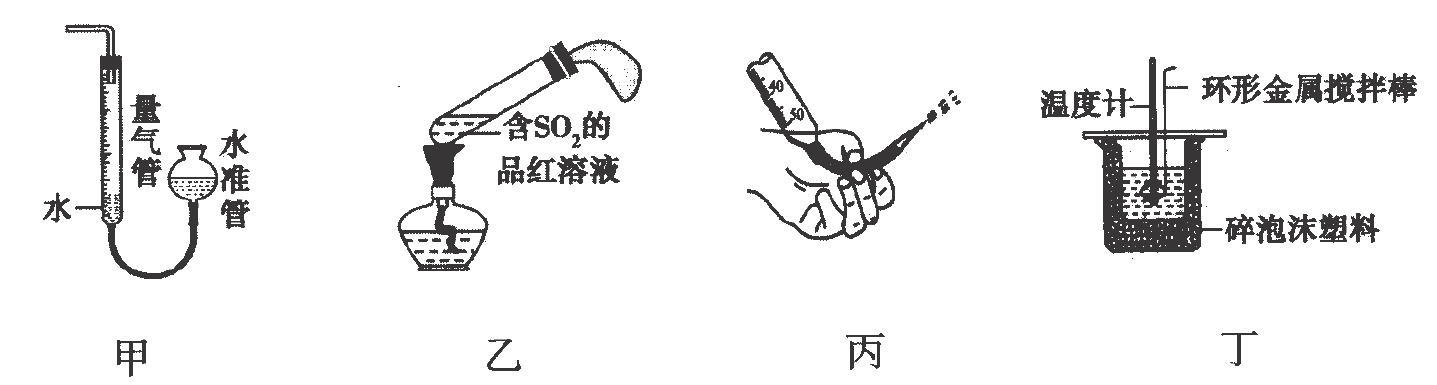 A、装置甲可用于测量与稀硫酸反应产生的体积 B、装置乙加热时,品红溶液中红色褪去,冷却后溶液变红 C、装置丙操作可排出盛有溶液滴定管尖嘴内的气泡 D、装置丁可用于中和热的测定5. 化合物Z是一种治疗糖尿病药物的重要中间体,其结构如下图所示.下列有关该化合物的说法正确的是( )
A、装置甲可用于测量与稀硫酸反应产生的体积 B、装置乙加热时,品红溶液中红色褪去,冷却后溶液变红 C、装置丙操作可排出盛有溶液滴定管尖嘴内的气泡 D、装置丁可用于中和热的测定5. 化合物Z是一种治疗糖尿病药物的重要中间体,其结构如下图所示.下列有关该化合物的说法正确的是( )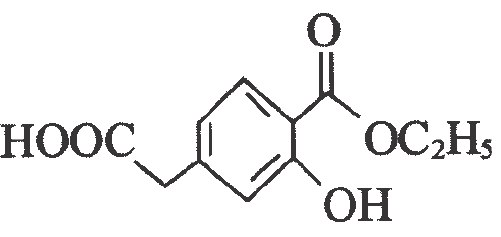 A、分子式为 B、分子中有4种官能团 C、不能与溶液发生反应 D、苯环上的一氯代物为3种6. 下列离子方程式表示正确的是( )A、溶液与铜的反应: B、溶液中滴入少量溶液: C、钠与水的反应: D、氯气通入冷的石灰乳中:7. 我国科学家研制出了一种新型固体催化剂 , 常温常压下可实现如图1所示的反应,该反应的能量变化如图2所示.下列有关描述不正确的是( )
A、分子式为 B、分子中有4种官能团 C、不能与溶液发生反应 D、苯环上的一氯代物为3种6. 下列离子方程式表示正确的是( )A、溶液与铜的反应: B、溶液中滴入少量溶液: C、钠与水的反应: D、氯气通入冷的石灰乳中:7. 我国科学家研制出了一种新型固体催化剂 , 常温常压下可实现如图1所示的反应,该反应的能量变化如图2所示.下列有关描述不正确的是( )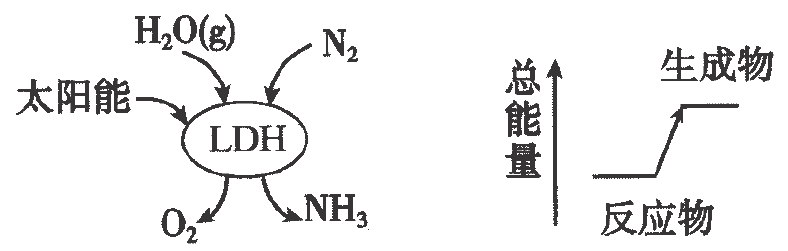
图1 图2
A、该过程实现了在常温常压下的可见光固氮 B、反应过程中存在极性键和非极性键的断裂与生成 C、使用 , 可同时提高反应速率和的平衡转化率 D、该反应的热化学方程式可表示为:8. 下列操作不能达到实验目的的是( )选项
目的
操作
A
除去氯气中混有的氯化氢气体
通入盛有饱和溶液的洗气瓶
B
除去自来水中含有的氯离子等杂质
将自来水进行蒸馏
C
除去氧化铁中混有的氧化铝
加入足量的溶液,过滤、洗涤
D
除去乙酸乙酯中混有的少量乙酸
加入饱和溶液洗涤、分液
A、A B、B C、C D、D9. X、Y、Z、W为原子序数依次增大的短周期主族元素.X分别与Y、Z、W结合形成质子数相同的甲、乙、丙三种分子.丙的水溶液可刻蚀玻璃;丁为无色气体,遇空气变红棕色.上述物质有如图转化关系:
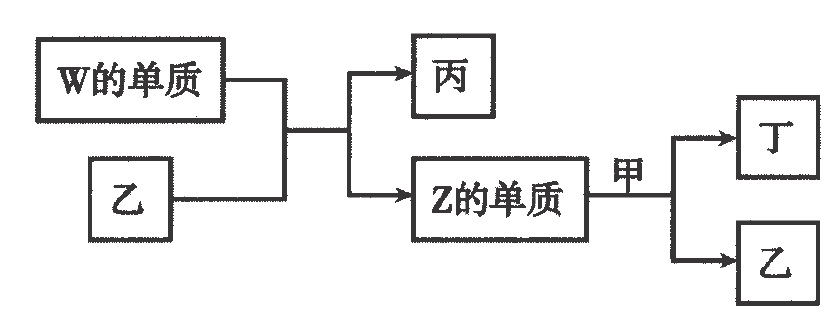
下列说法正确的是( )
A、原子半径: B、甲、乙、丙中沸点最高的是丙 C、由X、Y、Z三种元素形成的化合物一定是共价化合物 D、四种元素形成的单质中W单质的氧化性最强10. 下列工业转化过程在给定条件下均能实现的是( )A、工业制硫酸: B、海水提镁: C、制备高纯硅:石英高纯硅 D、侯氏制碱法:饱和11. 为阿伏加德罗常数的值.下列说法正确的是( )A、标准状况下,与足量充分反应,转移的电子数目为 B、水解形成的胶体粒子数为 C、 , 当放出热量时,参加反应的为 D、向溶液中加氨水至中性,此时溶液含数目大于12. 下列各组离子在给定溶液中一定大量共存的是( )A、在溶液中: B、在溶液中: C、使甲基橙变红的溶液中: D、常温下,水电离出的溶液中:13. 为完成下列各组实验,所选择的装置正确的是( )选项
A
B
C
D
装置和试剂
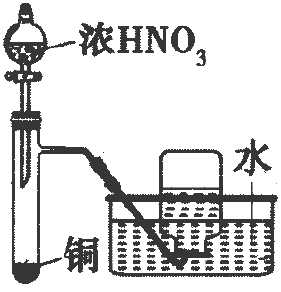
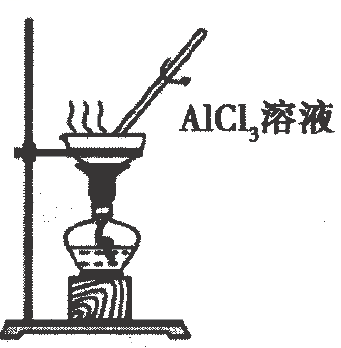
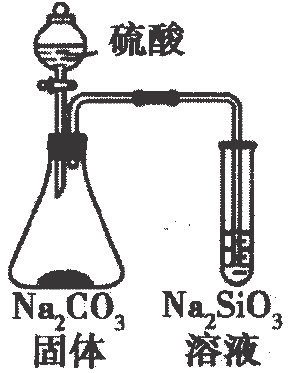
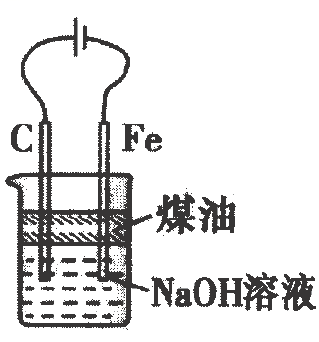
实验目的
制取
获取晶体
比较非金属性:
获得纯净的
A、A B、B C、C D、D14. 浓差电池是电池内某一物质由高浓度变为低浓度且伴随着能量变化的一类电池,现有如图Ⅰ、Ⅱ所示装置,电极材料均为 , 该装置工作时,下列说法正确的是( )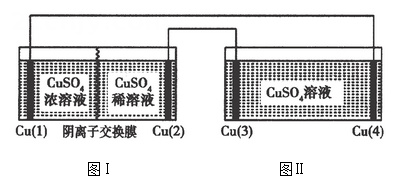 A、电子流向: B、极和极的电极反应都是: C、工作一段时间后,图Ⅱ装置中溶液浓度不变 D、若通过阴离子交换膜,理论上极减少15. 下列实验操作、现象及结论均正确的是( )
A、电子流向: B、极和极的电极反应都是: C、工作一段时间后,图Ⅱ装置中溶液浓度不变 D、若通过阴离子交换膜,理论上极减少15. 下列实验操作、现象及结论均正确的是( )选项
操作
现象
结论
A
向溴水中加入苯,振荡后静置
水层颜色变浅
溴与苯发生了加成反应
B
向溶液中缓慢滴加硫酸
溶液由黄色变为橙色
增大 , 转化平衡向生成的方向移动
C
向溶液中加入几滴氯水振荡,再加萃取
上层颜色无明显变化,下层呈橙色
还原性
D
用计分别测定和的饱和溶液的
饱和溶液的小
酸性:
A、A B、B C、C D、D16. 下表是在常温下三种酸的有关数据,下列判断正确的是( )酸
浓度
0.12
0.2
0.9
1
1
电离度
0.25
0.2
0.1
0.3
0.5
电离常数
A、从的数据可知,在相同温度下,弱电解质溶液浓度越低,电离度越大,电离常数 B、酸性: C、常温下,向溶液中加水,则的比值变小 D、等物质的量的和的混合溶液中:17. 常温下,向溶液和溶液中分别滴加的溶液.滴加过程中或与所加溶液体积之间的关系如下图所示(已知:为砖红色沉淀).下列说法正确的是( )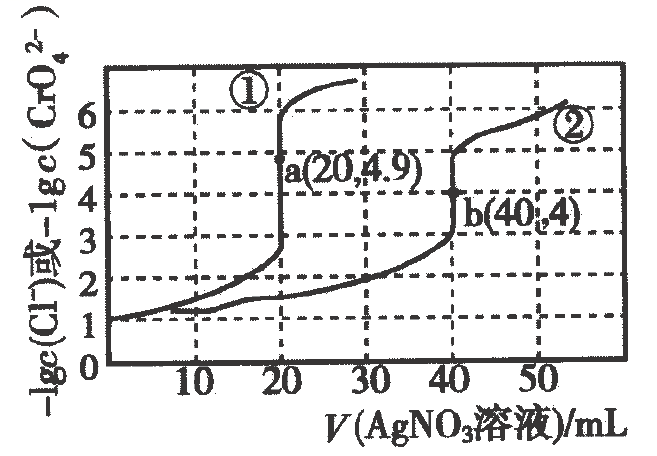 A、曲线②可视为随的变化曲线 B、常温下, C、若只增大溶液的浓度,则图中a点、b点将向上平移 D、用标准溶液滴定溶液时,可用溶液作指示剂
A、曲线②可视为随的变化曲线 B、常温下, C、若只增大溶液的浓度,则图中a点、b点将向上平移 D、用标准溶液滴定溶液时,可用溶液作指示剂二、非选择题(本题共4小题,共49分)
-
18. 处理电镀污水时会产生大量的电镀污泥,下面是处理某种电镀污泥回收铜、镍元素的一种工业流程:

已知:硫酸浸出后得到的浸出液中含有;
回答下列问题:
(1)、“浸出”工序中,为提高浸出率可以采取的措施(写出两条);(2)、在“电解”时,若维持电流强度为 , 电流效率为90%,电解 , 理论上可获得铜的质量g(结果保留小数点后两位);(已知:电流效率是指电解时电极上实际沉积与理论沉积物质的量之比,)(3)、为提高“除杂”工序的效果,“电解”工序中需控制电解电压稍大一些,其目的是;磷酸盐沉淀是、(填化学式);(4)、硫酸镍溶液在强碱性环境下用氧化,可沉淀出能用作镍镉电池正极材料的 . “氧化”工序中反应的离子方程式;(5)、“过滤、洗涤”工序中,检验沉淀洗涤干净的操作方法 .19. 三硫代碳酸钠又名全硫碳酸钠,常温下是一种玫瑰红色针状物质.在农业上常用作杀菌剂、杀虫剂.某小组欲测定三硫代碳酸钠样品的纯度,实验如下:
(1)、【实验一】配制溶液
取固体样品配制成溶液
上述溶液配制过程中不可能用到的仪器是(填字母);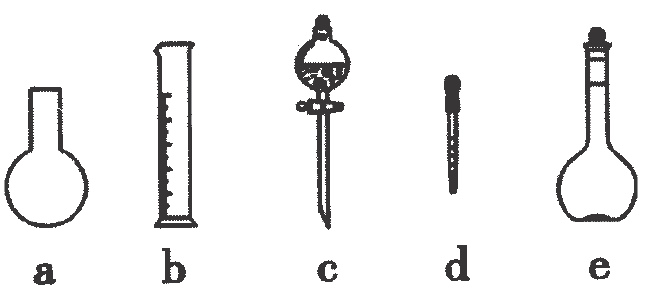 (2)、【实验二】测定样品纯度
(2)、【实验二】测定样品纯度实验装置如下图所示,取上述溶液于圆底烧瓶中,滴加足量稀 , 充分反应,关闭活塞.待反应结束后打开止水夹k,通入一段时间 .
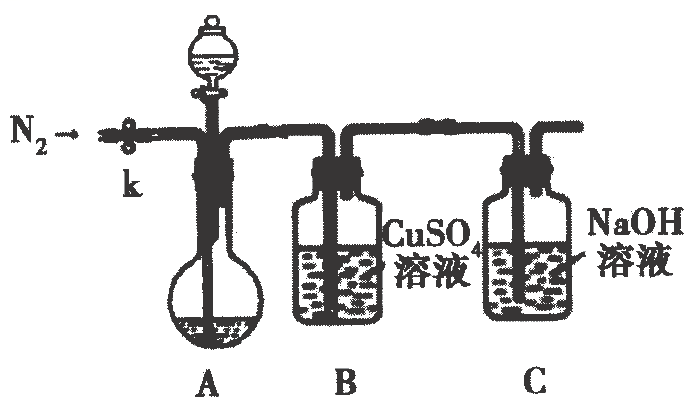
已知:①
②是不溶于水、比水重、易挥发(沸点为)的无色液体;与某些性质相似,与溶液反应生成和
实验小组设计如下两种实验方案测定样品纯度
方案1:通过测定B中产生沉淀的质量,计算样品纯度
B中发生反应的离子方程式;
(3)、将B中产生的沉淀过滤、洗涤、干燥、称重得固体.样品的纯度为;(4)、方案2:通过装置C的增重,计算样品纯度反应结束后,通入的最好是左右的热 , 其目的是;
(5)、该方案测得的样品纯度(填“偏高”或“偏低”),分析原因,写出你对装置的改进建议 .20. 钴及其化合物在化工生产中有重要的用途.三氯化六氨合钴(Ⅲ)是制备其它三价钴配合物的重要试剂.实验室用活性炭作催化剂,为主要原料合成 .反应原理为: .
该过程的流程如图:
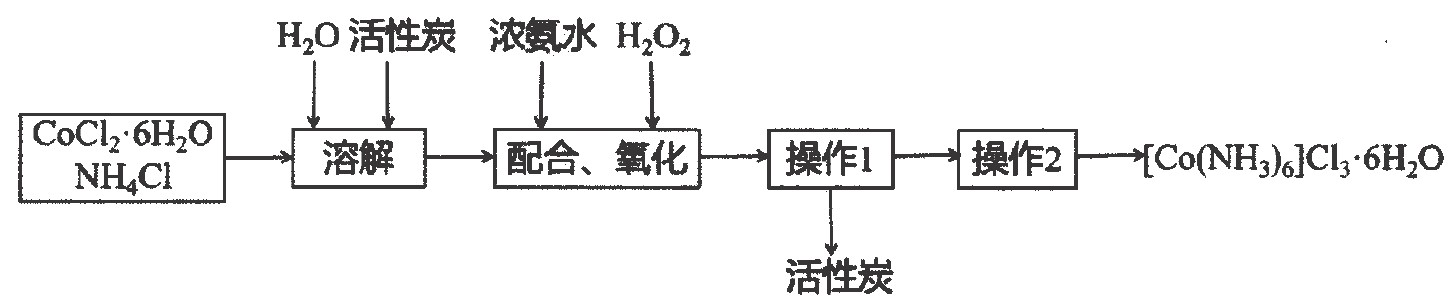
已知:
①不易被氧化,具有较强还原性.
②难溶于无水乙醇,在水中的溶解度随温度升高而增大.
③加入浓盐酸有利于晶体析出.
回答下列问题:
(1)、溶解时加入的有利于后续与的配合反应,还能抑制的水解.写出水解的离子方程式;(2)、发生“配合、氧化”的步骤在如下实验装置中进行.
①盛放混合液仪器的名称;
②干燥管盛放的药品可以是;
a.浓硫酸 b.五氧化二磷 c.碱石灰
③向混合溶液中首先滴加(填入“溶液”或“浓氨水”),完成该步骤的具体操作是;
④“配合、氧化”过程中,控制混合液温度不高于的原因;
(3)、“操作1”的名称;“操作2”的步骤是向滤液滴加少量 , 冷却结晶后过滤,用洗涤晶体次,低温干燥.21. 甲烷化是绿色低碳前沿技术研发的热点方向之一,在环境保护方面显示出较大潜力.涉及反应如下:主反应:
副反应: ,
回答下列问题:
(1)、向密闭容器中充入反应合成 , 平衡时混合气体中含碳物质的物质的量随温度的变化如图所示.
①工业上,常选用作为合成温度,原因是;
②时,经过t分钟反应达平衡,t分钟内用表示的反应速率为;该温度下对甲烷的选择性=
(已知:选择性);
(2)、在体积相等的多个恒容密闭容器中,分别充入和发生上述主反应(忽略副反应),已知该反应的速率方程为 , 其中为速率常数,只受温度影响.在不同温度下反应相同时间,测得转化率与温度关系如图所示.
①c点(填“达平衡”或“未平衡”)
②主反应活化能(正)(逆)(填“>”或“<”),代表的曲线是(填“”或“”);
③温度下达平衡时总压为p,该反应的(列出计算式);
(3)、生物电化学系统可实现合成甲烷.阴极功能微生物可以直接从阴极表面获得电子还原二氧化碳生产甲烷.酸性环境下该过程的电极反应式 .