江苏省扬州市2023-2024学年高三上学期1月期末检测化学试题
试卷更新日期:2024-03-21 类型:期末考试
一、单项选择题:本题包括13小题,每小题3分,共计39分。每小题只有一个选项符合题意。
-
1. 近日,科学家研制出了由石墨烯(结构模型如图所示)材料制成的功能性半导体。这主要是利用了石墨烯的( )
 A、导电性 B、导热性 C、高熔点 D、高沸点2. 反应可用于制备。下列说法正确的是( )A、中子数为37的锌原子: B、中硫元素的化合价: C、的结构示意图:
A、导电性 B、导热性 C、高熔点 D、高沸点2. 反应可用于制备。下列说法正确的是( )A、中子数为37的锌原子: B、中硫元素的化合价: C、的结构示意图: D、的电子式:
3. 气体微溶于水,有强还原性,可由反应制得。实验室制取少量的原理及装置均正确的是( )
D、的电子式:
3. 气体微溶于水,有强还原性,可由反应制得。实验室制取少量的原理及装置均正确的是( ) A、制取 B、干燥 C、收集 D、吸收尾气中的4. 可用于除去某些重金属离子。下列说法正确的是( )A、电负性: B、离子半径: C、电离能: D、热稳定性:5. 阅读下列材料,完成问题:
A、制取 B、干燥 C、收集 D、吸收尾气中的4. 可用于除去某些重金属离子。下列说法正确的是( )A、电负性: B、离子半径: C、电离能: D、热稳定性:5. 阅读下列材料,完成问题:电池有铅蓄电池、燃料电池(如电池)、锂离子电池、一次氯酸盐电池等,它们可以将化学能转化为电能。都可用作燃料电池的燃料。的燃烧热为。电解则可以将电能转化为化学能,电解饱和溶液可以得到 , 用电解法可制备消毒剂高铁酸钠。
(1)、下列说法正确的是( )A、中存在配位键 B、的空间构型为平面正方形 C、中的键角比中的小 D、中心原子的轨道杂化类型为(2)、下列化学反应表示正确的是( )A、铅蓄电池的正极反应: B、电解饱和溶液: C、燃烧: D、一定条件下与的反应:(3)、下列物质结构与性质或物质性质与用途不具有对应关系的是( )A、的电负性比B的大,中显负电性 B、的原子半径比的小,金属锂的熔点比钠的高 C、具有强氧化性,可作为火箭发射的助燃剂 D、的热稳定性较强,可用作燃料电池的燃料(4)、电解法制备的工作原理如图所示。下列说法正确的是( ) A、为电源的负极 B、阳极上的电极反应式为 C、阴离子交换膜应能允许通过而能阻止的扩散 D、理论上每转移 , 阴极上会产生气体6. 硫及其化合物的转化具有重要应用。下列说法不正确的是( )A、用氨水吸收烟气(含等)中获得的物质转化: B、工业制硫酸过程中的物质转化: C、利用硫酸的酸性去除铁制品表面的铁锈 D、利用的还原性将其作为葡萄酒的抗氧化剂7. 化合物Y是合成丹参醇的中间体,其合成路线如下:
A、为电源的负极 B、阳极上的电极反应式为 C、阴离子交换膜应能允许通过而能阻止的扩散 D、理论上每转移 , 阴极上会产生气体6. 硫及其化合物的转化具有重要应用。下列说法不正确的是( )A、用氨水吸收烟气(含等)中获得的物质转化: B、工业制硫酸过程中的物质转化: C、利用硫酸的酸性去除铁制品表面的铁锈 D、利用的还原性将其作为葡萄酒的抗氧化剂7. 化合物Y是合成丹参醇的中间体,其合成路线如下:
下列说法正确的是( )
A、X分子中含手性碳原子 B、X转化为的过程中 与反应生成
与反应生成 C、与以物质的量发生加成反应时可得3种产物
D、X、Y可用酸性溶液进行鉴别
8. , 探究溶液的性质。下列实验方案能达到探究目的的是( )
C、与以物质的量发生加成反应时可得3种产物
D、X、Y可用酸性溶液进行鉴别
8. , 探究溶液的性质。下列实验方案能达到探究目的的是( )选项
探究目的
实验方案
A
钾元素的焰色试验
用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色
B
是否有还原性
向溶液中滴加氯水,再滴入溶液,观察是否有白色沉淀产生
C
是否水解
向溶液中滴加2~3滴酚酞试液,观察溶液颜色的变化
D
比较溶液中与的大小
用计测量溶液的
A、A B、B C、C D、D9. 从炼钢粉尘(主要含)中回收锌的过程如图所示。“浸取”过程转化为 , 并有少量铁元素浸出。已知: , 。下列说法正确的是( ) A、的溶液中: B、溶液中: C、“沉锌”过程中,溶液的减小 D、“沉锌”后的溶液中:10. 为研究反应在不同条件下的转化率,向恒压反应器中通入含一定浓度与的气体,在无催化剂和有催化剂存在时,分别测得不同温度下反应器出口处NO的转化率如图中曲线a、b所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )
A、的溶液中: B、溶液中: C、“沉锌”过程中,溶液的减小 D、“沉锌”后的溶液中:10. 为研究反应在不同条件下的转化率,向恒压反应器中通入含一定浓度与的气体,在无催化剂和有催化剂存在时,分别测得不同温度下反应器出口处NO的转化率如图中曲线a、b所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( ) A、反应的 B、曲线a中转化率随温度升高而增大,是由于催化剂的活性增强 C、曲线中从点到点,转化率随温度升高而减小,是由于反应速率减慢 D、催化剂存在时,其他条件不变,增大气体中 , NO转化率随温度的变化为曲线c
A、反应的 B、曲线a中转化率随温度升高而增大,是由于催化剂的活性增强 C、曲线中从点到点,转化率随温度升高而减小,是由于反应速率减慢 D、催化剂存在时,其他条件不变,增大气体中 , NO转化率随温度的变化为曲线c二、非选择题(共61分)
-
11. 镓及其化合物在半导体、光电材料等领域有广泛应用。(1)、以酸性含溶液(含少量)为原料通过除杂等一系列操作制得粗镓,粗镓经过电解精炼制得高纯镓。体系中含镓微粒的物质的量分数随的关系如图1所示。已知:。
①的基态核外电子排布式为.
②“除杂”包括加入溶液调节、加入足量除去和、过滤等步骤。调节溶液的目的为。
③“电解精炼”时,以粗镓为阳极,含的碱性溶液为电解液,阴极析出镓的电极反应式为;阴极同时有少量气体产生。测得电解过程溶液中镓浓度与电流效率()随时间的变化如图2所示。反应后,降低的原因是。
图1
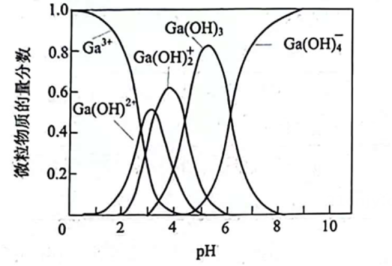 图2
图2 (2)、具有优异的光电性能,可由与发生反应制得。
(2)、具有优异的光电性能,可由与发生反应制得。①制得GaN时生成一种有机物的化学式为。
②的一种晶胞如图3所示。晶体中距离最近且相等的的数目为。

图3
③准确称取样品,加入溶液,加热使固体充分溶解,用足量溶液吸收产生的。向吸收液中滴加指示剂,用的盐酸滴定至终点,消耗盐酸。
过程中涉及反应:; , 计算样品的纯度(写出计算过程)。
12. 化合物是合成一种激酶抑制剂的中间体,其合成路线如下: (1)、反应涉及的反应物有;a.溶液;b.盐酸;c.浓、浓。
(1)、反应涉及的反应物有;a.溶液;b.盐酸;c.浓、浓。①加入反应物的正确顺序是:c、、(填字母)。
②硝化反应的机理可表示为:

反应中浓硫酸的作用是。
(2)、的分子式为 , 结构简式为。(3)、已知: , TEA为 , 能促进该反应的进行。能促进反应进行的原因是。(4)、写出同时满足下列条件的A的一种同分异构体的结构简式。碱性条件水解后酸化生成两种产物,产物之一能与溶液发生显色反应,两种产物的核磁共振氢谱中都有2个峰。
(5)、写出以 、
、 为原料制备
为原料制备 的合成路线流程图(无机试剂和有机溶剂任用)。 13. 深共晶溶剂(DESs)可从中回收锂。(1)、DESs的制备。将乙二醇()与氯化胆碱(
的合成路线流程图(无机试剂和有机溶剂任用)。 13. 深共晶溶剂(DESs)可从中回收锂。(1)、DESs的制备。将乙二醇()与氯化胆碱( )按一定比例混合搅拌至形成均一透明液体,制得DESs。
)按一定比例混合搅拌至形成均一透明液体,制得DESs。
图1
①DESs由含氢键供体(能形成氢键的氢原子)的组分与含氢键受体(能与氢原子形成氢键的原子)的组分混合。乙二醇分子中氢键供体的数目为。
②不同配比氯化胆碱与乙二醇混合的二元相图如图1所示。相同条件下,氯乙二醇的熔点乙二醇的熔点(填“>”“二”或“<”)。制备熔点达到最低值的DESs时,氯化胆碱与乙二醇的物质的量之比为。
(2)、氧化浸出锂。将与按照一定比例混合,再通入。实验装置如图所示。①冷凝管的作用为。
图2
 图3
图3
②主要反应机理如图3所示:
Ⅰ中碳原子轨道杂化类型的变化为;M的化学式为。
(3)、碳酸锂的制备。已知: , 完全沉淀时离子浓度小于;易溶于水;的溶解度:为为为。补充完整由粗溶液(含少量)制备的实验方案:向粗溶液中 , 得到固体。
(须使用的试剂:溶液、溶液)
14. 水合肼在储氢领域有广阔的应用前景,其水溶液呈弱碱性。(1)、分子有顺式、反式和交互式三种比较稳定的空间构型。下列结构能表示分子交互式的是(填序号)。 (2)、肼分解制氢的主要反应为 , 肼的理论储氢密度。测得肼实际分解时产生的气体中含 , 肼实际储氢密度小于理论值的原因是(用化学方程式表示)。(3)、水合肼制氢过程中涉及肼在催化剂表面分解,如图1所示。
(2)、肼分解制氢的主要反应为 , 肼的理论储氢密度。测得肼实际分解时产生的气体中含 , 肼实际储氢密度小于理论值的原因是(用化学方程式表示)。(3)、水合肼制氢过程中涉及肼在催化剂表面分解,如图1所示。
图1
①X的结构简式为。
②催化剂表面存在和两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于(填“”或“”)活性位点。已知:键、键的键能分别是。肼在该催化剂表面反应断裂的化学键不是键,而是键,原因是。
③催化剂存在下,不同浓度的分解时,测得随时间的变化如图2所示。当浓度从增加到时,反应速率加快;从增加到时,反应速率几乎不变。其原因是。

图2