安徽省淮北市2023-2024学年高三上学期1月调研化学试题
试卷更新日期:2024-03-21 类型:期末考试
一、单选题(每小题3分,共45分)
-
1. 2023年5月28日,国产大飞机C919迎来商业首飞,C919机身部分采用第三代新型铝锂合金材料。下列关于铝和锂及合金的认识,正确的是( )A、铝锂合金用于机身材料是因为密度较大,强度较大 B、多相R-Mg-Ni系储氢合金中,基态Ni原子中自旋状态相反的两种电子的个数比为13∶15 C、铝锂合金属于新型无机非金属材料 D、铝锂合金的性质保持了原来金属的性质,与各成分金属的性质都相同2. 化学符号是化学学科进行思维的最基本的工具,下列微粒的化学符号表述正确的是( )A、基态Zn原子的价层电子排布图:
 B、丙酮的球棍模型:
B、丙酮的球棍模型: C、乙酸甲酯的结构简式:C3H6O2
D、NH3的电子式:
C、乙酸甲酯的结构简式:C3H6O2
D、NH3的电子式: 3. 设为阿伏加德罗常数的值。下列说法中正确的是( )A、常温下,pH为13的溶液中含有的数目为 B、溶液中含N的粒子数目为 C、粗铜精炼时,若阳极材料减少 , 电路中通过电子数一定为 D、%的甲酸水溶液中,含有的氧原子数为4. 化学用语是学习化学最好的工具,下列化学用语能用于解释相应实验且书写正确的是( )A、测得碳酸钠溶液呈碱性: B、饱和溶液滴入沸水中变红褐色: C、铅酸蓄电池正极反应: D、小苏打与明矾共溶于水,产生大量气泡:↓5. 我国科学家在世界上首次实现人工合成淀粉,下图是中间产物GAP的结构式,其中X、Y、Z、W均为短周期且原子序数依次增大的主族元素,且W的原子序数为其最外层电子数的3倍。下列说法正确的是( )
3. 设为阿伏加德罗常数的值。下列说法中正确的是( )A、常温下,pH为13的溶液中含有的数目为 B、溶液中含N的粒子数目为 C、粗铜精炼时,若阳极材料减少 , 电路中通过电子数一定为 D、%的甲酸水溶液中,含有的氧原子数为4. 化学用语是学习化学最好的工具,下列化学用语能用于解释相应实验且书写正确的是( )A、测得碳酸钠溶液呈碱性: B、饱和溶液滴入沸水中变红褐色: C、铅酸蓄电池正极反应: D、小苏打与明矾共溶于水,产生大量气泡:↓5. 我国科学家在世界上首次实现人工合成淀粉,下图是中间产物GAP的结构式,其中X、Y、Z、W均为短周期且原子序数依次增大的主族元素,且W的原子序数为其最外层电子数的3倍。下列说法正确的是( )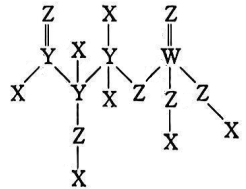 A、对应氢化物的沸点:Y<Z B、X2Z2是由极性键和非极性键组成的非极性分子 C、W所在周期中,第一电离能比其小的元素有5种 D、1mol的该物质可以和足量的Na反应转移4mol的电子6. 下图是实验室模拟制备“84”消毒液的过程,其中装置和描述错误的是( )
A、对应氢化物的沸点:Y<Z B、X2Z2是由极性键和非极性键组成的非极性分子 C、W所在周期中,第一电离能比其小的元素有5种 D、1mol的该物质可以和足量的Na反应转移4mol的电子6. 下图是实验室模拟制备“84”消毒液的过程,其中装置和描述错误的是( )选项
A
B
C
D
装置




描述
制备
净化氯气
制备“84”消毒液
尾气的处理
A、A B、B C、C D、D7. 我国华中科技大学李钰团队研究了H2S在CuFe2O4催化剂表面吸附的历程,他们通过计算机模拟出的一种机理如图所示。
下列说法正确的是( )
A、CuFe2O4催化剂能降低该反应的焓变 B、决定该吸附历程速率的步骤是 C、吸附在催化剂表面的水分子解吸出来时放出能量 D、该吸附历程是H2S的分解过程8. 高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料。它的发现和使用曾引起计算机的一场“革命”。可以按下列方法制备:SiO2Si(粗) SiHCl3Si(纯)
下列说法不正确的是( )
A、步骤①的化学方程式为SiO2+CSi+CO2↑ B、步骤①中每生成1 mol Si,转移4 mol电子 C、高纯硅是制造太阳能电池的常用材料,二氧化硅是制造光导纤维的基本原料 D、SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏可提纯SiHCl39. 晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是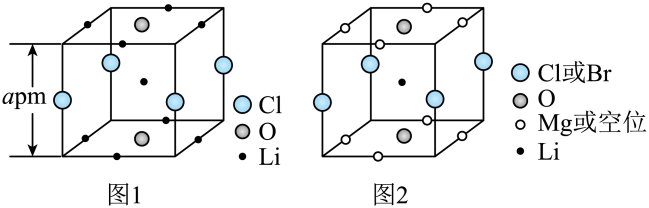 A、图1晶体密度为g∙cm-3 B、图1中O原子的配位数为6 C、图2表示的化学式为 D、取代产生的空位有利于传导10. 室温下,下列实验探究方案能达到探究目的的是( )
A、图1晶体密度为g∙cm-3 B、图1中O原子的配位数为6 C、图2表示的化学式为 D、取代产生的空位有利于传导10. 室温下,下列实验探究方案能达到探究目的的是( )选项
实验探究方案
探究目的
A
向盛有Fe(NO3)2溶液的试管中滴加几滴稀硫酸,振荡,观察溶液颜色变化
具有氧化性
B
向溶液X中加入稀硫酸,并将产生的无色气体通入澄清石灰水中,观察是否有沉淀生成
溶液X中含有或
C
用pH试纸分别测定浓度均为0.1mol/L的NaCN和NaClO溶液的pH
D
常温下,向10mL0.1mol/LNaCl溶液中滴加5滴0.1mol/LAgNO3溶液,充分反应后,再滴加5滴0.1mol/LKI溶液,观察沉淀颜色变化
A、A B、B C、C D、D11. 利用有机分子模拟生物体内“醛缩酶”催化Diels-Alder反应取得重要进展,荣获2021年诺贝尔化学奖。某Diels-Alder反应催化机理如下,下列说法错误的是( )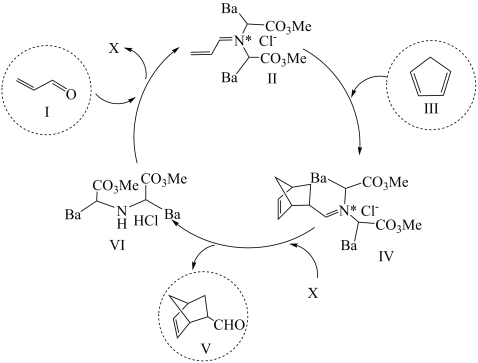 A、总反应为加成反应 B、Ⅰ和Ⅴ互为同系物 C、Ⅵ是反应的催化剂 D、化合物X为12. 湖北蕲春李时珍的《本草纲目》记载的中药丹参,其水溶性有效成分之一的结构简式如图。下列说法正确的是
A、总反应为加成反应 B、Ⅰ和Ⅴ互为同系物 C、Ⅵ是反应的催化剂 D、化合物X为12. 湖北蕲春李时珍的《本草纲目》记载的中药丹参,其水溶性有效成分之一的结构简式如图。下列说法正确的是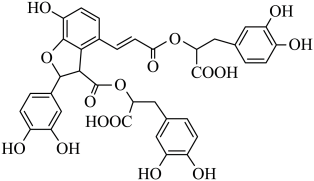 A、该物质属于芳香烃 B、可发生取代反应和氧化反应 C、分子中有5个手性碳原子 D、1mol该物质最多消耗9molNaOH13. 我国科学家最近发明了一种电池,电解质为、和KOH,通过a和b两种离子交换膜将电解质溶液隔开,形成M、R、N三个电解质溶液区域,结构示意图如下。下列说法不正确的是( )
A、该物质属于芳香烃 B、可发生取代反应和氧化反应 C、分子中有5个手性碳原子 D、1mol该物质最多消耗9molNaOH13. 我国科学家最近发明了一种电池,电解质为、和KOH,通过a和b两种离子交换膜将电解质溶液隔开,形成M、R、N三个电解质溶液区域,结构示意图如下。下列说法不正确的是( ) A、a为阳离子交换膜、b为阴离子交换膜 B、电子由Zn电极经过外电路流向电极 C、放电时,Zn电极反应为 D、消耗6.5gZn的同时,电极理论上应增重3.2g14. 在体积均为2L的恒容容器中,分别在200℃和T℃时,发生如下反应 , A的物质的量浓度(单位:mol/L)随时间变化的有关实验数据见下表:
A、a为阳离子交换膜、b为阴离子交换膜 B、电子由Zn电极经过外电路流向电极 C、放电时,Zn电极反应为 D、消耗6.5gZn的同时,电极理论上应增重3.2g14. 在体积均为2L的恒容容器中,分别在200℃和T℃时,发生如下反应 , A的物质的量浓度(单位:mol/L)随时间变化的有关实验数据见下表:时间/min
0
2
4
6
8
10
200℃
0.80
0.55
0.35
0.20
0.15
0.15
T℃
1.00
0.65
0.35
0.18
0.18
0.18
下列有关该反应的描述正确的是( )
A、在200℃时,4min内用B表示的化学反应速率为0.225mol/(L·min) B、T℃下,6min时反应刚好达到平衡状态 C、从表中可以看出T>200℃ D、在该题目条件下,无法判断正反应方向是否为放热反应15. 下图为和在水中达沉淀溶解平衡时的关系图(;可认为离子沉淀完全)。下列叙述正确的是 A、由点可求得 B、时的溶解度为 C、浓度均为的和可通过分步沉淀进行分离 D、混合溶液中时二者不会同时沉淀
A、由点可求得 B、时的溶解度为 C、浓度均为的和可通过分步沉淀进行分离 D、混合溶液中时二者不会同时沉淀二、实验题(12分)
-
16. 己二酸[HOOC(CH2)4COOH]是一种重要的工业原料,通常为白色结晶体,微溶于冷水,易溶于热水和乙醇。实验室以环己醇(
 )为原料制取己二酸实验流程如图:
)为原料制取己二酸实验流程如图:
已知:“氧化”过程发生的主要反应为:
 KOOC(CH2)4 COOK △H<0
KOOC(CH2)4 COOK △H<0该反应装置如图所示。

回答下列问题:
(1)、装置图中仪器A的名称为。(2)、“氧化”过程应采用____加热(填标号)。A、酒精灯 B、水浴 C、油浴 D、电炉(3)、“氧化”过程中,当环己醇滴速不同时,溶液温度随时间变化曲线如下图所示,实验过程中应选择的环己醇滴速为滴/min。 (4)、“氧化液”中加浓盐酸酸化时有气泡产生,推测该气体的成分有(填化学式)。(5)、已知:不同温度下,相关物质在水中的溶解度如下表:
(4)、“氧化液”中加浓盐酸酸化时有气泡产生,推测该气体的成分有(填化学式)。(5)、已知:不同温度下,相关物质在水中的溶解度如下表:物质
己二酸
氯化钠
氯化钾
25℃时溶解度/g
2.1
36.1
34.3
70℃时溶解度/g
68
37.8
48
100℃时溶解度/g
160
39.5
56.3
①己二酸晶体“洗涤”的方法为(填字母)。
A.用乙醇洗涤 B.用热水洗涤 C.用冷水洗涤
②除去己二酸晶体中含有的氯化钠杂质通常采取的实验方法为。
(6)、实验时称取10.0g环己醇(M=100g/mol),最终得到纯净的己二酸(M=146g/mol)晶体11.68g,则该实验中己二酸的产率为(保留两位有效数字)。三、工业流程题(14分)
-
17. 锗是重要的半导体材料,是一种“稀散金属”,如图是以中和渣(主要成分为GeO2、Fe2O3、ZnO、SiO2、CaSO4等)为原料生产二氧化锗的工艺流程:

已知:
①GeCl4的沸点:83℃,FeCl3的沸点:315℃。
②H2GeO3在高酸度时易聚合形成胶状多聚锗酸。
③常温下,部分金属阳离子转化为氢氧化物沉淀的pH见下表(离子浓度低于10-5 mol·L-1视为沉淀完全)。
离子
Fe3+
Zn2+
开始沉淀pH
2.2
6.2
完全沉淀pH
3.2
8.2
回答下列问题:
(1)、①“酸浸”时加热的目的是 , 浸渣的主要成分是。②测得相同时间内锗的浸出率与硫酸的物质的量浓度(mol·L-1)的关系如图所示。硫酸浓度过高,浸出率反而降低的原因是。
 (2)、常温下,若“沉锗”时用饱和NaOH溶液调pH=3.0,此时滤液中-lgc(Fe3+)为。(3)、“残余液”的溶质主要成分为 (填化学式)。(4)、“中和水解”的化学反应方程式为。(5)、纯度测定
(2)、常温下,若“沉锗”时用饱和NaOH溶液调pH=3.0,此时滤液中-lgc(Fe3+)为。(3)、“残余液”的溶质主要成分为 (填化学式)。(4)、“中和水解”的化学反应方程式为。(5)、纯度测定称取m g GeO2样品,在加热条件下溶解,用NaH2PO2将其还原为Ge2+ , 用c mol·L-1 KIO3标准溶液滴定,消耗KIO3标准溶液的平均体积为V mL,需选用的指示剂为 , 样品纯度为%。(实验条件下,NaH2PO2未被KIO3氧化)[已知:+H+Ge4++I-+H2O(未配平);]。
四、原理综合题(14分)
-
18. 近年来我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。因此将CO2转化为高附加值化学品成为科学家研究的重要课题。(1)、I.工业上在Cu -ZnO催化下利用CO2发生如下反应①来生产甲醇,同时伴有反应②发生。
①CO2(g) +3H2(g) ⇌ CH3OH(g)+ H2O(g) ΔH1
②CO2(g)+ H2(g) ⇌CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
已知:CO(g)+2H2(g) ⇌ CH3OH(g) ΔH = -90.6kJ·mol-1 , 则△H1= 。(2)、向密闭容器中加入CO2(g)和H2(g),合成CH3OH(g)。已知反应①的正反应速率可表示为v正=k正·c(CO2)·c3(H2),逆反应速率可表示为v逆=k逆·c(CH3OH)·c(H2O),其中k正、k逆为速率常数。如图中能够代表k逆的曲线为 (填“L1”“L2”“L3”或“L4”)。 (3)、不同条件下,按照n(CO2) : n(H2)=1 : 3投料,CO2的平衡转化率如图所示。
(3)、不同条件下,按照n(CO2) : n(H2)=1 : 3投料,CO2的平衡转化率如图所示。
①压强p1、p2、p3由大到小的顺序是。压强为p1 时,温度高于570 ℃之后,随着温度升高CO2平衡转化率增大的原因是。
②图中点M(500,60),此时压强p1为0.1 MPa,CH3OH的选择性为(选择性:转化的CO2中生成CH3OH占整个转化的CO2的百分比)。则该温度时反应①的平衡常数Kp=(MPa)-2(分压=总压×物质的量分数)。
(4)、II.电化学法还原二氧化碳制乙烯在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示:

阴极电极反应为 , 该装置中使用的是(填“阴”或“阳”)离子交换膜。
五、有机推断题(15分)
-
19. 阿斯巴甜(G)是一种广泛应用于食品工业的添加剂,一种合成阿斯巴甜(G)的路线如下:

已知如下信息:
①


②


回答下列问题:
(1)、A中官能团的名称是。(2)、A生成B反应的化学方程式为。(3)、D的结构简式为 , D生成E的反应中浓硫酸的作用是。(4)、E生成G的反应类型为。(5)、写出能同时满足下列条件的C的同分异构体的结构简式。①分子中含有苯环,且苯环上有两个取代基
②能与FeCl3溶液发生显色反应
③能在氢氧化钠溶液中发生水解反应,且含有苯环的水解产物的核磁共振氢谱只有一组峰
(6)、参照上述合成路线,设计以乙醛为起始原料制备聚丙氨酸的合成路线(无机试剂任选)。
-
-
-