福建省龙岩市2023-2024学年高三上学期期末考试化学试题
试卷更新日期:2024-03-21 类型:期末考试
一、选择题:本题共10小题,每小题4分,共40分。每小题只有一个选项符合题目要求。
-
1. 我国科学家首次成功精准合成了和。下列有关说法正确的是( )
 A、和均含有大键 B、和均为共价晶体 C、和互为同分异构体 D、和均可发生取代反应2. 一种治疗高血压药物的中间体结构如图。下列有关该物质的说法正确的是( )
A、和均含有大键 B、和均为共价晶体 C、和互为同分异构体 D、和均可发生取代反应2. 一种治疗高血压药物的中间体结构如图。下列有关该物质的说法正确的是( ) A、分子式为 B、含有手性碳原子 C、含有3种官能团 D、1mol该物质最多可与6molNaOH反应3. 某溶液中存在较多的、、 , 该溶液中还可能大量存在的离子是( )A、 B、 C、 D、4. 一种金属有机框架材料的化学式为 , 其结构如图。X、Y、Z、M为原子序数依次增大的1~36号元素,其中X、Z位于不同周期,四种元素中Y的第一电离能最大,的d轨道全充满。下列说法正确的是( )
A、分子式为 B、含有手性碳原子 C、含有3种官能团 D、1mol该物质最多可与6molNaOH反应3. 某溶液中存在较多的、、 , 该溶液中还可能大量存在的离子是( )A、 B、 C、 D、4. 一种金属有机框架材料的化学式为 , 其结构如图。X、Y、Z、M为原子序数依次增大的1~36号元素,其中X、Z位于不同周期,四种元素中Y的第一电离能最大,的d轨道全充满。下列说法正确的是( ) A、键角: B、最简单氢化物沸点:Z>Y>X C、电负性:X>Y>M D、最高价氧化物对应水化物酸性:Z>X5. 电还原空气污染物NO的转化路径如图。25℃,NH2OH的。为阿伏加德罗常数的值。下列说法错误的是( )
A、键角: B、最简单氢化物沸点:Z>Y>X C、电负性:X>Y>M D、最高价氧化物对应水化物酸性:Z>X5. 电还原空气污染物NO的转化路径如图。25℃,NH2OH的。为阿伏加德罗常数的值。下列说法错误的是( ) A、含有的质子数为 B、含有的键数为 C、路径①中生成11.2L(已折算为标准状况)时,转移电子数为 D、25℃,1LNH2OH和HCl混合液中,若 , 则数目为6. 下列实验探究方案能达到探究目的的是( )
A、含有的质子数为 B、含有的键数为 C、路径①中生成11.2L(已折算为标准状况)时,转移电子数为 D、25℃,1LNH2OH和HCl混合液中,若 , 则数目为6. 下列实验探究方案能达到探究目的的是( )选项
探究方案
探究目的
A
向中滴加少量酸性溶液,振荡,溶液褪色
中含有碳碳双键
B
向溶液中加入少量NaCl固体,振荡,溶液由蓝色变为黄绿色
配位键稳定性大于
C
向酸性溶液中加入相同体积不同浓度的NaOH溶液,浓度越大,溶液黄色越深
pH越大,化学反应速率越快
D
向碳酸钠溶液中滴加浓盐酸,将产生的气体通入苯酚钠溶液中,溶液变浑浊
碳酸的酸性大于苯酚
A、A B、B C、C D、D7. 利用为原料制备 , 涉及的物质转化关系如下: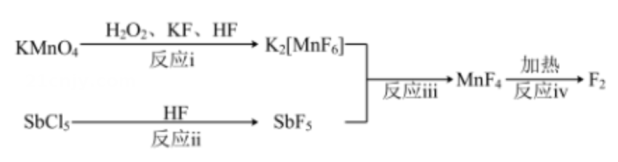
其中反应iii为。下列有关制备过程中的说法错误的是( )
A、反应i中为还原剂 B、键能:Sb-F>Sb-Cl C、Sb原子的价层电子对数发生变化 D、反应i~iv中有3个氧化还原反应8. 利用CaO焙烧浸出法从炼钢粉尘(主要含ZnO和)中回收Zn的流程如下:
已知:“焙烧”主要产物为ZnO、;“盐浸”滤液的主要成分为。下列说法错误的是( )
A、若略去“焙烧”操作,则“盐浸”过程无法浸出 B、“盐浸”过程发生反应为 C、“盐浸”时通入适量HCl气体,可提高锌浸出率 D、“电解”时通入适量HCl气体,有利于放电9. 利用丙酮酸与废水中的电催化耦合温和条件下去除和生产高值化丙氨酸,其工作原理如图。25℃,丙氨酸主要以 形式存在,其。下列说法错误的是( )
形式存在,其。下列说法错误的是( ) A、丙氨酸酸性很弱是因为形成了内盐 B、阴极的电极反应式为
A、丙氨酸酸性很弱是因为形成了内盐 B、阴极的电极反应式为 ++10e-+11H+=
++10e-+11H+= +4H2O
C、理论上阳极区每生成 , 阴极区减少4.4mol
D、该装置整合了电化学—化学—电化学串联反应
10. 用溶液分别滴定20.00mL丁酸、2-氯丁酸、3-氯丁酸,溶液pH随NaOH溶液体积变化如图。下列说法错误的是( )
+4H2O
C、理论上阳极区每生成 , 阴极区减少4.4mol
D、该装置整合了电化学—化学—电化学串联反应
10. 用溶液分别滴定20.00mL丁酸、2-氯丁酸、3-氯丁酸,溶液pH随NaOH溶液体积变化如图。下列说法错误的是( ) A、的数量级为 B、HZ为2-氯丁酸 C、b点: D、水的电离程度:c>b>a>d
A、的数量级为 B、HZ为2-氯丁酸 C、b点: D、水的电离程度:c>b>a>d二、非选择题:本题共4小题,共60分。
-
11. 从钒矿石(主要含、、及少量)中分离提取的流程如下:

已知:有机溶剂对萃取率高于;有机溶剂只萃取Fe(Ⅲ)不萃取Fe(Ⅱ)。
(1)、“焙烧”过程中转化为 , 该反应的还原剂为。(2)、“酸浸”过程中将转化为 , 该反应的离子方程式为。(3)、为提高钒的萃取率和纯度,“操作X”中M和N可分别选择____(填标号)。A、、Fe B、Fe、 C、、H2O2(4)、以HA( )和HB(
)和HB( )“协同萃取”,其主要萃取物结构如图。
)“协同萃取”,其主要萃取物结构如图。
①HA和HB可通过两个氢键形成环状二聚体,其结构示意图为。
②比更稳定的原因为。
(5)、“氧化”过程中转化为的离子方程式为。(6)、“氧化”后的溶液中 , 为了使沉钒率达到98%,加入氯化铵(设溶液体积增加1倍),“沉钒”时应控制溶液中不低于。[25℃时,](7)、的晶胞如图(晶胞参数:;)。为阿伏加德罗常数的值。
①的配位数为。
②位于构成的空隙中(填标号)。
A.八面体 B.四面体 C.平面三角形
③该晶胞的密度为(用含的代数式表示)。
12. 以和丙烯酸合成-巯基丙酸( , 沸点为130℃)的过程如下。(1)、制备的四氢呋喃(THF)溶液,实验装置如图。
①将浓硫酸稀释成30%硫酸的实验操作为。
②下列措施有利于提高吸收率的是(填标号)。
A.缓慢滴加30%硫酸 B.快速滴加30%硫酸
C.水浴X使用热水浴 D.水浴X使用冰水浴
③该装置存在的不足之处是。
(2)、合成-巯基丙酸的实验过程如下:将上述所得溶液转移至反应容器内,依次加入0.3mol丙烯酸、3.0mmol离子液体催化剂ILs,密封反应器后于90℃水浴恒温反应一段时间。其反应机理如图。
①
 中N1结合的孤电子对所处的原子轨道为。
中N1结合的孤电子对所处的原子轨道为。②虚线框内中间产物的结构简式为。
③若反应时间过长,-巯基丙酸与丙烯酸会进一步发生上述反应,其产物的结构简式为。
(3)、分离产物与催化剂的实验流程如下。
①操作1、操作2依次为、。
②操作3是通过加入适当浓度的、溶液来提纯分离,其原理是。
13. 神经病理性疼痛治疗药物米洛巴林苯磺酸盐的部分合成路线如下:
已知:
(1)、A的结构简式为。(2)、B中所含官能团名称为。(3)、 的系统命名为;Ⅲ的反应类型为。 (4)、V的化学方程式为。(5)、米洛巴林的一种同分异构体F,同时满足下列条件:
的系统命名为;Ⅲ的反应类型为。 (4)、V的化学方程式为。(5)、米洛巴林的一种同分异构体F,同时满足下列条件:①属于芳香族化合物且能与发生显色反应;
②核磁共振氢谱有四组峰,峰面积之比为。
则F的结构简式为。
(6)、Ⅵ为成盐反应,其目的是将米洛巴林转化为米洛巴林苯磺酸盐。①米洛巴林中能与苯磺酸反应的官能团为 , 从结构角度分析其能与苯磺酸反应的原因是。
②熔点:米洛巴林米洛巴林苯磺酸盐(填“>”“<”或“=”)。
(7)、参照上述合成路线,设计由 和制备
和制备 的合成路线。 14. 利用甲醇催化脱氢法制备甲酸甲酯涉及到如下化学反应:
的合成路线。 14. 利用甲醇催化脱氢法制备甲酸甲酯涉及到如下化学反应:反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)、。(2)、250℃,向密闭容器中通入 , 恒压条件下进行反应Ⅰ。①下列有关说法正确的是(填标号)。
A.高温有利于反应Ⅰ自发
B.说明该反应体系达到平衡状态
C.温度升高有利于提高的平衡转化率
D.通过增大分压可以提高的平衡产率
②要缩短达到平衡的时间,可采取的措施有。
③250℃,测得体系中反应Ⅰ的平衡转化率和进料时甲醇的分压(分压=总压×物质的量分数)关系如图。M点kPa(计算结果保留2位小数,下同);该反应的平衡常数kPa(为以分压表示的平衡常数)。
 (3)、一种在上高度分散的铜颗粒催化剂()制备方法如下。CuO(w%)+酸性硅溶胶(),为测试催化剂性能,将甲醇蒸汽以的流速通过负载的催化反应器,甲醇转化率和甲酸甲酯选择性随w%、反应温度的变化如图。
(3)、一种在上高度分散的铜颗粒催化剂()制备方法如下。CuO(w%)+酸性硅溶胶(),为测试催化剂性能,将甲醇蒸汽以的流速通过负载的催化反应器,甲醇转化率和甲酸甲酯选择性随w%、反应温度的变化如图。①如图,当w%=15%时,生成甲酸甲酯的反应速率为(列计算式)。

②最适合的反应温度为(填标号)。
A.553K B.563K C.573K D.583K
③如图,当温度高于563K时,甲酸甲酯选择性下降的可能原因为。
