专题三 混合物质的阶段性反应--【高效二轮复习】2023-2024学年中考科学二轮复习(浙教版)
试卷更新日期:2024-03-21 类型:二轮复习
一、选择题
-
1. 图像能直观体现化学中的各种变化关系,下列图象中,能正确反映对应变化关系的是( )A、
 将等质量的锌粉、铁粉分别放入盛有足量且相同浓度稀盐酸的容器中
B、
将等质量的锌粉、铁粉分别放入盛有足量且相同浓度稀盐酸的容器中
B、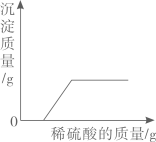 向NaOH和BaCl2的混合溶液中滴加H2SO4溶液
C、
向NaOH和BaCl2的混合溶液中滴加H2SO4溶液
C、 实验室的浓硫酸、浓盐酸敞口放置一段时间
D、
实验室的浓硫酸、浓盐酸敞口放置一段时间
D、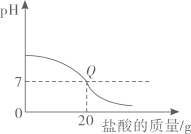 向20g10%氢氧化钠溶液中逐滴滴入7.3%的稀盐酸(Q点表示恰好完全反应)
2. 现有盐酸和氯化钡的混合溶液,向其中逐滴滴入碳酸钠溶液,生成沉淀质量与滴入碳酸钠溶液质量的变化关系如下图所示。下列说法正确的是( )
向20g10%氢氧化钠溶液中逐滴滴入7.3%的稀盐酸(Q点表示恰好完全反应)
2. 现有盐酸和氯化钡的混合溶液,向其中逐滴滴入碳酸钠溶液,生成沉淀质量与滴入碳酸钠溶液质量的变化关系如下图所示。下列说法正确的是( ) A、滴加碳酸钠溶液质量为0~a克时,溶液中发生的反应为BaCl2+Na2CO3=2NaCl+BaCO3↓ B、滴加碳酸钠溶液质量至a克时,溶液中含有三种溶质 C、滴加碳酸钠溶液质量为a~c克时,有气体产生 D、滴加碳酸钠溶液质量至c克时,溶液呈中性3. 小科在实验室中制取CO2气体后,对废液进行后续探究。他向一定量的含CaCl2和HCl的废液中逐滴加入质量分数为10%的Na2CO3溶液。实验过程中加入Na2CO3溶液质量与产生沉淀或气体的质量关系如图1所示;加入的Na2CO3溶液质最与溶液的pH变化关系如图2所示。下列说法正确的是( )
A、滴加碳酸钠溶液质量为0~a克时,溶液中发生的反应为BaCl2+Na2CO3=2NaCl+BaCO3↓ B、滴加碳酸钠溶液质量至a克时,溶液中含有三种溶质 C、滴加碳酸钠溶液质量为a~c克时,有气体产生 D、滴加碳酸钠溶液质量至c克时,溶液呈中性3. 小科在实验室中制取CO2气体后,对废液进行后续探究。他向一定量的含CaCl2和HCl的废液中逐滴加入质量分数为10%的Na2CO3溶液。实验过程中加入Na2CO3溶液质量与产生沉淀或气体的质量关系如图1所示;加入的Na2CO3溶液质最与溶液的pH变化关系如图2所示。下列说法正确的是( )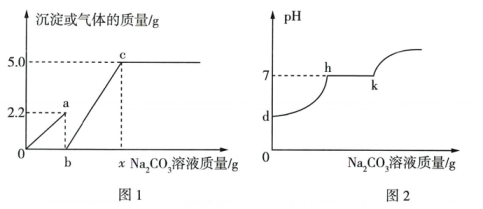 A、图1中0a段表示生成沉淀的过程 B、图1中b点的值为5.3 C、图1中c点对应的溶液中的溶质只有一种 D、图1中be段反应过程中溶液的pH变化情况可用图2中dh段表示4. 向盛有一定量铜和CaCO3混合物的烧杯中滴加稀盐酸,边滴边搅拌,反应过程中剩余固体的质量与加入稀盐酸的质量关系如图所示。下列说法不正确的是( )
A、图1中0a段表示生成沉淀的过程 B、图1中b点的值为5.3 C、图1中c点对应的溶液中的溶质只有一种 D、图1中be段反应过程中溶液的pH变化情况可用图2中dh段表示4. 向盛有一定量铜和CaCO3混合物的烧杯中滴加稀盐酸,边滴边搅拌,反应过程中剩余固体的质量与加入稀盐酸的质量关系如图所示。下列说法不正确的是( ) A、M点时,剩余固体是铜和CaCO3 B、M、N点时,溶液中的溶质均只有CaCl2 C、混合物中铜的质量为(a-b)g D、P点时,溶液中溶质有两种5. 向一定质量的Na2CO3溶液中滴加一定质量的Ba(OH)2溶液,反应一段时间后改为滴加Ca(OH)2溶液,当恰好不再产生沉淀时,再滴加稀盐酸至沉淀消失。反应过程中产生沉淀的质量与加入物质的质量关系如图所示。下列说法错误的是( )
A、M点时,剩余固体是铜和CaCO3 B、M、N点时,溶液中的溶质均只有CaCl2 C、混合物中铜的质量为(a-b)g D、P点时,溶液中溶质有两种5. 向一定质量的Na2CO3溶液中滴加一定质量的Ba(OH)2溶液,反应一段时间后改为滴加Ca(OH)2溶液,当恰好不再产生沉淀时,再滴加稀盐酸至沉淀消失。反应过程中产生沉淀的质量与加入物质的质量关系如图所示。下列说法错误的是( ) A、a点溶液中溶质只有NaOH B、c﹣d段发生反应的化学方程式为NaOH+HCl═NaCl+H2O C、整个过程溶液中的溶质种类最多含有3种 D、d﹣e段有气泡产生6. 相同质量的Mg、Fe、Zn三种金属,分別与足量的、质量相同、质量分数相同的稀H2SO4充分反应,生成氢气与消耗稀H2SO4的质量关系如图,所得的结论与事实相符的是:( )
A、a点溶液中溶质只有NaOH B、c﹣d段发生反应的化学方程式为NaOH+HCl═NaCl+H2O C、整个过程溶液中的溶质种类最多含有3种 D、d﹣e段有气泡产生6. 相同质量的Mg、Fe、Zn三种金属,分別与足量的、质量相同、质量分数相同的稀H2SO4充分反应,生成氢气与消耗稀H2SO4的质量关系如图,所得的结论与事实相符的是:( ) A、三种金属消耗稀H2SO4的质量:Mg<Fe<Zn B、三种金属的失去电子总数量:Mg>Fe>Zn C、三种金属的活动性顺序:Mg=Fe=Zn D、三种金属与稀H2SO4反应后溶液的质量:Mg>Fe>Zn7. 向硫酸铜和稀硫酸的混合溶液中滴加氢氧化钡溶液。生成沉淀质量与滴加的氢氧化钡质量的关系如右图所示。下列说法正确的是( )
A、三种金属消耗稀H2SO4的质量:Mg<Fe<Zn B、三种金属的失去电子总数量:Mg>Fe>Zn C、三种金属的活动性顺序:Mg=Fe=Zn D、三种金属与稀H2SO4反应后溶液的质量:Mg>Fe>Zn7. 向硫酸铜和稀硫酸的混合溶液中滴加氢氧化钡溶液。生成沉淀质量与滴加的氢氧化钡质量的关系如右图所示。下列说法正确的是( )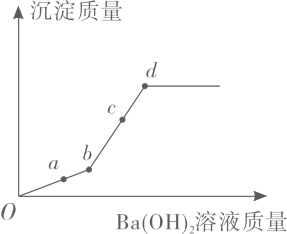 A、若向a点溶液滴加酚酞试剂,溶液变红 B、b点有两种沉淀 C、c点所得溶液中的溶质只有CuSO4 D、d点时烧杯中只有四种物质8. 取1.4g铁粉于烧杯中,加溶质质量分数为10%的AgNO₃溶液100g,充分反应后,再不断缓慢加入锌粉,烧杯中相关量与所加锌的质量的关系图正确的是( )A、
A、若向a点溶液滴加酚酞试剂,溶液变红 B、b点有两种沉淀 C、c点所得溶液中的溶质只有CuSO4 D、d点时烧杯中只有四种物质8. 取1.4g铁粉于烧杯中,加溶质质量分数为10%的AgNO₃溶液100g,充分反应后,再不断缓慢加入锌粉,烧杯中相关量与所加锌的质量的关系图正确的是( )A、 B、
B、 C、
C、 D、
D、 9. 图像是一种表示方法,也是了解化学反应的“窗口”,我们可通过建立图像法来表示化学反应过程中物质间的量的相互关系。现一烧杯中含有HCl和CuCl2的混合液,现将一定质量分数的氢氧化钠溶液加入到混合液中直至过量(CuCl2溶液看成中性),则反应中各个量的关系图正确的是( )
9. 图像是一种表示方法,也是了解化学反应的“窗口”,我们可通过建立图像法来表示化学反应过程中物质间的量的相互关系。现一烧杯中含有HCl和CuCl2的混合液,现将一定质量分数的氢氧化钠溶液加入到混合液中直至过量(CuCl2溶液看成中性),则反应中各个量的关系图正确的是( ) A、甲、乙、丁 B、乙、丙、丁 C、甲、丙 D、甲10. 用一小块未打磨过的铝片和一定质量的稀盐酸反应,产生气泡的快慢和反应时间的关系如图所示。待实验结束后,发现试管底部出现了灰色沉淀。为了初步判断灰色沉淀的成分,往上述试管中继续滴加稀盐酸,观察到沉淀溶解并有气泡生成。下列推理正确的有( )
A、甲、乙、丁 B、乙、丙、丁 C、甲、丙 D、甲10. 用一小块未打磨过的铝片和一定质量的稀盐酸反应,产生气泡的快慢和反应时间的关系如图所示。待实验结束后,发现试管底部出现了灰色沉淀。为了初步判断灰色沉淀的成分,往上述试管中继续滴加稀盐酸,观察到沉淀溶解并有气泡生成。下列推理正确的有( )
①0~t1阶段,铝的氧化物与稀盐酸反应
②t1~t2阶段,铝和稀盐酸反应生成气体
③t3~t4阶段,稀盐酸过量生成气体量减少
④实验结束后试管底部出现的灰色沉淀是铝
A、①② B、①②④ C、①③④ D、②③④11. 蚀刻印刷电路后的溶液为FeCl3、FeCl2 和CuCl2的混合溶液。如图是向200g该溶液中加入铁粉的质量与溶液质量变化的关系。已知0→a段发生的反应为: 2FeCl3+Fe=3FeCl2。下面说法正确的是( )
 A、a→b段发生的反应为2Fe+3CuCl2=3Cu+2FeCl3 B、x=11.2 C、原溶液中FeCl3与CuCl2的质量之比为52:81 D、取出c点溶液中的固体,投入足量CuCl2溶液,可得25.6克Cu12. 将锌粉持续加入到100g含有AgNO3和Cu(NO3)2两种溶质的混合溶液中,充分反应。当加入锌粉的质量为6.5g时,溶液质量最小;当加入锌粉的质量为13.0g时,恰好完全反应。下列是反应中的相关量随加入锌的质量变化的关系图,正确的是( )A、
A、a→b段发生的反应为2Fe+3CuCl2=3Cu+2FeCl3 B、x=11.2 C、原溶液中FeCl3与CuCl2的质量之比为52:81 D、取出c点溶液中的固体,投入足量CuCl2溶液,可得25.6克Cu12. 将锌粉持续加入到100g含有AgNO3和Cu(NO3)2两种溶质的混合溶液中,充分反应。当加入锌粉的质量为6.5g时,溶液质量最小;当加入锌粉的质量为13.0g时,恰好完全反应。下列是反应中的相关量随加入锌的质量变化的关系图,正确的是( )A、 B、
B、 C、
C、 D、
D、 13. 向盛有10g49%稀硫酸的烧杯中加入5.6g的铁粉,充分反应后有固体残留,t1时迅速倒入一定量的硫酸铜溶液。整个过程烧杯中溶液的质量随时间的变化如图所示,下列分析不正确的是( )
13. 向盛有10g49%稀硫酸的烧杯中加入5.6g的铁粉,充分反应后有固体残留,t1时迅速倒入一定量的硫酸铜溶液。整个过程烧杯中溶液的质量随时间的变化如图所示,下列分析不正确的是( ) A、a→b点,溶液的pH一直增大 B、m=12.7g C、c点时,烧杯中有4种物质 D、d点固体,加入盐酸有气泡产生14. 在5.6g铁粉中,先逐滴加入一定量的Cu(NO3)2溶液, 充分反应后再逐滴加入AgNO3溶液,剩余固体质量与所加溶液总质量的关系如图所示。下列说法正确的是( )
A、a→b点,溶液的pH一直增大 B、m=12.7g C、c点时,烧杯中有4种物质 D、d点固体,加入盐酸有气泡产生14. 在5.6g铁粉中,先逐滴加入一定量的Cu(NO3)2溶液, 充分反应后再逐滴加入AgNO3溶液,剩余固体质量与所加溶液总质量的关系如图所示。下列说法正确的是( )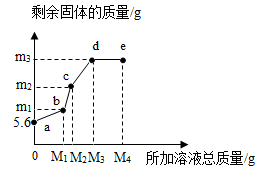 A、所加溶液质量为M1g时,生成Cu的质量为m1g B、bc段发生的是Cu和AgNO3溶液的反应 C、m3的值为21.6 D、e点溶液中不含Cu(NO3)2
A、所加溶液质量为M1g时,生成Cu的质量为m1g B、bc段发生的是Cu和AgNO3溶液的反应 C、m3的值为21.6 D、e点溶液中不含Cu(NO3)2二、填空题
-
15. 将一定质量的锌粉加入到硝酸铜、硝酸银和硝酸铝的混合溶液中。如图是盛放混合溶液的烧杯中間体质量在反应过程中的变化情况。
 (1)、写出ab段发生反应的化学方程式:。(2)、bc段固体质量减少的原因是:。(3)、请分析并解释cd段烧杯内溶液质量的变化情况:。16. 向一定质量的CaCl2和HCl的混合溶液中逐滴加入Na2CO3溶液,并振荡。如图表示反应过程中溶液质量随加入Na₂CO3溶液质量的变化情况。图线AB段对应的实验现象是 , 在C点时溶液中的溶质是。
(1)、写出ab段发生反应的化学方程式:。(2)、bc段固体质量减少的原因是:。(3)、请分析并解释cd段烧杯内溶液质量的变化情况:。16. 向一定质量的CaCl2和HCl的混合溶液中逐滴加入Na2CO3溶液,并振荡。如图表示反应过程中溶液质量随加入Na₂CO3溶液质量的变化情况。图线AB段对应的实验现象是 , 在C点时溶液中的溶质是。 17. 向一定质量的CaCl2和HCl的混合溶液中逐滴加入Na2CO3溶液,并振荡。如图表示反应过程中溶液质量随加入Na2CO3溶液质量的变化情况。图线AB段对应的实验现象是 , 在C点时溶液中的溶质是。
17. 向一定质量的CaCl2和HCl的混合溶液中逐滴加入Na2CO3溶液,并振荡。如图表示反应过程中溶液质量随加入Na2CO3溶液质量的变化情况。图线AB段对应的实验现象是 , 在C点时溶液中的溶质是。 18. 农业上可用熟石灰改良酸性土壤。某小组做了Ca(OH)2溶液和稀盐酸反应的相关实验探究,如图所示。
18. 农业上可用熟石灰改良酸性土壤。某小组做了Ca(OH)2溶液和稀盐酸反应的相关实验探究,如图所示。 (1)、甲中酸与碱反应的化学方程式为 , 若酸碱恰好完全中和,观察到的实验现象是。(2)、往乙反应结束后的溶液中滴加质量分数为26.5%的Na2CO3溶液(如丙),溶液pH的变化如图丁所示。ab段反应结束后,b点对应溶液中所含的溶质为(填化学式)。(3)、丙实验结束后,产生沉淀的质量为g。c点后pH逐渐增大的原因是。
(1)、甲中酸与碱反应的化学方程式为 , 若酸碱恰好完全中和,观察到的实验现象是。(2)、往乙反应结束后的溶液中滴加质量分数为26.5%的Na2CO3溶液(如丙),溶液pH的变化如图丁所示。ab段反应结束后,b点对应溶液中所含的溶质为(填化学式)。(3)、丙实验结束后,产生沉淀的质量为g。c点后pH逐渐增大的原因是。三、计算题
-
19. 兴趣小组为了探究实验室中久置的NaOH的变质程度,具体如下:
【研究方案】先称取13.3g的NaOH样品(杂质为Na2CO3)配成溶液,然后向溶液中逐滴加入质量分数为14.6%的稀盐酸,根据生成CO2的质量测定Na2CO3的质量。从而进一步确定样品中NaOH的变质程度。
【解决问题】实验测得加入稀盐酸的质量与产生CO2气体的质量关系如图所示,样品中NaOH的质量分数是多少?(结果精确到0.1%)
 (1)、【继续探究】求实验过程中与NaOH反应所用的盐酸的质量是多少?(2)、【发现问题】根据图像推测在100克10.6%碳酸钠溶液中逐滴加入盐酸溶液的下列图像合理的是。
(1)、【继续探究】求实验过程中与NaOH反应所用的盐酸的质量是多少?(2)、【发现问题】根据图像推测在100克10.6%碳酸钠溶液中逐滴加入盐酸溶液的下列图像合理的是。 20. 实验室用金属镁与100g盐酸反应探究酸的性质。小宁取反应后的溶液,逐渐加入溶质质量分数为8%的NaOH溶液,产生沉淀质量与滴加溶液的质量关系如图所示。已知当NaOH溶液滴加至150g时不再有沉淀产生。求:
20. 实验室用金属镁与100g盐酸反应探究酸的性质。小宁取反应后的溶液,逐渐加入溶质质量分数为8%的NaOH溶液,产生沉淀质量与滴加溶液的质量关系如图所示。已知当NaOH溶液滴加至150g时不再有沉淀产生。求: (1)、0.58g沉淀的成分为 。(2)、a点时,与NaOH反应的物质化学式 。(3)、若在b点溶液中加AgNO3溶液,出现白色沉淀 (填“能”或“不能”)证明HCl有剩余;(4)、计算100g稀盐酸的溶质质量分数。21. 小龙用过量的稀盐酸溶液和石灰石反应制取二氧化碳后(石灰石中的杂质既不溶于水也不和酸反应),得到了含有盐酸和氯化钙的混合溶液。为了探究该混台溶液中氮化钙的质量。他又进行如下实验:取一定量的混合溶液于烧杯中,逐滴滴入碳酸钠溶液,观察并记录相应数据。结果如图所示。
(1)、0.58g沉淀的成分为 。(2)、a点时,与NaOH反应的物质化学式 。(3)、若在b点溶液中加AgNO3溶液,出现白色沉淀 (填“能”或“不能”)证明HCl有剩余;(4)、计算100g稀盐酸的溶质质量分数。21. 小龙用过量的稀盐酸溶液和石灰石反应制取二氧化碳后(石灰石中的杂质既不溶于水也不和酸反应),得到了含有盐酸和氯化钙的混合溶液。为了探究该混台溶液中氮化钙的质量。他又进行如下实验:取一定量的混合溶液于烧杯中,逐滴滴入碳酸钠溶液,观察并记录相应数据。结果如图所示。
(反应原理: Na2CO3+2HCl=2NaCl+2H2O+CO2↑;
Na2CO3+CaCl2=2NaCl+CaCO3↓)
(1)、小龙发现碳酸钠溶液与混合溶液反应时存在多步反应,则a曲线代表的是碳酸钠与反应,并说明理由。(2)、请根据图中数据,计算所取混合溶液中氯化钙的质量。(3)、图中n=。22. 小乐了解到某种胃药中主要成分是碳酸氢钠和氢氧化铝(其他杂质不与盐酸反应但能溶于水),他想测量该胃药中碳酸氢钠的含量,为此他设计如下实验。取10g该胃药粉末置于烧杯中,逐滴加入质量分数为7.3%的稀盐酸,在相同的时间间隔内记录并描出烧杯中物质质量的变化如图甲,其中b点胃药粉末全部溶解。查阅资料:氯化铝会与碳酸氢钠反应生成氢氧化铝。
发生反应的化学方程式:NaHCO3+HCl═NaCl+H2O+CO2↑,Al(OH)3+3HCl=AlCl3+3H2O
(1)、在a点时,溶液中的溶质有 。(2)、胃药中碳酸氢钠的质量是多少?(写出计算过程)(3)、请在图乙中画出溶液中氯化铝的质量变化的大致趋势。