浙教版初中科学八年级下册2.5表示元素的符号 提升卷
试卷更新日期:2024-03-20 类型:同步测试
一、选择题
-
1. 根据下表提供的信息,下列判断正确的是
 A、同一周期元素的最外层电子数相同 B、钠离子核外有三个电子层 C、第二、三周期元素的原子从左到右最外层电子数逐渐增多 D、在化学变化中镁元素容易失去最外层的2个电子形成镁离子,其离子符号是Mg+22. 某元素的原子失去 1个电子后形成的粒子与Ne具有相同的核外电子数。下列说法中,正确的是 ( )A、该元素位于元素周期表第二周期 B、该粒子为阴离子 C、该粒子核电荷数为 10 D、该粒子带正电3. 下列符号中,不具有宏观意义,只具有微观意义的是 ( )A、Cu B、N₂ C、2H₂O D、HCl4. 化学中元素符号能表示一定的意义,不同的元素符号表示的意义不同。下列对元素符号表示的意义解释正确的是 ( )A、H 只表示氢元素 B、Fe 表示铁元素,表示一个铁原子,表示铁这种物质 C、N 只表示一个氮原子 D、O 表示氧元素,表示一个氧原子,表示氧气这种物质5.
A、同一周期元素的最外层电子数相同 B、钠离子核外有三个电子层 C、第二、三周期元素的原子从左到右最外层电子数逐渐增多 D、在化学变化中镁元素容易失去最外层的2个电子形成镁离子,其离子符号是Mg+22. 某元素的原子失去 1个电子后形成的粒子与Ne具有相同的核外电子数。下列说法中,正确的是 ( )A、该元素位于元素周期表第二周期 B、该粒子为阴离子 C、该粒子核电荷数为 10 D、该粒子带正电3. 下列符号中,不具有宏观意义,只具有微观意义的是 ( )A、Cu B、N₂ C、2H₂O D、HCl4. 化学中元素符号能表示一定的意义,不同的元素符号表示的意义不同。下列对元素符号表示的意义解释正确的是 ( )A、H 只表示氢元素 B、Fe 表示铁元素,表示一个铁原子,表示铁这种物质 C、N 只表示一个氮原子 D、O 表示氧元素,表示一个氧原子,表示氧气这种物质5.全球近140个国家将根据签署的《国际防治汞污染公约》,在2020年前禁止生产和出口含汞产品,如电池、荧光灯、化妆品、温度计、血压计等,分析如图判断关于汞元素的相关信息正确的是( )
 A、汞的化学式为Hg B、汞原子的质量为200.6g C、汞原子的中子数是80 D、汞为非金属元素6. 用数轴表示某些化学知识直观、简明、易记,下列数轴表示错误的是( )A、地壳中元素含量由高到低
A、汞的化学式为Hg B、汞原子的质量为200.6g C、汞原子的中子数是80 D、汞为非金属元素6. 用数轴表示某些化学知识直观、简明、易记,下列数轴表示错误的是( )A、地壳中元素含量由高到低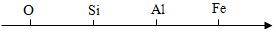 B、不同种原子的原子序数依次递增
B、不同种原子的原子序数依次递增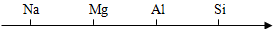 C、空气中气体体积分数由大到小
C、空气中气体体积分数由大到小 D、含氮物质中氮元素的化合价从低到高
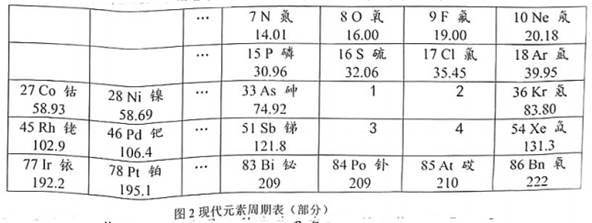
D、含氮物质中氮元素的化合价从低到高 7. 下列说法中错误的是( )A、Cl既可以表示氯元素,也可以表示一个氯原子 B、在化学变化中,分子可以再分,原子不能再分 C、石墨和金刚石都是由碳元素组成的,所以石墨和金刚石混在一起的物质是纯净物 D、NO2中的“2”表示一个二氧化氮分子中有两个氧原子8. 元素周期表将已知元素科学有序地排列起来,便于我们研究它们的性质和用途。下表是元素周期表的一部分,以下说法正确的是( )
7. 下列说法中错误的是( )A、Cl既可以表示氯元素,也可以表示一个氯原子 B、在化学变化中,分子可以再分,原子不能再分 C、石墨和金刚石都是由碳元素组成的,所以石墨和金刚石混在一起的物质是纯净物 D、NO2中的“2”表示一个二氧化氮分子中有两个氧原子8. 元素周期表将已知元素科学有序地排列起来,便于我们研究它们的性质和用途。下表是元素周期表的一部分,以下说法正确的是( )H
He
①
N
②
Ne
③
Ar
A、①和②处于同一族 B、表中不同种元素最本质的区别是中子数不同 C、表中②所代表元素是金属元素 D、元素符号是N的原子核外电子数是7个9. 正确使用和理解化学用语是重要的学科素养,下列说法中正确的是( )A、H2S、H2O、H2三种物质中都含有氢分子 B、H2SO3和H2SO4中硫元素的化合价相同 C、Na+、Mg2+、Al3+原子核内质子数均为10 D、由Na和K在元素周期表中的位置得出,钠元素和钾元素的化学性质相似10. 化学用语是学习科学的重要工具,对①~⑤表示的有关化学用语含义的叙述正确的是( )①N ②Fe ③Fe2+ ④H2O ⑤NaCl
A、③表示铁离子 B、能表示一个分子的有①②④⑤ C、②和③属于同种元素 D、④表示H2O由2个氢元素和1个氧元素组成二、填空题
-
11. 元素符号表示的意义(1)、宏观上表示 , 如“N”表示氮元素,“0”表示氧元素。每种元素只能有一种元素符号。(2)、微观上表示这种元素的 , 如“N”表示1个氮原子,“O”表示1个氧原子。
如果物质直接由原子构成,则该元素符号还表示一种物质,如“Fe”表示铁这种物质。
说明 若元素符号前面有数字,则只能表示该元素的几个原子(即只有微观含义)。如:“3H”只能表示3个氢原子,“6Fe”只能表示6个铁原子。
12. 用元素符号或化学式表示下列物质或微粒:5个钾原子:;2个氮气分子:;
3个氯离子:;硫酸亚铁:。
13. 生活中的广告与化学联系密切,请欣赏以下两则广告:①黄金搭档,花一样钱补五样;
②葡萄糖酸锌口服溶液,蓝瓶的,好喝的。
请填写下列空白:
黄金搭档所补五样是指:钙(元素符号为)、铁、锌、硒、维生素。其中前四样是指人体需要这四样(填“单质”“离子”或“元素”)。
14. 根据相对原子质量来研究元素,始于19世纪初。1829年,德国化学家德贝纳提出了锂钠钾、钙锶钡、磷砷锑、氯溴碘等15种元素,他把这些元素称为“三元素组”。
1864年,德国化学家迈耶,按相对原子质量递增顺序制定了一个“六元素表”。
1865年,英国化学家纽兰兹按相对原子质量递增顺序,将已知元素作了排列。发现第八个元素就与第一个元素性质相似(元素的排列每逢八就出现周期性)。这好像音乐上的八个音阶一样重复出现,于是提出“八音律”的理论(下表是“八音律表”的前部分)。
H
Li
G
Bo
C
N
O
F
Na
Mg
Al
Si
P
S
1869年,俄罗斯化学家门捷列夫对当时已知的63种元素的相对原子质量和物理性质(熔点、密度等)进行了比较,直到19世纪末才制成了第一张元素周期表。事实上,在1869年,德国的迈耶和俄国的门捷列夫几乎同时发现了元素周期律。分析上述科学史料,并结合当代的元素周期表的相关知识回答:
(1)、根据纽兰兹“八音律表”,与Na化学性质相似的元素是(2)、分析上述科学史料,结合所学知识,判断下列观点不正确的有 (可多选)。A、研究复杂的现象往往需要寻找规律,有时还要会用简单的方法表述复杂的问题。 B、纽兰兹的“八音律表”中没有稀有元素,说明他的理论是错误的,起不到任何作用。 C、科学家是在制成了第一张元素周期表后才最终发现了元素周期律。 D、随着科学的进步,我们现在所学的元素周期表已包含所有元素。15. 如图甲是元素周期表的一部分,如果表中的相应空格内各有核电荷数为1~18的元素,其中Ⅱ位置中的元素如图乙所示,回答下列问题: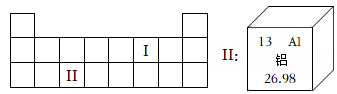 (1)、图甲中排在Ⅰ位置的元素X,下列说法正确的是 (填序号)。A、“X2”的相对分子质量为32g B、“X2”既能表示两个原子,也能表示一种气体 C、“2X”可以表示两个分子 D、“X”既能表示一种元素,也能表示一个原子(2)、图乙中,数字“13”表示铝元素的。
(1)、图甲中排在Ⅰ位置的元素X,下列说法正确的是 (填序号)。A、“X2”的相对分子质量为32g B、“X2”既能表示两个原子,也能表示一种气体 C、“2X”可以表示两个分子 D、“X”既能表示一种元素,也能表示一个原子(2)、图乙中,数字“13”表示铝元素的。三、实验探究题
-
16. 为纪念门捷列夫发明的元素周期表诞生150周年,联合国大会宣布2019年是“国际化学元素周期表年”。
材料一:门捷列夫将元素按照相对原子质量从小到大排列后,发现元素的化学性质成周期性出现,故将相似化学性质的元素排在同一列。
材料二:门捷列夫无可非议地成为元素周期律的主要发现者,因为门捷列夫的元素周期表有强大的预测功能。
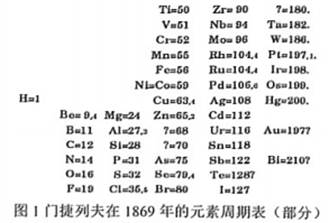
材料三:氟是一种非金属化学元素,氟元素的单质是F2 , 它是一种淡黄色有剧毒的气体。氟气的腐蚀性很强,化学性质极为活泼,是氧化性最强的物质之一。
硫是一种非金属元素,通常单质硫是黄色的品体。硫元素在自然界中通常以化合物或单质的形式存在。硫单质难溶于水,微溶于酒精对人体而言,单质硫通常是无毒无害的。
(1)、根据现代周期表的元素排布特点,下列哪两种元素的化学性质相似?( )A、F、Ne B、N、O C、N、S D、N、P(2)、结合材料中图1和图2,现在的元素周期表编制与门捷列夫的元素周期表排列规律有什么相矛盾的地方?(3)、溴是一种化学元素,相对原子质量是79.9, 溴单质是红黑色液体,溴蒸气具有腐蚀性,并且有毒。请你结合材料预测溴在图2元素周期表中的位置(选择标准序号),并说明理由。四、解答题
-
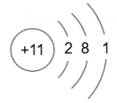
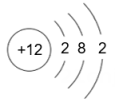
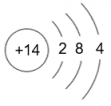
17. 下表为元素周期表中某一周期元素的原子结构示意图。
元素名称
钠
镁
铝
硅
元素符号
Na
Mg
Al
Si
原子结构示意图

元素名称
磷
硫
氯
氩
元素符号
P
S
Cl
Ar
原子结构示意图
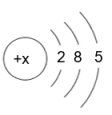
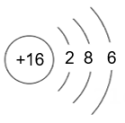
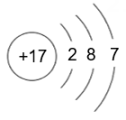
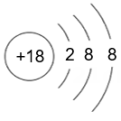
请回答下列问题。
(1)、表中磷原子的核电荷数x=。(2)、表中具有相对稳定结构的元素是。(3)、在化学反应中,每个铝原子失去个电子形成铝离子。(4)、上述元素在周期表中处于同一周期的原因是。(5)、硫与氧气的反应可用图表示:
设 N个氧气分子的质量为32g,则64g氧气与足量的硫粉完全反应生成的二氧化硫的分子个数为N。
18. 有A、B、C、D四种元素,已知A元素是人体中含量最多的元素,B元素的原子可以直接构成最坚硬的矿物单质,C元素的原子失去一个电子后只剩下一个质子,D+的电子层结构与氖原子相同。请回答下列问题。(1)、由A元素组成单质的化学式为。(2)、B元素的元素符号为。(3)、C元素的离子符号为。(4)、A、C、D三种元素组成化合物的化学式为。19. 如图所示为四名同学替4种元素进行的自我介绍,请你根据所学知识回答下列问题。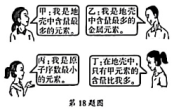 (1)、写出上述4种元素的元素符号。
(1)、写出上述4种元素的元素符号。甲: , 乙: ,
丙: , 丁:。
(2)、上述4种元素的根本区别是(填“质子数”或“中子数”)不同。20. 下图为元素周期表的一部分,请按要求填空: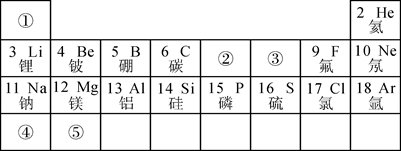 (1)、表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的相同。(2)、表中9号和17号元素最外层电子数相同,都易(填“得到”或“失去”)电子,则钠元素和氟元素组成的化合物的化学式为。(3)、请在表中①~⑤五种元素里选出三种元素组成一种常见的化合物,其化学式为。
(1)、表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的相同。(2)、表中9号和17号元素最外层电子数相同,都易(填“得到”或“失去”)电子,则钠元素和氟元素组成的化合物的化学式为。(3)、请在表中①~⑤五种元素里选出三种元素组成一种常见的化合物,其化学式为。
-