浙教版科学中考复习优中选优-化学-第18节-物质转化和鉴别
试卷更新日期:2024-03-13 类型:一轮复习
一、单选题
-
1. 下列物质间的转化不能实现的是( )A、 B、 C、 D、2. 下列各组物质中符合“酸、碱、盐、氧化物”顺序的是( )A、H2SO4、Na2O、MgCl2、C B、NaHCO3、Ba(OH)2、Na2CO3、Zn C、HNO3、KOH、Na2CO3、O2 D、HCl、KOH、Na2CO3、SiO23. 某混合气体可能含有H2、CO、CO2、HCl中的一种或几种,某同学采取实验进行检验:将混合气体先通入澄清石灰水时无明显现象产生,导出的气体通过浓硫酸后再通入放有炽热氧化铜粉末的试管,发现试管中有红色物质出现.最后将试管中导出的气体通入放有白色硫酸铜粉末的U形管,未见有明显现象产生。根据上述实验,可以判定该混合气体中一定没有( )A、H2 B、H2和CO2 C、CO D、H2、CO2和HCl4. 2005年诺贝尔化学奖的成果与一种新的化学合成方法有关。新的合成过程更简单快捷,产生的副产品和有害废物更少,原子利用率更高,是“绿色化学”的典范。下列反应中,符合以上“绿色化学”概念的是( )A、烧制生石灰:CaCO3=CaO+CO2↑ B、湿法炼铜:Fe+CuSO4=FeSO4+Cu C、制氢氧化铜:CuSO4+2NaOH =Cu(OH)2↓+Na2SO4 D、利用纯碱制碳酸氢钠:Na2CO3+CO2+H2O=2NaHCO35. 实验废液中可能含有离子K+、Mg2+、Cl-、Ba2+、SO42-、CO32-中的几种,为确定可能含有的离子,兴趣小组进行了下面的实验:
①取一份废液,加入氯化钡溶液有白色沉淀产生,再加入足量稀盐酸,沉淀无变化;
②另取一份废液,加入氢氧化钾溶液出现白色沉淀,再加入足量稀盐酸,沉淀全部溶解,
分析上面实验得出的结论中,正确的是( )
A、只含有Mg2+、SO42- B、一定含有K+、Mg2+、Cl-、SO42- C、一定含有Mg2+、SO42- , 可能含有Cl-、K+ D、一定含有Cl-、K+ , 可能含有Mg2+、SO42-6. 在氢气还原氧化铜的实验中,观察到的现象是( )A、有红色的铜生成 B、试管底有水生成 C、有铜和水生成 D、黑色固体变成红色,试管口有水珠生成7. 除去下列物质中的少量杂质,所选试剂或操作方法不合理的是( )选项
物质
杂质
除杂试剂或操作方法
A
N2
O2
通过灼热的铜网
B
KCl固体
MnO2
溶解、过滤、蒸发结晶
C
NaOH溶液
Na2CO3
滴加适量的BaCl2溶液后过滤
D
Cu
Fe
用磁铁吸引
A、A B、B C、C D、D8. 某溶液中的溶质有NaOH、HCl、H2SO4和MgCl2中的一种或几种,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图所示,下列说法正确的是( ) A、HCl和H2SO4一定存在 B、NaOH、H2SO4和MgCl2一定不存在 C、HCl和MgCl2一定存在 D、HCl一定存在NaOH、H2SO4一定不存在,MgCl2可能存在9. 电脑芯片的制作要用到高纯度的硅。 目前广泛采用石英砂(主要成分是SiO₂)为原料制取,其中一步反应为↑。对该反应分析正确的是( )A、该反应属于置换反应 B、碳发生了还原反应 C、碳元素化合价由0价变为+4价 D、该反应利用了CO的还原性10. 下列既是空气污染物,又是氧化物的是( )A、二氧化氮 B、二氧化碳 C、臭氧 D、PM2.511. 如图是小科同学绘制的单质铜及其化合物的转化模型图,其中能转化的环节有( )
A、HCl和H2SO4一定存在 B、NaOH、H2SO4和MgCl2一定不存在 C、HCl和MgCl2一定存在 D、HCl一定存在NaOH、H2SO4一定不存在,MgCl2可能存在9. 电脑芯片的制作要用到高纯度的硅。 目前广泛采用石英砂(主要成分是SiO₂)为原料制取,其中一步反应为↑。对该反应分析正确的是( )A、该反应属于置换反应 B、碳发生了还原反应 C、碳元素化合价由0价变为+4价 D、该反应利用了CO的还原性10. 下列既是空气污染物,又是氧化物的是( )A、二氧化氮 B、二氧化碳 C、臭氧 D、PM2.511. 如图是小科同学绘制的单质铜及其化合物的转化模型图,其中能转化的环节有( ) A、①② B、②③ C、①③ D、②④12. 某固体可能含有CaCl₂、Na₂SO₄、CuSO₄、KNO₃、Na₂CO₃中的一种或几种,现对其进行如下实验:
A、①② B、②③ C、①③ D、②④12. 某固体可能含有CaCl₂、Na₂SO₄、CuSO₄、KNO₃、Na₂CO₃中的一种或几种,现对其进行如下实验:①取少量固体于试管中,加适量蒸馏水,固体完全溶解得无色透明溶液;
②在①所得溶液中,滴加足量的BaCl₂溶液,产生白色沉淀,过滤后,在白色沉淀中加过量稀盐酸,沉淀部分溶解,且有气泡产生。
下列对原固体成分的说法正确的是( )
A、一定有Na₂CO₃和Na₂SO₄,可能含有KNO₃、CuSO₄、CaCl₂ B、一定有Na₂CO₃,Na₂SO₄和CuSO₄两种物质中至少有一种 C、一定有Na₂CO₃和Na₂SO₄,不含CaCl₂,可能有KNO₃、CuSO₄ D、一定有Na₂CO₃和Na₂SO₄,不含CuSO₄和CaCl₂,可能有KNO₃二、填空题
-
13. 某溶液中可能含有Na+ , H+ , Cl- , SO42-中的几种离子,现欲检验两种阴离子是否存在,选用的最佳方案是:先向溶液中滴入足量的溶液,若有白色沉淀产生,则证明有SO42-存在;再取上层清液滴加溶液,若出现白色沉淀,则可得出Cl-存在的结论。14. 有一包白色粉末,可能是由硫酸铜、氯化钠、碳酸钠中的一种或几种组成。为检验其中的成分,按以下流程进行实验:
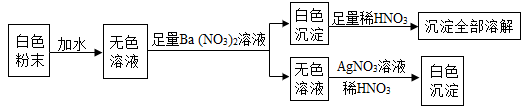 (1)、根据实验现象,白色粉末中一定有。(2)、实验中不能用BaCl2 溶液代替 Ba(NO3)2 溶液的理由是。15. 有一种纳米材料添加剂,由铝粉、氧化铝粉末、铜粉中的一种或几种组成,为探究该添加剂的成分,科学学习小组进行了下列实验,请回答实验中的相关问题:(1)、取适量添加剂于试管中,加入足量稀盐酸,产生大量气泡并有红色固体残留,该现象说明添加剂中一定含有;(2)、另取适量添加剂于另一试管中,加入一定量的硝酸银溶液,充分反应,过滤,得到滤渣和蓝色溶液。则蓝色溶液中一定含有的溶质是。16. 如图是某科学老师设计的一氧化碳还原氧化铁的实验装置。
(1)、根据实验现象,白色粉末中一定有。(2)、实验中不能用BaCl2 溶液代替 Ba(NO3)2 溶液的理由是。15. 有一种纳米材料添加剂,由铝粉、氧化铝粉末、铜粉中的一种或几种组成,为探究该添加剂的成分,科学学习小组进行了下列实验,请回答实验中的相关问题:(1)、取适量添加剂于试管中,加入足量稀盐酸,产生大量气泡并有红色固体残留,该现象说明添加剂中一定含有;(2)、另取适量添加剂于另一试管中,加入一定量的硝酸银溶液,充分反应,过滤,得到滤渣和蓝色溶液。则蓝色溶液中一定含有的溶质是。16. 如图是某科学老师设计的一氧化碳还原氧化铁的实验装置。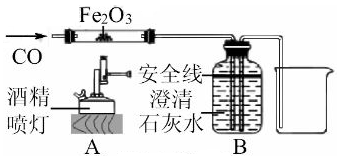 (1)、在B装置的液面下降到安全线之前,不能加热氧化铁,这是因为。(2)、反应结束后停止加热,继续通CO,此时B装置的作用是。
(1)、在B装置的液面下降到安全线之前,不能加热氧化铁,这是因为。(2)、反应结束后停止加热,继续通CO,此时B装置的作用是。三、实验探究题
-
17. 兴趣小组同学用氧化铜与足量的炭粉利用图甲所示的装置进行实验,对生成气体的成分进行探究。

【提出问题】生成的气体中是否含有一氧化碳?
【实验与讨论】①打开K,缓缓通入干燥的氮气 段时间。通入氮气的目的是。
②关闭 K,加热至一定温度使之反应,用气囊收集气体样品。
③除去气体样品中的二氧化碳,并将剩余气体收集在集气瓶中,下列装置中最为合理的是。

【实验求证】将除尽二氧化碳后的气体样品干燥,仍然用图甲所示的装置进行实验,若A 中的固体选用CuO,B中溶液为澄清石灰水,若出现现象,可说明气体样品中含有一氧化碳。
【实验反思】炭粉还原氧化铜的实验中,若生成的气体中含有一氧化碳,则反应时消耗碳与CuO 的质量比,在下列数据中不可能的是。A.1:5 B.1:8 C.1:10 D.1:15
18. 科学探究是认识和解决化学问题的重要实践活动。近年来,自热食品种类繁多。只需将撕去塑料膜的发热包放入凉水中,就能享用美食,很受年轻人的追捧。实验小组同学买来一份自热食品进行以下探究。
【资料】Ⅰ、发热包中物质的主要成分是生石灰、碳酸钠、铝粒。
Ⅱ、铝能和NaOH溶液反应生成偏铝酸钠(NaAlO₂)和氢气,偏铝酸钠溶于水。
(1)、探究一:发热包的发热原理。小组同学取出发热包,撕去塑料膜,放入适量凉水中,可观察到的现象是 , 固体迅速膨胀,同时还可观察到发热包内固体变硬结块,其可能的原因是(用化学方程式表示)。
(2)、在使用发热包过程中,禁止明火的理由是。(3)、探究二:反应后混合物中部分成分的探究。
根据以上操作和实验现象回答下列问题。
操作Ⅰ的名称是。
(4)、根据现象①得出:滤液A 中一定不含的物质是。根据现象②③分析得出:固体B中 定含有的物质是。综合分析得出:现象③中产生的气体,其成分的组成可能为。(5)、通过以上探究,同学们进行反思总结,你认为其中正确的是____。A、能与水混合放出热量的物质均可做发热包的发热材料 B、发热包应密封防潮保存 C、禁止用湿手接触发热包 D、使用过程中应保持通风19. 化学兴趣小组的同学按图示装置(K₁、K₂开始处于关闭状态)及步骤探究碱的化学性质。
【实验步骤】实验I:沿分液漏斗将一定量NaOH溶液注入A中,关闭漏斗活塞。
实验Ⅱ:打开K₁,观察到B中部分溶液倒吸入A中,待停止倒吸。
实验Ⅲ:打开K₂,观察到C中溶液分别倒吸入A、B中,轻轻振荡,直到液面稳定。
【思考与交流】
(1)、B中滴有酚酞的Ca(OH)₂溶液呈红色,说明Ca(OH)₂溶液的pH(填“<”“>”或“=”)7。(2)、实验Ⅱ中在A装置的锥形瓶内观察到的现象有;根据实验I和Ⅱ(填“能”或“不能”)证明CO₂和NaOH溶液发生了反应。(3)、实验Ⅲ,B中反应的化学方程式是。(4)、实验Ⅲ,C中溶液倒吸入A装置的锥形瓶内,充分反应后溶液呈无色。经分析,瓶中混合物一定含有水、氯化钠和酚酞,可能含有碳酸钙。
为进一步确定溶液中还可能含有哪些溶质,提出以下猜想:(已知:氯化钙溶液呈中性)猜想一:CaCl₂;猜想二:。
①请完成猜想二。
②请你帮助设计实验方案,验证猜想正确(写出实验操作过程及实验现象):。



A.该实验是将氢氧化钠溶液滴入稀盐酸中B.当滴入液体体积为5mL时,溶液呈酸性
C.当滴入液体体积为7mL时,盐酸和氢氧化钠恰好完全反应
D.当滴入液体体积为9mL时,溶液中有3种溶质
20. 有一包白色固体样品,可能含有NaOH、Na₂CO₃、K₂SO₄、BaCl₂中的一种或几种,为确定其组成,进行如下实验:步骤Ⅰ:取少量样品于烧杯中,加足量水,充分搅拌,静置,有固体剩余。
步骤Ⅱ:取步骤Ⅰ所得上层清液于试管中,滴入几滴酚酞溶液,溶液变红色;再滴入过量稀盐酸,无气泡产生,红色逐渐褪去,得到无色溶液。
步骤Ⅲ:取步骤Ⅱ所得溶液于试管中,滴入过量Ba(NO₃)₂溶液,无明显现象。
根据上述实验,回答下列问题:
(1)、步骤Ⅱ中溶液的红色褪去,发生反应的化学方程式。(2)、分析上述实验过程,关于样品的组成,可以得到的结论是。(3)、若要进一步确定样品的组成,还需进行的实验操作是。21. 某实验废液中可能含有、六种离子中的几种,为确定废液中存在的离子,进行了下面实验:①取少量废液,向废液中滴加NaOH溶液,有白色沉淀生成;
②另取少量废液,向其中滴加BaCl₂溶液,无明显现象;
③再取少量废液,滴加AgNO₃溶液,产生白色沉淀,加稀硝酸后沉淀不溶解。
试分析实验后回答:
(1)、废液中一定含有的离子是 , 可能含有的离子是。(2)、有同学认为实验③可以省略,理由是。四、解答题
-
22. 有一瓶标签无法辨认的试剂,是碳酸钠溶液或氢氧化钠溶液中的一种。(1)、仅用下列一种试剂就可以进行鉴别的是____。A、硫酸钾溶液 B、酚酞试液 C、氯化钠溶液 D、硝酸钡溶液(2)、选择合适的器材,利用第(1)题选择的试剂,设计实验方案,写出实验步骤、预期现象和对应结论。