浙教版科学中考复习优中选优-化学-第13节-盐
试卷更新日期:2024-03-13 类型:一轮复习
一、单选题
-
1. 阳光玫瑰葡萄今年获得了大丰收,颗粒大,果肉鲜脆多汁,受到了人们的一致好评。在葡萄开花后要注意补充钾肥,钾肥能促进糖类的合成与运输,提高葡萄品质,下列属于钾肥的是( )
 A、KNO3 B、CO(NH2)2 C、K2CO3 D、Ca(H2PO4)22. 庄稼一枝花,全靠肥当家。碳酸氢铵(化学式为NH4HCO3)属于( )A、氮肥 B、磷肥 C、钾肥 D、复合肥3. 下列各组物质的变化中,只有加入酸才能一步实现的是( )A、 B、 C、 D、4. 为了增强水稻的抗病虫害和抗倒伏能力,应施用的一种化学肥料是( )A、KCl B、CO(NH₂)₂ C、Ca(H₂PO₄)₂ D、NH₄Cl5. 番茄种子开始萌发到长出第一片新叶时,两片子叶仍具有生理功能。学习小组用缺氮的营养液培养上述若干幼苗,然后对幼苗进行如下不同处理,随后对叶片进行观察,最先出现缺氮症状的是( )A、剪去 一片子叶的幼苗 B、剪掉根尖的幼苗 C、剪去两片子叶的幼苗 D、完整的幼苗6. 小金种植番薯的产量总是比邻近的地低,怀疑地里可能缺乏某种肥料,他将地分成等面积的四块,仅施肥不同,实验结果如下表。据表判断该种植地最可能缺乏的是( )
A、KNO3 B、CO(NH2)2 C、K2CO3 D、Ca(H2PO4)22. 庄稼一枝花,全靠肥当家。碳酸氢铵(化学式为NH4HCO3)属于( )A、氮肥 B、磷肥 C、钾肥 D、复合肥3. 下列各组物质的变化中,只有加入酸才能一步实现的是( )A、 B、 C、 D、4. 为了增强水稻的抗病虫害和抗倒伏能力,应施用的一种化学肥料是( )A、KCl B、CO(NH₂)₂ C、Ca(H₂PO₄)₂ D、NH₄Cl5. 番茄种子开始萌发到长出第一片新叶时,两片子叶仍具有生理功能。学习小组用缺氮的营养液培养上述若干幼苗,然后对幼苗进行如下不同处理,随后对叶片进行观察,最先出现缺氮症状的是( )A、剪去 一片子叶的幼苗 B、剪掉根尖的幼苗 C、剪去两片子叶的幼苗 D、完整的幼苗6. 小金种植番薯的产量总是比邻近的地低,怀疑地里可能缺乏某种肥料,他将地分成等面积的四块,仅施肥不同,实验结果如下表。据表判断该种植地最可能缺乏的是( )地块
甲
乙
丙
丁
施肥情况
不施肥
磷、钾肥
磷、氮肥
钾、氮肥
番薯产量
30kg
45kg
31kg
46kg
A、氮肥 B、磷肥 C、钾肥 D、无法确定7. 往氯化铁和稀盐酸的混合液中逐滴加入过量氢氧化钠溶液。发生的反应为NaOH+HCl=NaCl+H2O,3NaOH+FeCl3=Fe(OH)3↓+3NaCl。则烧杯中各物质质量的变化正确的是( )A、 B、
B、 C、
C、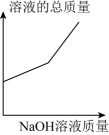 D、
D、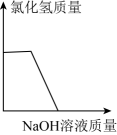 8. 下列实验现象的描述中,不正确的是( )A、硫在氧气中燃烧, 产生蓝紫色火焰 B、蜡烛在空气中燃烧, 生成二氧化碳和水 C、铝丝插入硫酸铜溶液中, 铝丝表面有红色物质析出 D、少量氯化钙与少量熟石灰粉末混合、研磨,闻到刺激性气味9. 下列有关说法正确的是( )A、盐中一定含有金属元素 B、酸中一定含有氢元素和氧元素 C、两种化合物相互反应生成两种新的化合物的反应一定是复分解反应 D、 酸溶液有通性的原因是酸在水溶液中都能够电离出
8. 下列实验现象的描述中,不正确的是( )A、硫在氧气中燃烧, 产生蓝紫色火焰 B、蜡烛在空气中燃烧, 生成二氧化碳和水 C、铝丝插入硫酸铜溶液中, 铝丝表面有红色物质析出 D、少量氯化钙与少量熟石灰粉末混合、研磨,闻到刺激性气味9. 下列有关说法正确的是( )A、盐中一定含有金属元素 B、酸中一定含有氢元素和氧元素 C、两种化合物相互反应生成两种新的化合物的反应一定是复分解反应 D、 酸溶液有通性的原因是酸在水溶液中都能够电离出 10. 物质的性质与用途密切相关。下列做法不合理的是( )A、工业上用稀盐酸除铁锈 B、农业上用熟石灰改良酸性土壤 C、碳酸钠用于玻璃、造纸、洗涤剂的生产 D、水壶中的水垢 (主要成分是碳酸钻和氢氧化镁)用水清洗11. 有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种。取样溶于水,有白色沉淀产生;过滤后,向该白色沉淀中滴加过量盐酸,沉淀部分溶解并有气体产生。由此推断白色固体中( )A、可能存在NaOH B、可能存在Na2SO4 C、肯定不存在BaCl2 D、肯定存在Na2CO3和Na2SO4、NaOH12. 氯化铵(NH4Cl)是“侯氏制碱法”的一种副产品。已知氯化铵的水溶液显酸性,下列关于氯化铵的说法正确的是( )A、氯化铵属于酸 B、氯化铵是一种复合肥 C、氯化铵与熟石灰混合使用可提高肥效 D、氯化铵溶液与硝酸银溶液混合会产生白色沉淀13. 在下列化学方程式中,属于“复分解反应”的是( )A、Fe+2HCl=FeCl2+H2↑ B、CaCO3CaO+CO2↑ C、H2CO3H2O+CO2↑ D、Ca(OH)2+Li2CO3=2LiOH+CaCO3↓14. 在加压降温条件下,氯气(Cl2) 可液化为油状液体(液氯Cl2),氯气溶于水得到的溶液叫氯水,其中部分氯气会与水反应生成HCl和HClO (次氯酸)。小陈做了分析,合理的是( )A、氯气变成液氯是物理变化 B、氯气与水的反应属于复分解反应 C、往氯水中滴加碳酸钠溶液不会有气泡生成 D、往氯水中滴加硝酸银溶液后无明显现象15. 下列是分析久置空气中的NaOH固体的相关实验(不考虑水分),其中合理的是( )
10. 物质的性质与用途密切相关。下列做法不合理的是( )A、工业上用稀盐酸除铁锈 B、农业上用熟石灰改良酸性土壤 C、碳酸钠用于玻璃、造纸、洗涤剂的生产 D、水壶中的水垢 (主要成分是碳酸钻和氢氧化镁)用水清洗11. 有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种。取样溶于水,有白色沉淀产生;过滤后,向该白色沉淀中滴加过量盐酸,沉淀部分溶解并有气体产生。由此推断白色固体中( )A、可能存在NaOH B、可能存在Na2SO4 C、肯定不存在BaCl2 D、肯定存在Na2CO3和Na2SO4、NaOH12. 氯化铵(NH4Cl)是“侯氏制碱法”的一种副产品。已知氯化铵的水溶液显酸性,下列关于氯化铵的说法正确的是( )A、氯化铵属于酸 B、氯化铵是一种复合肥 C、氯化铵与熟石灰混合使用可提高肥效 D、氯化铵溶液与硝酸银溶液混合会产生白色沉淀13. 在下列化学方程式中,属于“复分解反应”的是( )A、Fe+2HCl=FeCl2+H2↑ B、CaCO3CaO+CO2↑ C、H2CO3H2O+CO2↑ D、Ca(OH)2+Li2CO3=2LiOH+CaCO3↓14. 在加压降温条件下,氯气(Cl2) 可液化为油状液体(液氯Cl2),氯气溶于水得到的溶液叫氯水,其中部分氯气会与水反应生成HCl和HClO (次氯酸)。小陈做了分析,合理的是( )A、氯气变成液氯是物理变化 B、氯气与水的反应属于复分解反应 C、往氯水中滴加碳酸钠溶液不会有气泡生成 D、往氯水中滴加硝酸银溶液后无明显现象15. 下列是分析久置空气中的NaOH固体的相关实验(不考虑水分),其中合理的是( )序号
实验目的
实验方案
A
证明变质
取少量固体,加水溶解,滴加少量稀盐酸,观察是否有气泡产生
B
确定成分
取少量固体,加入石灰水,过滤,向滤液中滴加酚酞试液
C
测定纯度
取ag样品与足量氯化钡溶液充分反应,将沉淀过滤、洗涤、干燥,得到mg固体
D
除去杂质
取固体,加水溶解,滴加氯化钙溶液至恰好完全反应,过滤
A、A B、B C、C D、D16. 向一定量的AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如下图所示,下列说法正确的是( )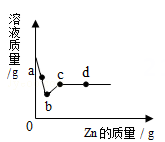 A、a点溶液中有2种阳离子 B、c点溶液中溶质为Zn(NO3)2 C、若取b~c段溶液,滴加稀盐酸,会产生白色沉淀 D、若取d点固体,有反应生成的铜与银,加入稀盐酸则无气泡产生17. 下面是四种制取ZnSO4的化学反应:
A、a点溶液中有2种阳离子 B、c点溶液中溶质为Zn(NO3)2 C、若取b~c段溶液,滴加稀盐酸,会产生白色沉淀 D、若取d点固体,有反应生成的铜与银,加入稀盐酸则无气泡产生17. 下面是四种制取ZnSO4的化学反应:①Zn+H2SO4=ZnSO4+H2↑
②ZnO+H2SO4=ZnSO4+H2O
③Zn(OH)2+H2SO4=ZnSO4+2H2O
④ZnCO3+H2SO4=ZnSO4+H2O+CO2↑
对这四个化学反应,下列说法错误的是( )
A、反应①是置换反应 B、反应②中锌元素的化合价不变 C、反应③实质是Zn2+和SO42-的反应 D、反应④是复分解反应二、填空题
-
18. 有一包固体粉末,可能是CaCO3、Na2SO4、CuSO4、Na2CO3中的一种或多种,取一定量上述固体粉末,加足量水溶解,得到蓝色澄清溶液,则原固体粉末中一定没有 , 可能含有。
三、实验探究题
-
19. 根据如图所示实验,探究酸碱中和反应。

 (1)、实验一:通过溶液酸碱性变化证明酸碱发生中和反应。图①中证明碱与酸发生反应的现象是。(2)、图②中b、c、d三点处对应溶液所含溶质NaCl的质量大小关系。(3)、通过证明酸碱发生中和反应。20. 氧化钙俗名生石灰,某同学针对氧化钙设计了如下实验方案:
(1)、实验一:通过溶液酸碱性变化证明酸碱发生中和反应。图①中证明碱与酸发生反应的现象是。(2)、图②中b、c、d三点处对应溶液所含溶质NaCl的质量大小关系。(3)、通过证明酸碱发生中和反应。20. 氧化钙俗名生石灰,某同学针对氧化钙设计了如下实验方案: (1)、A中发生反应的化学方程式为;分离B中难溶物的操作Ⅰ叫。(2)、如果要证明C中不是水而是一种溶液,可以选择下列(填序号)进行实验。
(1)、A中发生反应的化学方程式为;分离B中难溶物的操作Ⅰ叫。(2)、如果要证明C中不是水而是一种溶液,可以选择下列(填序号)进行实验。①稀盐酸 ②酚酞溶液 ③二氧化碳 ④氯化钠溶液
(3)、操作Ⅱ是加入某种物质使无色澄清液出现白色固体,如果加入的是饱和碳酸钠溶液,白色固体的化学式是;如果加入的是固体氢氧化钠(全部溶解),白色固体的化学式是。21. 实验室现有一瓶含有少量水的碳酸氢铵样品,为测定其中碳酸氢铵的质量分数,某化学兴趣小组利用如图所示装置进行实验(该装置气密性良好,装置B、C中所装药品均足量,碱石灰是氧化钙和氢氧化钠的混合物)。已知:碳酸氢受热易分解,反应的化学方程式为:NH4HCO3≜NH3↑+H2O+CO2↑,NH3能被酸溶液吸收。部分实验步骤如下:
Ⅰ、打开弹簧夹,通入一段时间的氮气;
Ⅱ、关闭弹簧夹,给碳酸氢铵样品加热;
Ⅲ、当样品反应完全,......,再停止加热,直到玻璃管冷却;
Ⅳ、实验完毕,测得装置B、C中药品的质量分别增加了m1、m2。
请回答下列问题:
(1)、NH4HCO3属于(选填“氮肥”“磷肥”“钾肥”或“复合肥”)(2)、装置B中盛放的液体是(3)、步骤Ⅱ中,停止加热前应进行的操作。四、解答题
-
22. 实验室有一杯质量为50g的硫酸铜和稀盐酸混合溶液,缓慢加入未知浓度的氢氧化钡溶液,每次加入20g,共分6次加入,同时不断搅拌,使其充分反应,并测量每次反应后溶液总质量和沉淀质量,部分数据如下表所示。
测量次数
第1次
第⒉次
第3次
第4次
第5次
第6次
加入氢氧化钡溶液质量/g
20
20
20
20
20
20
溶液总质量/g
65.34
80.68
100.68
118.72
136.76
m
沉淀质量
4.66
9.32
9.32
11.28
13.24
13.24
(1)、表格中m=。(2)、求实验使用的氢氧化钡溶液的溶质质量分数。(3)、第3次实验中沉淀质量没有增加,而第4次实验沉淀质量又增加的原因是。(4)、求原混合溶液中稀盐酸的溶质质量分数。23. 无土栽培是利用营养液栽培作物的一种方法。
(1)、下列化学肥料中属于复合肥的是(填序号)。①NH4NO3 ②NH4H2PO4 ③KNO3 ④K2SO4
(2)、现有一种无色的营养液,可能由 KNO3 、Ca(NO3)2、K2CO3、KCl 中的一种或几种物质组成,为探究其成分,某同学设计并完成了如下图的实验。根据以上实验,请你进行有关推断。
①由实验 1 可确定原营养液中一定有的物质是。
②由实验 1 和实验 2 可推测原营养液(填“一定有”或“可能有”)KCl。
③若测得原营养液中 K+和 Cl-的数目之比为 1∶1,则原营养液的组成中的溶质是。
24. 明代《徐光启手迹》中记载了硝酸的制法。(1)、原料:绿矾五斤,硝五斤。绿矾和硝(KNO₃)均属于____(填序号)。
A、氧化物 B、酸 C、碱 D、盐(2)、预处理:将矾炒去,约折五分之一。二味同研细,听用。①加热绿矾,质量约减小该过程中绿矾失去部分水,生成。写出反应的化学方程式:。
②研碎和KNO₃,研碎的目的是。
(3)、制备:用铁作锅,铁锅置炭炉上,锅下起火…取起冷定,开坛则药化为强水。强水即硝酸,制备时发生如下反应:①以上三个反应中未涉及的反应类型是(填“化合”“分解”“置换”或“复分解”)反应。
和HNO₃的水溶液中均含有的阳离子是(填符号)。
25. 某同学用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该溶液,测定Na2CO3溶液中溶质的质量分数。他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如下图所示。 (1)、在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,但却看到溶液有气泡产生,说明滤液中的溶质除含有CaCl2外,还含有(填化学式)。(2)、Na2CO3溶液从0加到5克的过程中,溶液pH如何变化?(选填变大、变小或不变)。(3)、计算Na2CO3溶液中溶质的质量分数。(提示:Na2CO3+CaCl2=CaCO3↓+2NaCl,计算结果精确到0.1%)26. 剩菜隔夜可能会产生亚硝酸盐和细菌。其中亚硝酸钠(化学式为NaNO2)对人来说是剧毒的,食用后易造成严重的中毒事件。亚硝酸钠是一种白色固体,有咸味,易溶于水,水溶液呈碱性,能与硝酸银溶液反应能生成不溶于水但溶于稀硝酸的白色沉淀。根据亚硝酸钠的化学式,你认为亚硝酸钠溶液中的(填写离子符号)有毒;试设计一个简单的实验方案来鉴别食盐和亚硝酸钠。。
(1)、在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,但却看到溶液有气泡产生,说明滤液中的溶质除含有CaCl2外,还含有(填化学式)。(2)、Na2CO3溶液从0加到5克的过程中,溶液pH如何变化?(选填变大、变小或不变)。(3)、计算Na2CO3溶液中溶质的质量分数。(提示:Na2CO3+CaCl2=CaCO3↓+2NaCl,计算结果精确到0.1%)26. 剩菜隔夜可能会产生亚硝酸盐和细菌。其中亚硝酸钠(化学式为NaNO2)对人来说是剧毒的,食用后易造成严重的中毒事件。亚硝酸钠是一种白色固体,有咸味,易溶于水,水溶液呈碱性,能与硝酸银溶液反应能生成不溶于水但溶于稀硝酸的白色沉淀。根据亚硝酸钠的化学式,你认为亚硝酸钠溶液中的(填写离子符号)有毒;试设计一个简单的实验方案来鉴别食盐和亚硝酸钠。。
-