浙教版初中科学八年级下册2.3原子结构的模型 提优卷
试卷更新日期:2024-03-13 类型:同步测试
一、选择题
-
1. 如图为碳-14 原子的结构示意图,由图可知碳-14原子 ( )
 A、含有6个中子 B、含有14个质子 C、核电荷数为 6 D、质子数和中子数相等2. 1909年起,英国科学家卢瑟福和他的助手用一束带正电荷的高速α粒子流轰击一片很薄的金箔,并根据如图所示的实验现象和已有知识,在1911年提出了原子的有核模型。要解释本实验现象产生的原因,下列知识不需要用到的是………………( )
A、含有6个中子 B、含有14个质子 C、核电荷数为 6 D、质子数和中子数相等2. 1909年起,英国科学家卢瑟福和他的助手用一束带正电荷的高速α粒子流轰击一片很薄的金箔,并根据如图所示的实验现象和已有知识,在1911年提出了原子的有核模型。要解释本实验现象产生的原因,下列知识不需要用到的是………………( ) A、同种电荷相互排斥 B、电荷的定向移动形成电流 C、力是改变物体运动状态的原因 D、一个α粒子的质量比一个电子的质量大得多3. 对于 Fe、Fe²⁺、Fe³⁺三种粒子的判断,正确的是( )
A、同种电荷相互排斥 B、电荷的定向移动形成电流 C、力是改变物体运动状态的原因 D、一个α粒子的质量比一个电子的质量大得多3. 对于 Fe、Fe²⁺、Fe³⁺三种粒子的判断,正确的是( )①核电荷数相同 ②核外电子数相等
③电子层结构相同 ④质量几乎相等
⑤所含的质子数相等
A、①③④⑤ B、②③④ C、①④⑤ D、③④⑤4. 最近科学家发现了一种与天体中的中子星构成类似的,只由四个中子构成的粒子,这种粒子称为“四中子”,也称为“零号元素”。有关这种粒子的说法正确的是( )A、易失去电子 B、相当于一个氢分子的质量 C、不显电性 D、在周期表中可与氢元素占同一位5. 在某原子结构模型示意图图,abc是构成该原子的三种不同粒子,下列说法正确的是( ) A、a和c数量不相等 B、c决定原子种类 C、该原子的相对原子质量为6 D、该原子所带的电荷数为-26. 如图表示四种原子的结构模型(“·”、”O”和”●”分别表示电子、中子、质子),下列说法正确的是( )
A、a和c数量不相等 B、c决定原子种类 C、该原子的相对原子质量为6 D、该原子所带的电荷数为-26. 如图表示四种原子的结构模型(“·”、”O”和”●”分别表示电子、中子、质子),下列说法正确的是( )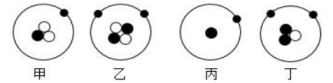 A、甲、丙的核电荷数不同 B、甲、丙为同一种原子 C、乙、丁属于同一种元素 D、甲、乙互为同位素原子7. 关于原子及原子结构发现史的说法不正确的是( )A、汤姆生、卢瑟福两位科学家都是在实验的基础上,通过推理和想象建构原子模型 B、汤姆生发现了电子,证实原子是可分的 C、原子核外的电子数发生变化时,元素的种类也发生了变化 D、原子在化学变化中的表现主要取决于原子的最外层电子8. 科学研究院团队对嫦娥五号采集的月壤样品进行研究,发现钛(Ti)在月壤中的含量是地球土壤平均含量的6倍多。Ti的相对原子质量为49,质子数是22。则钛原子的核外电子数为( )A、49 B、22 C、27 D、719. 为了进一步探索原子的结构,卢瑟福用粒子轰击金属箔。如图所示表示a粒子的运动轨迹,其中错误的是( )
A、甲、丙的核电荷数不同 B、甲、丙为同一种原子 C、乙、丁属于同一种元素 D、甲、乙互为同位素原子7. 关于原子及原子结构发现史的说法不正确的是( )A、汤姆生、卢瑟福两位科学家都是在实验的基础上,通过推理和想象建构原子模型 B、汤姆生发现了电子,证实原子是可分的 C、原子核外的电子数发生变化时,元素的种类也发生了变化 D、原子在化学变化中的表现主要取决于原子的最外层电子8. 科学研究院团队对嫦娥五号采集的月壤样品进行研究,发现钛(Ti)在月壤中的含量是地球土壤平均含量的6倍多。Ti的相对原子质量为49,质子数是22。则钛原子的核外电子数为( )A、49 B、22 C、27 D、719. 为了进一步探索原子的结构,卢瑟福用粒子轰击金属箔。如图所示表示a粒子的运动轨迹,其中错误的是( )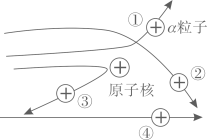 A、① B、② C、③ D、④10. 南京理工大学胡炳成团队用新方法制得了NaN5·3H2O,该化合物中含有N5-等微粒。已知N为7号元素,则下列有关说法正确的是( )A、N5-是一种单质 B、1 个 N5-带 1 个单位的正电荷 C、个 N5-中共含有 35 个质子 D、1 个 N5-中共含有 35 个电子11. 化学上常用符号“ZAX”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和。已知 abXn+和 cdYm﹣的电子层排布完全相同,则下列关系正确的是( )A、b-a=d-c B、a+n=c-m C、a-n=c+m D、b-n=d+m12. 2021年3月20日,有关部门发布了三星堆遗址考古新发现,通报新出土金面具残片、象
A、① B、② C、③ D、④10. 南京理工大学胡炳成团队用新方法制得了NaN5·3H2O,该化合物中含有N5-等微粒。已知N为7号元素,则下列有关说法正确的是( )A、N5-是一种单质 B、1 个 N5-带 1 个单位的正电荷 C、个 N5-中共含有 35 个质子 D、1 个 N5-中共含有 35 个电子11. 化学上常用符号“ZAX”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和。已知 abXn+和 cdYm﹣的电子层排布完全相同,则下列关系正确的是( )A、b-a=d-c B、a+n=c-m C、a-n=c+m D、b-n=d+m12. 2021年3月20日,有关部门发布了三星堆遗址考古新发现,通报新出土金面具残片、象牙、各种青铜器等重要文物500余件,考古学家应用C-14测出三星堆遗址距今已有3000
至5000年。下列有关说法正确的是( )
A、C-12和C-14的质子数相同 B、Cu的相对原子质量是64g C、青铜是一种纯净物 D、可根据金面具中的C-14含量测定其年代13. 与碳元素一样,氢元素也有三种不同的原子,依次称为氕[piē]、氘[dāo]、氚[chuān],分别用符号 H、D、T 表示,其原子核内质子数均为 1,中子数依次为 0、1、2.下列有关说法不正确的是( )A、氕、氘、氚三种原子核外均只有一个电子 B、一个氘原子的质量约为一个氕原子质量的 2 倍 C、氕、氘、氚三种原子的化学性质几乎完全相同 D、化学式为 HD 的物质属于化合物14. 生活中常见的“加铁酱油”、“富硒大米”、“高钙奶粉”等物质中的“铁”、“硒”、“钙”指的是( )A、单质 B、元素 C、原子 D、分子15. 建立模型是学习科学的重要方法,下列模型表示正确的是 ( )A、 B、
B、 C、
C、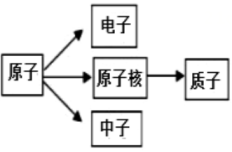 D、
D、
二、填空题
-
16. 在这一章中我们已经学习和接触了以下几种微粒:
①分子 ②原子 ③电子 ④原子核 ⑤质子 ⑥中子 ⑦离子(阳离子和阴离子),请用恰当的序号填空。
(1)、带正电的是。(2)、带负电的是。(3)、不显电性的是。(4)、能直接构成物质的是。(5)、质量最小的是。(6)、在同一原子中数目相等是。(7)、化学变化中最小的粒子是。(8)、质量与氢原子大约相等的是。17. 探测月壤是“嫦娥一号”的主要任务之一。因为月壤中蕴藏着丰富的He-3,其原子结构如图所示。He-3是一种安全、高效的清洁燃料,它的应用前景十分广阔。请回答下列问题。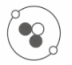 (1)、图中微粒“●”是(填“质子”“中子”或“电子”)。(2)、He-4是He-3的同位素原子,则He-4中质子有个,中子有个。(3)、α粒子是带两个单位正电荷的氦原子核,则氦原子转化为α粒子时,两个电子。18. 生活中的广告与化学联系密切,请欣赏以下两则广告:
(1)、图中微粒“●”是(填“质子”“中子”或“电子”)。(2)、He-4是He-3的同位素原子,则He-4中质子有个,中子有个。(3)、α粒子是带两个单位正电荷的氦原子核,则氦原子转化为α粒子时,两个电子。18. 生活中的广告与化学联系密切,请欣赏以下两则广告:①黄金搭档,花一样钱补五样;
②葡萄糖酸锌口服溶液,蓝瓶的,好喝的。
请填写下列空白:
黄金搭档所补五样是指:钙(元素符号为)、铁、锌、硒、维生素。其中前四样是指人体需要这四样(填“单质”“离子”或“元素”)。
19. 氢元素概念的建立是不断完善和修正的。请结合资料回答: (1)、卡文迪许用锌与足量的酸反应得到可燃空气,该可燃空气其实是;(2)、图甲A、B原子和图乙中的 原子的总称为氢元素(填字母)。
(1)、卡文迪许用锌与足量的酸反应得到可燃空气,该可燃空气其实是;(2)、图甲A、B原子和图乙中的 原子的总称为氢元素(填字母)。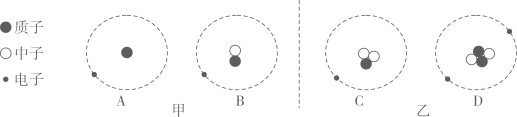 20. 如图实验装置,放射源发出的α粒子“轰击”金箔,并对散射的α粒子进行统计。发现:绝大多数α粒子都能沿直线穿过金箔,有少数发生很大的偏转,极少数甚至被弹回。这就是著名的卢瑟福α粒子散射实验。
20. 如图实验装置,放射源发出的α粒子“轰击”金箔,并对散射的α粒子进行统计。发现:绝大多数α粒子都能沿直线穿过金箔,有少数发生很大的偏转,极少数甚至被弹回。这就是著名的卢瑟福α粒子散射实验。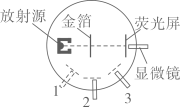 (1)、卢瑟福在实验基础上建立了原子的模型。(2)、实验时,若将显微镜分别放在位置1、2、3,则能观察到粒子数量最多的是位置。
(1)、卢瑟福在实验基础上建立了原子的模型。(2)、实验时,若将显微镜分别放在位置1、2、3,则能观察到粒子数量最多的是位置。三、实验探究题
-
21. 人们为了解释原子结构的奥秘,经历了漫长的探究过程。1803年,道尔顿提出原子概念,他认为一切物质都是由原子构成的。1897年,汤姆生发现原子中存在一种带负电荷的粒子,证明原子是可以再分的,又提出了“面包模型”。1911年,英国科学家卢瑟福为探索原子的内部结构,用带正电的α粒子轰击金属箔,发现如下现象:①大多数α粒子能穿透金属箔而不改变原来的运动方向;②有小部分α粒子改变了原来的运动方向;③有极少部分α粒子被弹了回来。请回答:(1)、汤姆生发现的粒子是。(2)、卢瑟福的α粒子轰击金属箔实验的上述现象中,能证明原子核带正电的现象是(填序号)。(3)、通过实验,卢瑟福认为“原子的大部分质量都集中到了中心一个很小的结构上”,卢瑟福所说的“很小的结构”指的是。22. 1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。实验做法如图甲所示。
绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
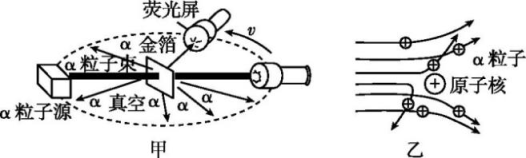
[猜想与假设] α粒子遇到电子后,就像飞行的子弹碰到灰尘一样,运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
[解释与结论]
(1)、大多数α粒子不改变原来的运动方向,原因是。(2)、卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是。(3)、科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为图中的。 23. 对原子结构探究科学家们提出不同的观点,道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,卢瑟福进行α粒子散射实验后,认为原子是“行星模型”……。(1)、如今看这些观点是不完善甚至是完全错误的,这体现科学是需要不断完善的和修正的过程,对此你还能有什么感悟。(2)、科学家通过α粒子散射实验,发现α粒子运动轨迹如下图,根据示意图你认为能推测出的原子结构为以下的(填选项)。
23. 对原子结构探究科学家们提出不同的观点,道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,卢瑟福进行α粒子散射实验后,认为原子是“行星模型”……。(1)、如今看这些观点是不完善甚至是完全错误的,这体现科学是需要不断完善的和修正的过程,对此你还能有什么感悟。(2)、科学家通过α粒子散射实验,发现α粒子运动轨迹如下图,根据示意图你认为能推测出的原子结构为以下的(填选项)。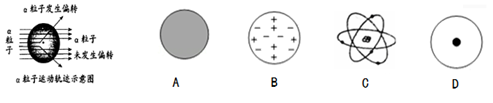 (3)、用能被感知的现象来表现难以感知或度量的事物、现象,是科学研究的重要方法。卢瑟福用该研究方法来说明原子核的存在。下列实验研究与该方法不同的是( )
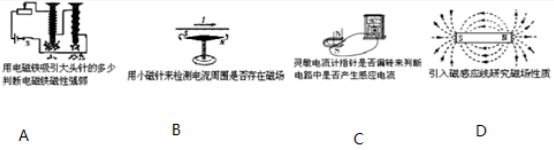
(3)、用能被感知的现象来表现难以感知或度量的事物、现象,是科学研究的重要方法。卢瑟福用该研究方法来说明原子核的存在。下列实验研究与该方法不同的是( )