浙教版初中科学八年级下册2.3原子结构的模型 基础卷
试卷更新日期:2024-03-13 类型:同步测试
一、选择题
-
1. 如图为碳-14 原子的结构示意图,由图可知碳-14原子 ( )
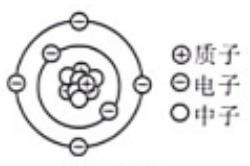 A、含有6个中子 B、含有14个质子 C、核电荷数为 6 D、质子数和中子数相等2. 1909年起,英国科学家卢瑟福和他的助手用一束带正电荷的高速α粒子流轰击一片很薄的金箔,并根据如图所示的实验现象和已有知识,在1911年提出了原子的有核模型。要解释本实验现象产生的原因,下列知识不需要用到的是………………( )
A、含有6个中子 B、含有14个质子 C、核电荷数为 6 D、质子数和中子数相等2. 1909年起,英国科学家卢瑟福和他的助手用一束带正电荷的高速α粒子流轰击一片很薄的金箔,并根据如图所示的实验现象和已有知识,在1911年提出了原子的有核模型。要解释本实验现象产生的原因,下列知识不需要用到的是………………( )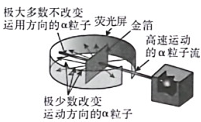 A、同种电荷相互排斥 B、电荷的定向移动形成电流 C、力是改变物体运动状态的原因 D、一个α粒子的质量比一个电子的质量大得多3. 替诺福韦(化学式为C₉H₁₄N₅O₁P)是一种抗病毒药物,在55℃~65℃的环境中反应制成,其相对分子质量为287.22。下列关于它的表述正确的一项是………………………………………( )A、受热即可分解 B、属于混合物 C、质量为287.22 D、由五种元素组成4. 分类法是科学学习常用的一种方法,下列选项符合如图所示关系的是……………………………………( )
A、同种电荷相互排斥 B、电荷的定向移动形成电流 C、力是改变物体运动状态的原因 D、一个α粒子的质量比一个电子的质量大得多3. 替诺福韦(化学式为C₉H₁₄N₅O₁P)是一种抗病毒药物,在55℃~65℃的环境中反应制成,其相对分子质量为287.22。下列关于它的表述正确的一项是………………………………………( )A、受热即可分解 B、属于混合物 C、质量为287.22 D、由五种元素组成4. 分类法是科学学习常用的一种方法,下列选项符合如图所示关系的是……………………………………( )选项
a
b
C
A
原子
原子核
质子
B
单质
化合物
臭氧
C
金属
非金属
汞
D
纯净物
混合物
冰水混合物
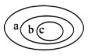 A、A B、B C、C D、D5. 下列说法正确的是…………………………………………( )A、原子核内的质子数和核电荷数一定相等 B、原子核中的质子数和中子数一定相等 C、原子核一定是由质子和中子构成的 D、元素的化学性质取决于原子核内的质子数6. 氚是氢的一种同位素,氚原子含有1个质子和2个中子。下列示意图中能正确表示氚原子结构的是………………………( )
A、A B、B C、C D、D5. 下列说法正确的是…………………………………………( )A、原子核内的质子数和核电荷数一定相等 B、原子核中的质子数和中子数一定相等 C、原子核一定是由质子和中子构成的 D、元素的化学性质取决于原子核内的质子数6. 氚是氢的一种同位素,氚原子含有1个质子和2个中子。下列示意图中能正确表示氚原子结构的是………………………( ) A、
A、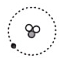 B、
B、 C、
C、 D、
D、 7. 已知 R²⁺核外有 m个电子,该元素原子核内的质子数为 ( )A、m-2 B、2-m C、m D、m+28. 化学上常用左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,如表示核内有6个质子和7个中子的碳原子。下列关于和的说法中错误的是 ( )A、两种原子相比较,质子数相同 B、两种原子相比较,中子数相同 C、两种原子相比较,核外电子数相同 D、属于同种元素9. 钚可用于制造核武器。一种钚原子核电荷数为94,中子数为145,则该钚原子的核外电子数为( )A、94 B、145 C、239 D、5110. 2017年,哈佛大学科学家利用约488万个大气压制成了世界首个金属氢,如图所示。下列有关叙述正确的是( )
7. 已知 R²⁺核外有 m个电子,该元素原子核内的质子数为 ( )A、m-2 B、2-m C、m D、m+28. 化学上常用左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,如表示核内有6个质子和7个中子的碳原子。下列关于和的说法中错误的是 ( )A、两种原子相比较,质子数相同 B、两种原子相比较,中子数相同 C、两种原子相比较,核外电子数相同 D、属于同种元素9. 钚可用于制造核武器。一种钚原子核电荷数为94,中子数为145,则该钚原子的核外电子数为( )A、94 B、145 C、239 D、5110. 2017年,哈佛大学科学家利用约488万个大气压制成了世界首个金属氢,如图所示。下列有关叙述正确的是( )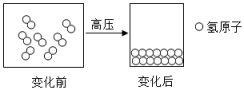 A、氢气是由两个氢元素组成的 B、氢气和金属氢是由氢原子构成的 C、金属氢中氢元素的化合价是0 D、金属氢中的原子含有质子、中子和电子各1个
A、氢气是由两个氢元素组成的 B、氢气和金属氢是由氢原子构成的 C、金属氢中氢元素的化合价是0 D、金属氢中的原子含有质子、中子和电子各1个二、填空题
-
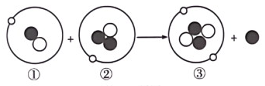
11. 如图为核聚变的示意图,其中①②③表示三种原子,“●”“O”“o”表示原子中的不同粒子,“●”表示 , ①②③中互为同位素原子的是(填序号),核聚变(填“是”或“不是”)化学变化。
 12. 探测月壤是“嫦娥一号”的主要任务之一。因为月壤中蕴藏着丰富的He-3,其原子结构如图所示。He-3是一种安全、高效的清洁燃料,它的应用前景十分广阔。请回答下列问题。
12. 探测月壤是“嫦娥一号”的主要任务之一。因为月壤中蕴藏着丰富的He-3,其原子结构如图所示。He-3是一种安全、高效的清洁燃料,它的应用前景十分广阔。请回答下列问题。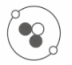 (1)、图中微粒“●”是(填“质子”“中子”或“电子”)。(2)、He-4是He-3的同位素原子,则He-4中质子有个,中子有个。(3)、α粒子是带两个单位正电荷的氦原子核,则氦原子转化为α粒子时,两个电子。13. 铝原子(Al)和铝离子(Al³⁺)属于同一种元素,因为它们的相同。Al和Al+属于(填“相同”或“不同”,下同)的粒子,因为它们的核外电子总数。14. 如图代表氢的三种原子的原子核。请回答下列问题。
(1)、图中微粒“●”是(填“质子”“中子”或“电子”)。(2)、He-4是He-3的同位素原子,则He-4中质子有个,中子有个。(3)、α粒子是带两个单位正电荷的氦原子核,则氦原子转化为α粒子时,两个电子。13. 铝原子(Al)和铝离子(Al³⁺)属于同一种元素,因为它们的相同。Al和Al+属于(填“相同”或“不同”,下同)的粒子,因为它们的核外电子总数。14. 如图代表氢的三种原子的原子核。请回答下列问题。 (1)、这三种原子的原子核内均含有个质子,核外都有个电子。(2)、这三种原子因为数相同,所以它们都是氢原子;但中子数不相同,因此它们是氢的。15. 建立模型一般有一个不断完善和修正的过程,以使模型不断接近事物本质,原子结构模型的建立也是如此,其中行星模型的建立是一个重要阶段。如图是碳原子结构的行星模型,表示碳原子核内有6个和6个中子;核外有6个 , 且围绕原子核做高速运动;原子核在原子中所占的体积。
(1)、这三种原子的原子核内均含有个质子,核外都有个电子。(2)、这三种原子因为数相同,所以它们都是氢原子;但中子数不相同,因此它们是氢的。15. 建立模型一般有一个不断完善和修正的过程,以使模型不断接近事物本质,原子结构模型的建立也是如此,其中行星模型的建立是一个重要阶段。如图是碳原子结构的行星模型,表示碳原子核内有6个和6个中子;核外有6个 , 且围绕原子核做高速运动;原子核在原子中所占的体积。 16. 通过分析下表,你能得出哪些结论?
16. 通过分析下表,你能得出哪些结论?原子种类
核电荷数
质子数
中子数
核外电子数
氢原子
1
1
0
1
碳原子
6
6
6
6
原子种类
核电荷数
质子数
中子数
核外电子数
氧原子
8
8
8
8
钠原子
11
11
12
11
结论1:。
结论2:。
结论3:。
结论4:。
三、实验探究题
-
17. 人们为了解释原子结构的奥秘,经历了漫长的探究过程。1803年,道尔顿提出原子概念,他认为一切物质都是由原子构成的。1897年,汤姆生发现原子中存在一种带负电荷的粒子,证明原子是可以再分的,又提出了“面包模型”。1911年,英国科学家卢瑟福为探索原子的内部结构,用带正电的α粒子轰击金属箔,发现如下现象:①大多数α粒子能穿透金属箔而不改变原来的运动方向;②有小部分α粒子改变了原来的运动方向;③有极少部分α粒子被弹了回来。请回答:(1)、汤姆生发现的粒子是。(2)、卢瑟福的α粒子轰击金属箔实验的上述现象中,能证明原子核带正电的现象是(填序号)。(3)、通过实验,卢瑟福认为“原子的大部分质量都集中到了中心一个很小的结构上”,卢瑟福所说的“很小的结构”指的是。18. 卢瑟福用α粒子(α粒子是带两个单位正电荷的氦原子核)轰击金箔的实验,推翻了汤姆在 1903 年提出的原子结构模型,为建立现代原子理论打下了基础(如图)。
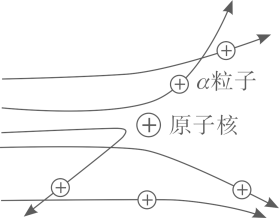
现象 1:大多数α粒子能穿透金箔而不改变原来的运动方向。
现象 2:一小部分α粒子改变原来的运动方向。
现象 3:极少数α粒子被弹了回来。
(1)、请你根据原子结构知识分析现象 1 产生的原因:。(2)、通过该实验的上述三种现象(选填“能”或“不能”) 获得核外电子带有负电荷的结论。(3)、1919年,卢瑟福用加速了的高能α粒子轰击氮原子,结果有种微粒从氮原子中被打出,而α粒子留在了氮原子中,使氮原子变成了氧原子,从现代观点看,被打出的微粒一定是。(选填“质子”或“中子”)19. 探究原子结构的奥秘:1803年英国科学家道尔顿提出了近代原子学说,他认为一切物质是由原子构成的,这些原子是微小的不可分割的实心球。1911年,英国科学家卢瑟福用一束平行高速运动的α粒子(α粒子是带两个单位正电荷的氦原子)轰击金箔时(金原子的核电荷数为79,相对原子质量为197),发现大多数α粒子能穿透金箔,而且不改变原来的运动方向,但是也有一小部分α粒子改变了原来的运动路径,甚至有极少数的α粒子好像碰到了坚硬不可穿透的质点而被弹了回来。(1)、若原子质量、正电荷在原子内均匀分布,则极少数α粒子就(填“会”或“不会” )发生大角度散射。卢瑟福所说的“极少数的α粒子好像碰到了坚硬不可穿透的质点而被弹了回来的“质点”指的是。(2)、绝大多数α粒子穿过后方向不变,说明 ;(填序号)A、原子的质量是均匀分布的 B、原子内部绝大部分空间是空的(3)、从原子结构模型建立的过程中,我们发现。(选填序号)a.科学模型的建立是一个不断完善、不断修正的过程
b.模型在科学研究中起着很重要的作用
c.波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
d.人类借助模型的建立,对原子的认识逐渐接近本质
四、解答题
-
20. 征服原子——揭开原子的神秘面纱。请回答下列问题。(1)、1803年,近代化学之父,英国科学家道尔顿(Dalton J)在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分。而元素由微小的不可分的原子构成,不同元素的原子还可以简单数目比例形成不可再分的原子——“复杂原子”……但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。1811年,意大利化学家阿伏加德罗提出:有些物质也是由分子构成,原子的基本工作形式是分子。
①1897年,汤姆生通过实验发现了 , 进一步发展了原子论、分子论。汤姆生主要是纠正了“道尔顿原子论”中的观点。②1911年,卢瑟福又通过实验,推测原子是由构成的,并提出了沿用至今的现代原子结构理论。③道尔顿原子论中“复杂原子”构成的物质,按现在物质的组成分类,属于纯净物中的。
(2)、 道尔顿的原子论,不是事实的归纳,而是思维的产物,体现了直觉和想象在科学创造中的作用。在科学研究中,像汤姆生和卢瑟福这样,根据实验现象进行解释的过程叫做。原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了来表达他们的理论成果。