浙教版科学中考复习优中选优-化学-第07节-化合价及其计算
试卷更新日期:2024-03-13 类型:一轮复习
一、单选题
-
1. 薄荷醇(化学式为C10H20O)可用于糖果、饮料的加香.下列有关薄荷醇的说法正确的是( )
A、薄荷醇属于氧化物 B、薄荷醇由10个碳原子、20个氢原子和1个氧原子构成 C、薄荷醇中碳元素、氢元素和氧元素的质量比为10:20:1 D、薄荷醇中碳元素的质量分数约为76.9%2. 如图是金元素在元素周期表中的信息示意图,从图中获取的信息正确的是( ) A、金元素属于非金属元素 B、一个金原子的中子数为197.0 C、一个金原子的核外电子数为118 D、一个金原子核带有79个单位的正电荷3. 银制容器在空气中放置一段时间后表面会变黑,原因是银和空气中的微量硫化物等物质发生反应,其化学反应方程式为(4Ag+2H2S+O2=2X+2H₂O,则X的化学式为( )A、AgS B、Ag₂O C、Ag₂S D、Ag₂O₂4. 某元素 X 的原子序数为 a,能够形成 Xn- , 另一元素Y能够形成与X"⁻具有相同核外电子数的 Ym+ , 则Y元素的质子数是( )A、a+m- n B、a+m+n C、a- m- n D、a- m+n5. 氖气是芯片制造的核心材料之一,很难找到替代的产品。如图是氖元素在元素周期表中的相关信息,下列说法错误的是( )
A、金元素属于非金属元素 B、一个金原子的中子数为197.0 C、一个金原子的核外电子数为118 D、一个金原子核带有79个单位的正电荷3. 银制容器在空气中放置一段时间后表面会变黑,原因是银和空气中的微量硫化物等物质发生反应,其化学反应方程式为(4Ag+2H2S+O2=2X+2H₂O,则X的化学式为( )A、AgS B、Ag₂O C、Ag₂S D、Ag₂O₂4. 某元素 X 的原子序数为 a,能够形成 Xn- , 另一元素Y能够形成与X"⁻具有相同核外电子数的 Ym+ , 则Y元素的质子数是( )A、a+m- n B、a+m+n C、a- m- n D、a- m+n5. 氖气是芯片制造的核心材料之一,很难找到替代的产品。如图是氖元素在元素周期表中的相关信息,下列说法错误的是( ) A、氖气的化学式为Ne B、氖原子核内有10个质子 C、氖气化学性质稳定,常用作保护气 D、氖元素的相对原子质量20.18克6. N (NO₂)₃是一种新型的火箭燃料。下列有关N(NO₂)₃的说法中正确的是( )A、由3种元素组成 B、N、O原子的个数比为1:2 C、燃烧时放出大量的热 D、1个N(NO₂)₃中含有3个氧分子7. 构建化学基本观念是学好化学的基础,下列认识正确的是 ( )A、微粒观:构成氯化钠的微粒是氯化钠分子 B、结构观:H₂O和H₂O₂的分子构成不同,化学性质不同 C、能量观:硝酸铵溶于水吸收热量,溶液温度升高 D、守恒观:1g氢气与1g氧气充分反应,生成2g水8. 2023年5月30日神舟十六号载人飞船成功发射,三名航天员踏上”太空出差”之旅,叩问苍穹。如图为一种火箭推进剂发生化学反应的微观示意图,下列有关该反应说法正确的是( )
A、氖气的化学式为Ne B、氖原子核内有10个质子 C、氖气化学性质稳定,常用作保护气 D、氖元素的相对原子质量20.18克6. N (NO₂)₃是一种新型的火箭燃料。下列有关N(NO₂)₃的说法中正确的是( )A、由3种元素组成 B、N、O原子的个数比为1:2 C、燃烧时放出大量的热 D、1个N(NO₂)₃中含有3个氧分子7. 构建化学基本观念是学好化学的基础,下列认识正确的是 ( )A、微粒观:构成氯化钠的微粒是氯化钠分子 B、结构观:H₂O和H₂O₂的分子构成不同,化学性质不同 C、能量观:硝酸铵溶于水吸收热量,溶液温度升高 D、守恒观:1g氢气与1g氧气充分反应,生成2g水8. 2023年5月30日神舟十六号载人飞船成功发射,三名航天员踏上”太空出差”之旅,叩问苍穹。如图为一种火箭推进剂发生化学反应的微观示意图,下列有关该反应说法正确的是( ) A、反应物乙是氧化物 B、生成物丙的相对分子质量是28g C、反应前后N、H化合价均未发生改变 D、生成物丙和丁的分子个数比为3:49. 下列说法正确的是 ( )A、SO₂中含有氧分子 B、2H 表示两个氢分子 C、O₂中氧元素的化合价为-2价 D、CO表示一个一氧化碳分子是由一个碳原子和一个氧原子构成10. 下列微粒中,核电荷数少于核外电子数的是( )A、Na⁺ B、OH⁻ C、O₂ D、Mg11. 对于Fe、Fe²⁺、Fe³⁺三种微粒的判断,正确的是( )
A、反应物乙是氧化物 B、生成物丙的相对分子质量是28g C、反应前后N、H化合价均未发生改变 D、生成物丙和丁的分子个数比为3:49. 下列说法正确的是 ( )A、SO₂中含有氧分子 B、2H 表示两个氢分子 C、O₂中氧元素的化合价为-2价 D、CO表示一个一氧化碳分子是由一个碳原子和一个氧原子构成10. 下列微粒中,核电荷数少于核外电子数的是( )A、Na⁺ B、OH⁻ C、O₂ D、Mg11. 对于Fe、Fe²⁺、Fe³⁺三种微粒的判断,正确的是( )①核电荷数相同 ②核外电子数相同 ③质量几乎相等 ④等质量的三种微粒所含的质子数相同 ⑤三种粒子的化学性质相似
A、①③④ B、①③⑤ C、②③④ D、①②③④⑤12. 氕()、氘()、氚()是氢的三种同位素原子。 下列说法正确的是( )A、氕、氘、氚是三种不同的元素 B、三种原子的质量相等 C、三种原子的核外电子数不同 D、氕原子中的中子数为013. 对于下列几种化学符号,有关说法正确的是 ( )①H ②Fe²⁺ ③Cu
④P₂O₅ ⑤Fe³⁺ ⑥NaCl
A、能表示一个分子的是①④⑥ B、表示物质组成的化学式是③④⑥ C、②⑤的质子数相同,化学性质也相同 D、④中的数字“5”表示五氧化二磷中有5个氧原子14. 现有32g某可燃物在密闭容器中完全燃烧后,测得生成88g二氧化碳和72g水,关于该可燃物的说法正确的是( )A、一定是氧化物 B、只含有碳、氢两种元素 C、一定含有碳、氢、氧三种元素 D、一定含有碳、氢元素,可能含有氧元素15. 下列各组化合物,所含原子团化合价不同的一组是……( )A、Ca(OH)₂、KNO₃ B、KNO₃、KClO₃ C、CaCO₃、Na₂SO₄ D、KMnO₄、K₂MnO₄16. 如图是铜元素和硫元素常见的化合价坐标图,c表示的化合物的化学式是( )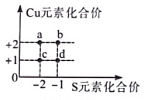 A、CuS B、Cu₂S₂ C、Cu₂S D、CuS₂17. 假设1个甲原子的质量为n千克,甲原子的相对原子质量为b,则1个标准的碳原子的实际质量可以表示为………………( )A、千克 B、12 C、12千克 D、千克18. 元素的化合价不同,组成的物质也多种多样,在下列纯净物中,化学式书写及元素的化合价标注均正确的是………………( )A、 B、 C、 D、19. 下列物质一定属于混合物的是……………………………( )A、含铁70%的氧化铁(Fe₂O₃) B、含氮35%的硝酸铵(NH₄NO₃) C、冰和水的混合物 D、含碳10%的碳酸钙(CaCO₃)20. 作为相对原子质量标准的碳-12可以写成。1个原子的质量为a千克,1个分子的质量为b千克。若以分子中的1个氧原子质量的1/16作为相对原子质量的标准,则的相对分子质量是……………………………………………( )A、 B、 C、 D、21. 某元素原子 A 的质子数为 a,若 B³⁺和A²⁻具有相同的核外电子数,则B元素的质子数为( )A、a-2+3 B、a-2-3 C、a+2+3 D、a+2-322. 某4.4g纯净物在氧气中完全燃烧,生成13.2g二氧化碳和7.2g水。下列说法中不正确的是( )A、该纯净物中含有碳、氢元察,不含氧元素 B、该反应中O2和CO2的质量比为14:11 C、该反应中O2和H2O的分子数之比为5:4 D、该纯净物中C、H原子个数比为3:823. 在一个密闭容器中,92g酒精(C2H5OH)不完全燃烧,全部变成CO、CO2和H2O。恢复至室温,所得气体中氧元素质量分数为36%,则参与反应的氧气质量为( )A、174g B、87g C、136g D、91g24. 室温下某气体可能是由SO、CO、N2中的一种或几种组成,测得该气体中氧元素的质量分数为50%,则该气体可能为下列组成中的( )
A、CuS B、Cu₂S₂ C、Cu₂S D、CuS₂17. 假设1个甲原子的质量为n千克,甲原子的相对原子质量为b,则1个标准的碳原子的实际质量可以表示为………………( )A、千克 B、12 C、12千克 D、千克18. 元素的化合价不同,组成的物质也多种多样,在下列纯净物中,化学式书写及元素的化合价标注均正确的是………………( )A、 B、 C、 D、19. 下列物质一定属于混合物的是……………………………( )A、含铁70%的氧化铁(Fe₂O₃) B、含氮35%的硝酸铵(NH₄NO₃) C、冰和水的混合物 D、含碳10%的碳酸钙(CaCO₃)20. 作为相对原子质量标准的碳-12可以写成。1个原子的质量为a千克,1个分子的质量为b千克。若以分子中的1个氧原子质量的1/16作为相对原子质量的标准,则的相对分子质量是……………………………………………( )A、 B、 C、 D、21. 某元素原子 A 的质子数为 a,若 B³⁺和A²⁻具有相同的核外电子数,则B元素的质子数为( )A、a-2+3 B、a-2-3 C、a+2+3 D、a+2-322. 某4.4g纯净物在氧气中完全燃烧,生成13.2g二氧化碳和7.2g水。下列说法中不正确的是( )A、该纯净物中含有碳、氢元察,不含氧元素 B、该反应中O2和CO2的质量比为14:11 C、该反应中O2和H2O的分子数之比为5:4 D、该纯净物中C、H原子个数比为3:823. 在一个密闭容器中,92g酒精(C2H5OH)不完全燃烧,全部变成CO、CO2和H2O。恢复至室温,所得气体中氧元素质量分数为36%,则参与反应的氧气质量为( )A、174g B、87g C、136g D、91g24. 室温下某气体可能是由SO、CO、N2中的一种或几种组成,测得该气体中氧元素的质量分数为50%,则该气体可能为下列组成中的( )①SO2 ②SO2、CO ③SO2、N2 ④CO、N2 ⑤SO2、CO、N2
A、①②③ B、②③⑤ C、①②⑤ D、①④⑤二、填空题
-
25.(1)、用化学符号表示。
两个氢氧根离子;硫酸铁;
2个氮分子;正二价的镁元素。
(2)、写出符号“2CH₄”中数字的含义。①“2”表示。
②“4”表示。
(3)、写出下列化学符号中数字“2”的含义。①Fe²+。
+2
②MgO。
26.(1)、相对分子质量最小的物质的化学式是。(2)、有一种原子,它的原子核内有20个中子,核外有19个电子,它有个质子,它的相对原子质量是。(3)、铁酸钠(化学式为Na₂FeO₄)是一种新型杀菌净水剂,铁酸钠中铁元素的化合价是。27. 科学家对元素的相对原子质量的认识经历了漫长的时间。材料一:19世纪初,有化学家认为:氢是母体,其他元素原子的相对原子质量理论上都是氢的整数倍,少数元素如Cl是35.5倍,则是由于实验误差造成的。
材料二:1886年,英国科学家克鲁克斯大胆假设:同一元素的原子,可以有不同的相对原子质量。化学家测定出的元素相对原子质量是其不同原子相对原子质量的平均值。
材料三:1961年8月,国际上采用12C的1/12作为相对原子质量的标准,确定各个同位素原子的相对原子质量。某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和。
(1)、在克鲁克斯的假设中,同种元素的原子,相对原子质量却不同,是因为原子结构中的某种微粒数不同,该微粒的名称是。(2)、结合已学知识和上述材料分析,下列说法正确的是_______。(可多选)A、自然界中大部分元素都有同位素原子,由此推测大部分元素的相对原子质量不是整数 B、CI的相对原子质量是35.5,其自然界仅有的两种同位素原子中,35Cl和37CI的原子个数比约为1:1 C、自然界中氢以氕、氘、氚三种同位素的形式存在,氕占百分比达99.9844%,则氢元素的相对原子质量约等于氕原子的相对原子质量 D、在化学变化中某金属原子失去电子与其他原子化合,计算该化合物相对分子质量时不能使用该金属元素原来的相对原子质量三、解答题
-
28. 元素周期表是学习化学的重要工具。如表是元素周期表中的一部分,请回答下列问题:
第一周期
1H
2He
第二周期
3Li
4Be
5B
6C
①
80
9F
10Ne
第三周期
11Na
12Mg
13Al
14Si
15P
16S
17Cl
18Ar
(1)、表中,①所示元素的名称是 , 含氧化合物中相对分子质量最小的化学式为。(2)、X²⁻与Ar的核外电子数相同,X的元素名称是 , 表中与它化学性质相似的元素是 。(3)、碳一14是碳的一种具放射性的同位素,现常用碳-14呼气检查胃部有没有出现幽门螺杆菌的感染,碳一14的中子数为 , 由碳一14构成的¹⁴CO₂的相对分子质量为。29. 在现代生活中,人们越来越注重微量元素的摄取。碘元素对人体有着至关重要的作用,如图是某地市场销售的一种“加碘食盐”包装袋上的部分说明,根据图回答下列问题。 (1)、“食用碘盐”属于(填“纯净物”或“混合物”)。(2)、碘酸钾中碘元素的化合价为。(3)、上述“含碘量”中的碘是指。(填序号)。
(1)、“食用碘盐”属于(填“纯净物”或“混合物”)。(2)、碘酸钾中碘元素的化合价为。(3)、上述“含碘量”中的碘是指。(填序号)。①碘酸钾 ②碘元素 ③碘单质 ④碘分子
(4)、由上述“文字说明”可推测碘酸钾的一种化学性质是。(5)、碘酸钾中钾元素、碘元素的质量比是 , 碘酸钾中碘元素的质量分数是(结果精确到0.1%)。(6)、通过计算说明,上述“加碘食盐”1000克中含碘酸钾的最低质量为多少毫克?30. 据图回答下列问题。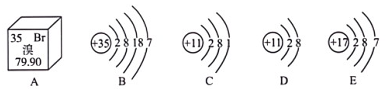 (1)、图A所示中溴的相对原子质量是。(2)、与B的化学性质相似的粒子是(填字母)。(3)、D的粒子符号为 。(4)、B与C形成化合物的化学式为。
(1)、图A所示中溴的相对原子质量是。(2)、与B的化学性质相似的粒子是(填字母)。(3)、D的粒子符号为 。(4)、B与C形成化合物的化学式为。四、综合说理题
-
31. 化合价是一个重要的化学概念,科学上用“化合价”来表示原子之间相互化合的数目。下面是对元素化合价的部分探究过程。
【提出问题一】元素正、负化合价有何规律?
推测一:金属元素都显正价;
推测二:非金属元素只有负价。
【举例及分析一】
(1)、NaCl、FeO、Al₂O₃中金属元素化合价分别为+1、+2、+3,其他金属也都显正价,则推测一正确。金属都显正价的原因可能为(2)、H₂O、SO₂、CO₂中H、O、S、C元素的化合价分别为+1、-2、+4、+4,说明推测二(填“成立”或“不成立”)。(3)、金属元素与非金属元素形成化合物时,非金属元素显价。