浙教版科学中考复习优中选优-化学-第06节-分子、原子和元素
试卷更新日期:2024-03-13 类型:一轮复习
一、单选题
-
1. 甲醛是一种防腐剂,如图是甲醛燃烧的微观示意图。有关说法错误的是( )
 A、该反应为置换反应 B、参加反应的两种物质的质量比为15:16 C、生成物均由两种元素组成 D、反应前后分子总数不变2. 芯片主要以高纯度的单质硅(Si)为原料制成,在半导体硅元件生产中,常用氢氟酸(HF)来清除硅表面的氧化膜,反应原理可表示为SiO2+6HF===H2SiF6+2X,已知硅元素显+4 价。下列说法错误的是( )A、生成物X的化学式是H2O B、H2SiF6中氟元素显-1价 C、该反应是复分解反应 D、地壳中硅元素含量仅次于氧元素3. 生活中常见的“加铁酱油”、“富硒大米”、“高钙奶粉”等物质中的“铁”、“硒”、“钙”指的是( )A、单质 B、元素 C、原子 D、分子4. 人体细胞中元素含量如图。有关说法正确的是 ( )
A、该反应为置换反应 B、参加反应的两种物质的质量比为15:16 C、生成物均由两种元素组成 D、反应前后分子总数不变2. 芯片主要以高纯度的单质硅(Si)为原料制成,在半导体硅元件生产中,常用氢氟酸(HF)来清除硅表面的氧化膜,反应原理可表示为SiO2+6HF===H2SiF6+2X,已知硅元素显+4 价。下列说法错误的是( )A、生成物X的化学式是H2O B、H2SiF6中氟元素显-1价 C、该反应是复分解反应 D、地壳中硅元素含量仅次于氧元素3. 生活中常见的“加铁酱油”、“富硒大米”、“高钙奶粉”等物质中的“铁”、“硒”、“钙”指的是( )A、单质 B、元素 C、原子 D、分子4. 人体细胞中元素含量如图。有关说法正确的是 ( ) A、氧元素主要来自吸入的空气 B、磷元素是人体中的微量元素 C、缺钙会导致青少年发育不良 D、硫和钾在人体中各占0.75%5. 重氢可应用于光导纤维制备。重氢和氢都属于氢元素,是因为它们的原子具有相同的( )A、质子数 B、中子数 C、体积 D、相对原子质量6. 以下关于足球烯(化学式:C₆₀)的说法正确的是( )A、足球烯是由碳原子直接构成的物质 B、一个足球烯中含有60个电子 C、足球烯分子是保持足球烯化学性质的最小微粒 D、足球烯是一种有机物7. 如图为碳-14 原子的结构示意图,由图可知碳-14原子 ( )
A、氧元素主要来自吸入的空气 B、磷元素是人体中的微量元素 C、缺钙会导致青少年发育不良 D、硫和钾在人体中各占0.75%5. 重氢可应用于光导纤维制备。重氢和氢都属于氢元素,是因为它们的原子具有相同的( )A、质子数 B、中子数 C、体积 D、相对原子质量6. 以下关于足球烯(化学式:C₆₀)的说法正确的是( )A、足球烯是由碳原子直接构成的物质 B、一个足球烯中含有60个电子 C、足球烯分子是保持足球烯化学性质的最小微粒 D、足球烯是一种有机物7. 如图为碳-14 原子的结构示意图,由图可知碳-14原子 ( )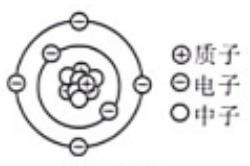 A、含有6个中子 B、含有14个质子 C、核电荷数为 6 D、质子数和中子数相等8. 科学家使用普通氧分子和带正电的氧离子,制造出了一种由4个氧原子构成的新型氧分子(O₄)。下列叙述正确的是……( )A、O₄是一种新型的化合物 B、O₄和O₂的性质完全相同 C、O₄和O₂混合后形成的是混合物 D、一个O₄分子中含有2个O₂分子9. 化学变化中一定不能实现的变化是………………………( )A、一种分子变成另一种分子 B、一种离子变成另一种离子 C、一种原子变成另一种原子 D、一种单质变成另一种单质10. 如图为物质、元素及构成微粒的相互关系图,下列说法不正确的是( )
A、含有6个中子 B、含有14个质子 C、核电荷数为 6 D、质子数和中子数相等8. 科学家使用普通氧分子和带正电的氧离子,制造出了一种由4个氧原子构成的新型氧分子(O₄)。下列叙述正确的是……( )A、O₄是一种新型的化合物 B、O₄和O₂的性质完全相同 C、O₄和O₂混合后形成的是混合物 D、一个O₄分子中含有2个O₂分子9. 化学变化中一定不能实现的变化是………………………( )A、一种分子变成另一种分子 B、一种离子变成另一种离子 C、一种原子变成另一种原子 D、一种单质变成另一种单质10. 如图为物质、元素及构成微粒的相互关系图,下列说法不正确的是( )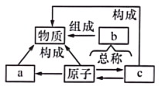 A、图中a为分子,b为元素,c为离子 B、由图可知,分子、原子、离子都是构成物质的微粒 C、原子得到电子可形成阴离子,原子失去电子可形成阳离子 D、不同种元素的两种离子,质子数一定不相同,电子数也一定不相同11. 在“2H₂O通直流电2H₂个+O₂个”的变化中,最小的粒子是( )A、H₂O B、H₂ C、O₂ D、H和O12. 下列选项不属于模型的是…………………………………( )A、
A、图中a为分子,b为元素,c为离子 B、由图可知,分子、原子、离子都是构成物质的微粒 C、原子得到电子可形成阴离子,原子失去电子可形成阳离子 D、不同种元素的两种离子,质子数一定不相同,电子数也一定不相同11. 在“2H₂O通直流电2H₂个+O₂个”的变化中,最小的粒子是( )A、H₂O B、H₂ C、O₂ D、H和O12. 下列选项不属于模型的是…………………………………( )A、
甲烷分子 B、
家庭电路 C、
磁感线 D、
高压危险13. 卢瑟福的α粒子(带正电)轰击金箔实验中,能证明绝大部分质量都集中在原子核上的运动轨迹原子核是…………………………………………( ) A、a B、b C、c D、d14. 下列说法正确的是…………………………………………( )A、原子核内的质子数和核电荷数一定相等 B、原子核中的质子数和中子数一定相等 C、原子核一定是由质子和中子构成的 D、元素的化学性质取决于原子核内的质子数15. 下列关于Na、Na+两种粒子的判断正确的是……………( )
A、a B、b C、c D、d14. 下列说法正确的是…………………………………………( )A、原子核内的质子数和核电荷数一定相等 B、原子核中的质子数和中子数一定相等 C、原子核一定是由质子和中子构成的 D、元素的化学性质取决于原子核内的质子数15. 下列关于Na、Na+两种粒子的判断正确的是……………( )①核电荷数相同 ②核外电子数相等 ③电子层结构完全相同
④质量几乎相等 ⑤质子数相等 ⑥Na+比Na稳定
A、①④⑤ B、①③⑤⑥ C、①④⑤⑥ D、②③④二、填空题
-
16. 有水(H₂O)、双氧水(H₂O₂)、重水(D₂O)(“D”表示原子核中有一个质子和一个中子的氢原子)三种物质,从物质组成的角度看,这三种物质所含的元素共有种,18克水中含有的氧元素的质量与克双氧水中含有的氧元素质量相等。17. 有核电荷数均小于20的A、B、C、D四种元素。A和B能形成A₂B,其中A元素的质量分数约为11.1%,A元素原子内有1个质子,C原子和D+分别比A原子多11个和9个电子,试回答下列问题。(1)、写出各元素的名称:A , C。(2)、写出B和D元素能组成化合物的化学式:。18. 在这一章中我们已经学习和接触了以下几种微粒:
①分子 ②原子 ③电子 ④原子核 ⑤质子 ⑥中子 ⑦离子(阳离子和阴离子),请用恰当的序号填空。
(1)、带正电的是。(2)、带负电的是。(3)、不显电性的是。(4)、能直接构成物质的是。(5)、质量最小的是。(6)、在同一原子中数目相等是。(7)、化学变化中最小的粒子是。(8)、质量与氢原子大约相等的是。三、解答题
-
19. 目前许多国家都在大力进行热核聚变自持反应堆的研究开发,并已取得了重要进展。如图为反应的示意图,“
 ”、“
”、“ ”、“
”、“ ”表示原子中的不同微粒。
”表示原子中的不同微粒。
 (1)、仿照①②,在图中的③中画出其原子核。(2)、①②③中互为同位素原子的是(填序号);该反应(填“是”或“不是”)化学反应。20. (2022·温州)“原子--分子”学说的建立经历了曲折的过程。
(1)、仿照①②,在图中的③中画出其原子核。(2)、①②③中互为同位素原子的是(填序号);该反应(填“是”或“不是”)化学反应。20. (2022·温州)“原子--分子”学说的建立经历了曲折的过程。材料一:1803年,道尔顿在原子论中提出:元素由微小的不可分的原子组成;不同元素的原子以简单数目比例形成不可再分的原子——“复杂原子”。
材料二:1809年,盖—吕萨克认同道尔顿的原子论,并提出自己的假说:在同温同压下,相同体积的不同气体中含有相同数目的原子(包括“复杂原子”)。道尔顿反对盖一吕萨克的假说,他认为若该假说成立,解释化学反应时,有些反应会推导出“半个原子”,与原子论矛盾。
材料三:1811年,阿伏加德罗提出分子学说,解决了道尔顿和盖一吕萨克的矛盾。随后科学家们确立并逐步完善了“原子—分子”学说。
(1)、1897 年,汤姆生发现原子内有带负电的 , 否定了“原子不可再分”的观点。(2)、道尔顿原子论中“复杂原子”构成的物质,按现在物质的组成分类,属于纯净物中的。(3)、依据道尔顿的原子论和盖一吕萨克的假说,下列反应能推导出“半个原子”的是____。(可多选)A、1升氢气和1升氯气化合成2升氯化氢气体 B、2升氢气和1升氧气化合成2升水蒸气 C、木炭与1升氧气化合成1升二氧化碳 D、木炭与1升二氧化碳化合成2升一氧化碳 E、硫与1升氢气化合成1升硫化氢气体21. 征服原子——揭开原子的神秘面纱。请回答下列问题。(1)、1803年,近代化学之父,英国科学家道尔顿(Dalton J)在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分。而元素由微小的不可分的原子构成,不同元素的原子还可以简单数目比例形成不可再分的原子——“复杂原子”……但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。1811年,意大利化学家阿伏加德罗提出:有些物质也是由分子构成,原子的基本工作形式是分子。①1897年,汤姆生通过实验发现了 , 进一步发展了原子论、分子论。汤姆生主要是纠正了“道尔顿原子论”中的观点。②1911年,卢瑟福又通过实验,推测原子是由构成的,并提出了沿用至今的现代原子结构理论。③道尔顿原子论中“复杂原子”构成的物质,按现在物质的组成分类,属于纯净物中的。
(2)、 道尔顿的原子论,不是事实的归纳,而是思维的产物,体现了直觉和想象在科学创造中的作用。在科学研究中,像汤姆生和卢瑟福这样,根据实验现象进行解释的过程叫做。原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了来表达他们的理论成果。22. 有A、B、C、D四种元素,已知A元素是人体中含量最多的元素,B元素的原子可以直接构成最坚硬的矿物单质,C元素的原子失去一个电子后只剩下一个质子,D+的电子层结构与氖原子相同。请回答下列问题。(1)、由A元素组成单质的化学式为。(2)、B元素的元素符号为。(3)、C元素的离子符号为。(4)、A、C、D三种元素组成化合物的化学式为。23. 科学家对元素的相对原子质量的认识经历了漫长的时间。阅读材料,回答下列问题。材料—:19世纪初,有化学家认为氢是母体,其他元素原子的相对原子质量理论上都是氢的整数倍。
材料二:1886年,英国科学家克鲁克斯大胆假设:同一元素的原子,可以有不同的相对原子质量。化学家测定出的元素相对原子质量是其不同原子相对原子质量的平均值。
材料三:1961年8月,国际上采用2C的1/12作为相对原子质量的标准,确定各个同位素原子的相对原子质量。某元素的相对原子质量是“其各种同位素原子的相对原子质量”乘以“各自在该元素中所占的百分比”之后,相加所得的和。
(1)、在克鲁克斯的假设中,同种元素的原子,相对原子质量却不同,是因为原子结构中的某种微粒数不同,该微粒的名称是。(2)、结合已学知识和上述材料分析可知:①自然界中大部分元素的相对原子质量都不是整数,原因是大部分元素都有。
②Cl的相对原子质量是35.5,其自然界仅有和两种同位素原子,则自然界中和的原子个数比为。
③自然界中氢有氖、氘、氚三种同位素原子,而氢元素的相对原子质量几乎和气相等,原因是。