浙教版科学中考复习优中选优-化学-第05节-结晶、过滤和蒸馏
试卷更新日期:2024-03-13 类型:一轮复习
一、单选题
-
1. 下列混合物的分离不能达到目的的是( )A、海水淡化得到淡水——蒸馏 B、泥水除去泥沙——过滤 C、分离食盐和糖——加水溶解并过滤 D、海水中提取食盐——蒸发结晶2. 下列关于水体净化的说法中,正确的是( )A、在自来水厂的水净化过程中,常需要通入氯气,杀死水中的微生物 B、蒸馏法是物理变化过程,是利用物质的溶解性不同而进行分离 C、沉淀法、过滤法等净化方法都是利用物质的化学性质 D、将自来水进行充分的过滤,就可以得到纯净的水3. 下列关于粗盐提纯实验操作要领,其中错误的是( )A、溶解、过滤和蒸发时都要用到玻璃棒 B、引流的玻璃棒应该靠在三层滤纸的一边 C、漏斗中的滤纸的边缘要低于漏斗的边缘 D、蒸发结晶食盐时,一直要加热到水分完全蒸干4. 下表是不同温度时NaCl、KNO3的溶解度.则下列说法正确的是( )
温度/℃ 0 20 40 60 80 溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4 KNO3 13.3 31.6 63.9 110 169 A、将60℃时KNO3的饱和溶液降温至20℃,溶质、溶剂的质量都会减少 B、将80℃时NaCl、KNO3两种饱和溶液降温至20℃,析出晶体的质量一定是:KNO3>NaCl C、40℃时,将5gNaCl、5gKNO3分别加入10g水中,所得溶液的溶质质量分数不相等 D、用上表数据绘制成NaCl、KNO3的溶解度曲线,两条曲线交点对应的温度范围是0~20℃5. 海水通过晒制得到的粗盐中常含有泥沙、MgCl2、CaCl2、Na2SO4等杂质,如图是除去粗盐中可溶性杂质的过程,下列说法正确的是( )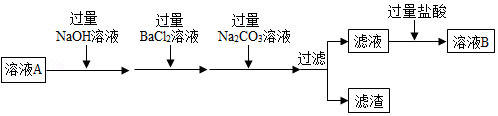 A、经过一系列除杂操作后,最终得到溶液B中的溶质只有NaCl B、滤渣中共有三种沉淀 C、为证明所加盐酸过量,可取少量溶液B,向其中滴加硝酸银溶液,看是否有沉淀生成 D、BaCl2和Na2CO3的添加顺序不能颠倒,否则除不尽Ba2+6. 下表是氯化钠和硝酸钾的溶解度表,下列叙述中,错误的是( )
A、经过一系列除杂操作后,最终得到溶液B中的溶质只有NaCl B、滤渣中共有三种沉淀 C、为证明所加盐酸过量,可取少量溶液B,向其中滴加硝酸银溶液,看是否有沉淀生成 D、BaCl2和Na2CO3的添加顺序不能颠倒,否则除不尽Ba2+6. 下表是氯化钠和硝酸钾的溶解度表,下列叙述中,错误的是( )氯化钠和硝酸钾在不同温度下的溶解度
温度(℃)
0
20
40
60
80
100
氯化钠(克)
35.7
36.0
36.6
37.3
38.4
39.8
硝酸钾(克)
13.3
31.6
63.9
110
169
246
A、氯化钠和硝酸钾的溶解度随温度的升高而增大 B、在20℃时,要溶解36克氯化钠至少需要100克水 C、若硝酸钾中混有少量的氯化钠,可采用冷却热饱和溶液的方法来提纯硝酸钾 D、将80℃的氯化钠饱和溶液和80℃的硝酸钾饱和溶液各100克降温至20℃,析出晶体的质量分别是2.4克和137.4克7. 粗盐中常含有MgCl2、CaCl2、Na2SO4及泥沙等杂质,常用下面的流程进行提纯。下列说法正确的是 ( ) A、加入试剂a的顺序可以是过量的NaOH溶液、Na2CO3溶液、BaCl2溶液 B、加入试剂a后,将混合物过滤,得到的沉淀中除泥沙外还含有4种不溶物 C、向溶液I中加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,但不应过量,否则会影响精盐的纯度 D、溶解过程需要进行搅拌,目的是提高氯化钠的溶解度8. 为了除去粗盐中的 Ca2+、Mg2+、SO42-及泥沙,得到纯净的 NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序( )
A、加入试剂a的顺序可以是过量的NaOH溶液、Na2CO3溶液、BaCl2溶液 B、加入试剂a后,将混合物过滤,得到的沉淀中除泥沙外还含有4种不溶物 C、向溶液I中加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,但不应过量,否则会影响精盐的纯度 D、溶解过程需要进行搅拌,目的是提高氯化钠的溶解度8. 为了除去粗盐中的 Ca2+、Mg2+、SO42-及泥沙,得到纯净的 NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序( )①过滤 ②加过量NaOH 溶液 ③加适量盐酸 ④加过量Na2CO3 溶液 ⑤加过量BaCl2 溶液.
A、① B、①②④⑤③ C、②⑤④①③ D、④②⑤9. 根据图示实验、部分记录和溶解度曲线,判断下列说法正确的是( ) A、无法判断a中溶液是否为饱和溶液 B、c中溶液溶质的质量分数为33.3% C、b中溶液在加热过程中始终为饱和溶液 D、用降温的的方法可获得大量氯化钠晶体10. 20℃时,取一定质量的固体硝酸钾于烧杯中,把100克水平均分成四份依次加入烧杯,不断搅拌,使之充分到溶解,实验过程如图所示。下列分析正确的是( )
A、无法判断a中溶液是否为饱和溶液 B、c中溶液溶质的质量分数为33.3% C、b中溶液在加热过程中始终为饱和溶液 D、用降温的的方法可获得大量氯化钠晶体10. 20℃时,取一定质量的固体硝酸钾于烧杯中,把100克水平均分成四份依次加入烧杯,不断搅拌,使之充分到溶解,实验过程如图所示。下列分析正确的是( ) A、甲烧杯中,硝酸钾溶液是不饱和溶液 B、丁烧杯中,硝酸钾溶液是不饱和溶液 C、乙→丙过程中,硝酸钾溶液的溶质质量分数变大 D、丙→丁过程中,硝酸钾溶液的溶质质量分数变大
A、甲烧杯中,硝酸钾溶液是不饱和溶液 B、丁烧杯中,硝酸钾溶液是不饱和溶液 C、乙→丙过程中,硝酸钾溶液的溶质质量分数变大 D、丙→丁过程中,硝酸钾溶液的溶质质量分数变大二、填空题
-
11. 用溶质质量分数为98%、密度为1.84克/厘米3的浓硫酸配制溶质质量分数为10%的稀硫酸100毫升,计算时必须查阅的数据是。配制过程除使用量筒、玻璃棒和胶头滴管外,还需要的一种玻璃仪器是。
12. 海水淡化可采用膜分离技术。如图一所示,对淡化膜右侧的海水加压,在其左侧得到淡水。其原理是海水中的水分子可以透过淡化膜,而其他各种离子不能透过。请回答: (1)、采用膜分离技术淡化海水的原理,与化学实验中常见的操作相似。(2)、对淡化膜右侧的海水加压后,海水中溶质的质量分数会(选填增大、减小或不变)。(3)、海水中含有大量的氯化钠,图二是氯化钠的溶解度曲线,据此可知盐场从海水中得到食盐晶体利用的方法是结晶(填降温或蒸发)。13. 易拉罐的主要成分是铝镁合金(已知其他杂质不溶于酸也不与稀硫酸反应),为了测定易拉罐铝镁合金中两种元素的质量比,小科开展了如图甲的实验,实验中生成沉淀的质量与滴入氢氧化钠溶液的质量的关系如图乙所示。
(1)、采用膜分离技术淡化海水的原理,与化学实验中常见的操作相似。(2)、对淡化膜右侧的海水加压后,海水中溶质的质量分数会(选填增大、减小或不变)。(3)、海水中含有大量的氯化钠,图二是氯化钠的溶解度曲线,据此可知盐场从海水中得到食盐晶体利用的方法是结晶(填降温或蒸发)。13. 易拉罐的主要成分是铝镁合金(已知其他杂质不溶于酸也不与稀硫酸反应),为了测定易拉罐铝镁合金中两种元素的质量比,小科开展了如图甲的实验,实验中生成沉淀的质量与滴入氢氧化钠溶液的质量的关系如图乙所示。资料:氢氧化铝是一种白色沉淀,可与氢氧化钠反应:Al(OH)3+NaOH=NaAlO2+2H2O,氢氧化镁不与氢氧化钠反应。
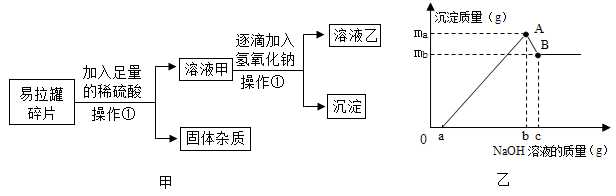 (1)、操作①表示的物质分离方法是。(2)、当滴入氢氧化钠溶液为cg时,充分反应后,溶液乙中的溶质为(填化学式)。(3)、根据实验数据,该易拉罐中铝元素和镁元素的质量比为(用mA和mB表示)。
(1)、操作①表示的物质分离方法是。(2)、当滴入氢氧化钠溶液为cg时,充分反应后,溶液乙中的溶质为(填化学式)。(3)、根据实验数据,该易拉罐中铝元素和镁元素的质量比为(用mA和mB表示)。三、实验探究题
-
14. 小科和小明同学在实验室分别用以下两种方法配制100克溶质质量分数为10%的氯化钠溶液。请回答:
 (1)、方法一中的“溶解”和方法二中的“混匀”,都要用到的玻璃仪器是。(2)、方法一中,小科在称量氯化钠固体时,发现指针向右偏转,接下去他的具体操作是。(3)、方法二中,小明用量筒量取水时俯视读数,其他操作均正确,则所配溶液中溶质的质量分数10%(选填“大于”、“小于”或“等于”)。15. 如图是实验室配制55克质量分数为20%的硝酸钾溶液的操作过程示意图。请回答:
(1)、方法一中的“溶解”和方法二中的“混匀”,都要用到的玻璃仪器是。(2)、方法一中,小科在称量氯化钠固体时,发现指针向右偏转,接下去他的具体操作是。(3)、方法二中,小明用量筒量取水时俯视读数,其他操作均正确,则所配溶液中溶质的质量分数10%(选填“大于”、“小于”或“等于”)。15. 如图是实验室配制55克质量分数为20%的硝酸钾溶液的操作过程示意图。请回答: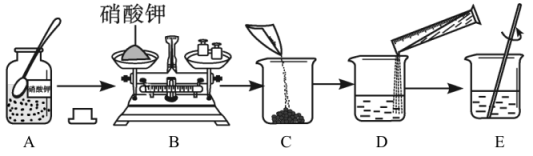 (1)、配制该硝酸钾溶液,需要硝酸钾固体的质量为克;(2)、D操作应选用(填“10毫升”“50毫升”或“100毫升”)的量筒;(3)、E操作的作用是;(4)、下列操作会引起所配溶液质量分数偏小的是____(填字母,可多选)。A、硝酸钾晶体不纯 B、配制溶液的烧杯用少量蒸馏水润洗 C、用量筒量取水时仰视读数 D、转移已配好的溶液时,有少量溶液溅出16. 小明取一包某食品包装袋内的“脱氧剂”,查阅资料发现其成分除铁粉外,可能含有碳粉、Na2CO3、NaCl、Fe2O3等。为确定其成分,进行了如下实验:
(1)、配制该硝酸钾溶液,需要硝酸钾固体的质量为克;(2)、D操作应选用(填“10毫升”“50毫升”或“100毫升”)的量筒;(3)、E操作的作用是;(4)、下列操作会引起所配溶液质量分数偏小的是____(填字母,可多选)。A、硝酸钾晶体不纯 B、配制溶液的烧杯用少量蒸馏水润洗 C、用量筒量取水时仰视读数 D、转移已配好的溶液时,有少量溶液溅出16. 小明取一包某食品包装袋内的“脱氧剂”,查阅资料发现其成分除铁粉外,可能含有碳粉、Na2CO3、NaCl、Fe2O3等。为确定其成分,进行了如下实验: (1)、过滤操作中除了需带铁圈的铁架台、滤纸、玻璃棒外,还需要用到的仪器有。(2)、写出用 pH试纸测定滤液pH的方法。(3)、试剂X的名称是。(4)、由实验可知,该包“脱氧剂”一定含有的物质是。17. 某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制一定质量分数的氯化钠溶液。
(1)、过滤操作中除了需带铁圈的铁架台、滤纸、玻璃棒外,还需要用到的仪器有。(2)、写出用 pH试纸测定滤液pH的方法。(3)、试剂X的名称是。(4)、由实验可知,该包“脱氧剂”一定含有的物质是。17. 某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制一定质量分数的氯化钠溶液。 (1)、实验一:如图,是甲组同学做粗盐提纯实验的操作示意图。请回答下列问题:
(1)、实验一:如图,是甲组同学做粗盐提纯实验的操作示意图。请回答下列问题:指出上面操作中的一处明显错误是:。
(2)、第④步骤中,当观察到蒸发皿中出现较多固体时,要采取____(填字母)的操作。A、移去酒精灯,停止搅拌 B、移去酒精灯,用玻璃棒继续搅拌 C、继续加热蒸干水分,再移去酒精灯(3)、粗盐提纯实验的操作顺序为①⑤②称量精盐并计算产率(4)、实验二:用提纯得到的精盐配制50g15%氯化钠溶液。用天平称取7.5g提纯得到的精盐,再用量筒量取42.5mL的水进行溶液配制,所配制的溶液溶质质量分数偏大。其原因可能有(填序号)
①氯化钠固体仍然不纯②量取水时,仰视读数③烧杯先用少量蒸馏水润洗④将量好的水倒入烧杯时,有少量水残留⑤配好的溶液装瓶时,有少量溶液洒出
18. 小科同学暑期去宁波象山游玩,来到了花岙岛的盐场。据说这里是浙江省最后一块传统盐场,这里的晒盐技术已传承1300多年。爱探索的小科同学从盐场带回粗盐样品,进行粗盐提纯实验,如下图: (1)、图甲中的操作①②③分别对应图乙中的(填图中字母);(2)、图乙a中,待到蒸发皿中时,撤去酒精灯。(3)、下列哪些操作会使最终精盐的产量偏低的有______(多选)。A、溶解粗盐时,加入的水量不足 B、过滤时滤纸破损,混合液流入滤液中 C、滤渣没有用蒸馏水冲洗 D、蒸发后,所得的精盐很潮湿(4)、假设图甲中的数据均通过正确合理的步骤得出,可计算氯化钠的产率=×100%=80%。请评价这样计算是否合理,并说明理由。19. 在科学实验操作考查中,小阳同学抽到的考题是“配制50克质量分数为12%的氯化钠溶液”。实验操作步骤示意图如图甲所示。
(1)、图甲中的操作①②③分别对应图乙中的(填图中字母);(2)、图乙a中,待到蒸发皿中时,撤去酒精灯。(3)、下列哪些操作会使最终精盐的产量偏低的有______(多选)。A、溶解粗盐时,加入的水量不足 B、过滤时滤纸破损,混合液流入滤液中 C、滤渣没有用蒸馏水冲洗 D、蒸发后,所得的精盐很潮湿(4)、假设图甲中的数据均通过正确合理的步骤得出,可计算氯化钠的产率=×100%=80%。请评价这样计算是否合理,并说明理由。19. 在科学实验操作考查中,小阳同学抽到的考题是“配制50克质量分数为12%的氯化钠溶液”。实验操作步骤示意图如图甲所示。 (1)、操作步骤中有误的是 (选填序号)。(2)、改正错误后,步骤②称量过程中指针如图乙所示,接下来应 , 使天平平衡。A、向右调节平衡螺母 B、向右移动游码 C、取走部分氯化钠(3)、步骤④中,量筒量取的水为毫升。(4)、步骤⑤溶解时用玻璃棒搅拌的目的是。(5)、经检测,所配制溶液的溶质质量分数偏大,其原因可能是 (选填字母)。A、量取水时,俯视读数 B、用于配制的烧杯在使用前未干燥 C、称量时,所使用的砝码生锈 D、转移称量好的氯化钠固体时,有少量洒落
(1)、操作步骤中有误的是 (选填序号)。(2)、改正错误后,步骤②称量过程中指针如图乙所示,接下来应 , 使天平平衡。A、向右调节平衡螺母 B、向右移动游码 C、取走部分氯化钠(3)、步骤④中,量筒量取的水为毫升。(4)、步骤⑤溶解时用玻璃棒搅拌的目的是。(5)、经检测,所配制溶液的溶质质量分数偏大,其原因可能是 (选填字母)。A、量取水时,俯视读数 B、用于配制的烧杯在使用前未干燥 C、称量时,所使用的砝码生锈 D、转移称量好的氯化钠固体时,有少量洒落四、解答题
-
20. 小科收集到一瓶浑浊的河水,他模拟自来水厂的净水过程,最终制成蒸馏水,过程如下图所示。
 (1)、图中a仪器的名称是。(2)、操作①的方法是。(3)、其中净化程度最高的是图中的装置。21. 从废旧电脑的某些零部件中回收金属银,设计流程如图所示:
(1)、图中a仪器的名称是。(2)、操作①的方法是。(3)、其中净化程度最高的是图中的装置。21. 从废旧电脑的某些零部件中回收金属银,设计流程如图所示: (1)、步骤 I 和步骤 II 都涉及的实验操作是。(2)、步骤 I 中加入足量稀硫酸后发生反应的化学方程式为。(3)、溶液X中只含有一种溶质, 该溶质的化学式为。(4)、据此判断, 铜、银、铝的金属活动性由强到弱的顺序是(填元素符号)。22. 小科和小明同学在实验室分别用以下两种方法配制100克溶质质量分数为10%的氯化钠溶液。请回答:
(1)、步骤 I 和步骤 II 都涉及的实验操作是。(2)、步骤 I 中加入足量稀硫酸后发生反应的化学方程式为。(3)、溶液X中只含有一种溶质, 该溶质的化学式为。(4)、据此判断, 铜、银、铝的金属活动性由强到弱的顺序是(填元素符号)。22. 小科和小明同学在实验室分别用以下两种方法配制100克溶质质量分数为10%的氯化钠溶液。请回答: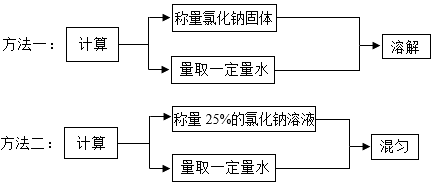 (1)、方法一中,小科在称量氯化钠固体时,他先在天平左右托盘上放上相同的纸片,并调节平衡螺母使天平平衡,接下去他应(写出具体操作),再往左盘逐渐添加氯化钠固体,直至天平重新平衡。(2)、方法二中,小明应用量筒量取毫升水,若他在做这一步时俯视读数了,其他操作均正确,则所配溶液中溶质的质量分数(填“大于”、“小于”或“等于”)10%。(3)、方法一中的“溶解”和方法二中的“混匀”,都要用到的仪器是。
(1)、方法一中,小科在称量氯化钠固体时,他先在天平左右托盘上放上相同的纸片,并调节平衡螺母使天平平衡,接下去他应(写出具体操作),再往左盘逐渐添加氯化钠固体,直至天平重新平衡。(2)、方法二中,小明应用量筒量取毫升水,若他在做这一步时俯视读数了,其他操作均正确,则所配溶液中溶质的质量分数(填“大于”、“小于”或“等于”)10%。(3)、方法一中的“溶解”和方法二中的“混匀”,都要用到的仪器是。