浙教版科学中考复习优中选优-化学-第04节-溶解度和溶质质量分数
试卷更新日期:2024-03-13 类型:一轮复习
一、单选题
-
1. 炎热的夏天,打开雪碧瓶盖时会发现雪碧自动喷出,喝了雪碧后又常常会打嗝,由此得出若要降低气体的溶解能力,下列方法中正确的是( )A、升高温度、增大气压 B、降低温度、减小气压 C、升高温度、减小气压 D、降低温度、增大气压2. 下表是硝酸钾、氯化钠两种固体物质在不同温度时的溶解度。下列有关说法中正确的是( )
温度/℃
0
10
20
30
40
50
60
溶解度/克
硝酸钾
13.3
20.9
31.6
45.8
63.9
85.5
110
氯化钠
35.7
35.8
36.0
36.3
36.6
37.0
37.3
A、在20℃-30℃温度范围内,硝酸钾和氯化钠的溶解度会出现相等的情况 B、20℃时,100克氯化钠饱和溶液中含有36克氯化钠 C、硝酸钾的溶解度大于氯化钠的溶解度 D、氯化钠中混有少量硝酸钾,可采用冷却热饱和溶液的方法提纯硝酸钾3. 下列说法正确的是( )A、某温度下两种不同物质的溶液,溶液质量分数相同,则两者溶解度一定相同 B、溶质质量分数为10%的200毫升某溶液,密度为1.2g/立方厘米,其中含溶质24g C、饱和溶液析出晶体后,溶质的质量分数一定减少 D、不饱和溶液化为饱和,其溶质的质量分数一定增大4. 下表为氢氧化钙在不同温度时的溶解度。下列有关说法正确的是( )温度℃
0
10
20
30
40
50
60
70
溶解度/g
0.185
0.176
0.165
0.153
0.141
0.138
0.116
0.106
A、氢氧化钙的溶解度随着温度的升高而增大 B、30℃时,氢氧化钙饱和溶液的溶质质量分数为 C、20℃时,将1g氢氧化钙投入到99g水中,充分反应后,所得溶液的质量为100g D、将40℃时氢氧化钙的饱和溶液降温至20℃,所得溶液的溶质质量分数不变5. 下列关于 a、b 数值的比较中,a 一定小于 b 的是( )
A、不饱和溶液中溶质的质量分数为 a%,饱和溶液中溶质的质量分数为 b% B、同一饱和溶液中,溶质的质量分数为 a%,溶解度为 b 克 C、某物质的饱和溶液中溶质的质量分数为 a%,向其中加入少量该物质后,溶质的质量分数为 b% D、某物质的溶解度在低温时为 a 克,高温时为 b 克6. 下图是对某固体物质的溶液在一定温度下进行恒温蒸发操作的实验记录,下列说法正确的是( ) A、乙中的溶液为饱和溶液 B、丁溶液的溶质质量分数大于丙 C、给丙溶液升高温度,固体一定会溶解 D、甲中的溶液一定是不饱和溶液7. 甲、乙两种物质的溶解度曲线如下图所示。下列说法正确的是( )
A、乙中的溶液为饱和溶液 B、丁溶液的溶质质量分数大于丙 C、给丙溶液升高温度,固体一定会溶解 D、甲中的溶液一定是不饱和溶液7. 甲、乙两种物质的溶解度曲线如下图所示。下列说法正确的是( )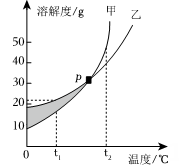 A、阴影部分的任意点表明甲、乙两种溶液都是饱和溶液 B、P点时,甲、乙两种溶液的溶质质量分数相等 C、t₂℃时,在100g水中加入60g甲,形成不饱和溶液 D、t₁℃时,甲、乙的饱和溶液升温至t₂℃,溶液的溶质质量分数甲>乙8. 下列图像能正确反映对应变化关系的是( )A、
A、阴影部分的任意点表明甲、乙两种溶液都是饱和溶液 B、P点时,甲、乙两种溶液的溶质质量分数相等 C、t₂℃时,在100g水中加入60g甲,形成不饱和溶液 D、t₁℃时,甲、乙的饱和溶液升温至t₂℃,溶液的溶质质量分数甲>乙8. 下列图像能正确反映对应变化关系的是( )A、 室温下,相同质量的锌和铁分别与足量的溶质质分数相同的稀盐酸反应
B、
室温下,相同质量的锌和铁分别与足量的溶质质分数相同的稀盐酸反应
B、 向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
C、
向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
C、 一定温度时,向一定量的饱和石灰水中加入生石灰
D、
一定温度时,向一定量的饱和石灰水中加入生石灰
D、 向一定量的NaOH和Ba(NO₃)₂溶液中逐滴加入稀H₂SO₄
9. 已知20℃时,氯化钠的溶解度为36克。在20℃时小明在甲、乙、丙三个相同的杯子中各注入100克蒸馏水,然后分别加入30克、40克和50克食盐(如图)。充分溶解后这三杯溶液的溶质质量分数大小关系为 ( )
向一定量的NaOH和Ba(NO₃)₂溶液中逐滴加入稀H₂SO₄
9. 已知20℃时,氯化钠的溶解度为36克。在20℃时小明在甲、乙、丙三个相同的杯子中各注入100克蒸馏水,然后分别加入30克、40克和50克食盐(如图)。充分溶解后这三杯溶液的溶质质量分数大小关系为 ( ) A、甲<乙<丙 B、甲<乙=丙 C、丙<乙<甲 D、甲=乙<丙10. 如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是( )
A、甲<乙<丙 B、甲<乙=丙 C、丙<乙<甲 D、甲=乙<丙10. 如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是( ) A、在①→②过程中,氯化钠的质量分数保持不变 B、在②→③过程中,氯化钠的溶解度不断增大 C、在③→④过程中,水的质量分数不断增大 D、在②→④过程中,氯化钠的质量分数先不变后增大11. 硫酸锰广泛用于医药、食品、造纸等行业.硫酸锰的溶解度曲线如图所示.下列说法正确的是( )
A、在①→②过程中,氯化钠的质量分数保持不变 B、在②→③过程中,氯化钠的溶解度不断增大 C、在③→④过程中,水的质量分数不断增大 D、在②→④过程中,氯化钠的质量分数先不变后增大11. 硫酸锰广泛用于医药、食品、造纸等行业.硫酸锰的溶解度曲线如图所示.下列说法正确的是( ) A、硫酸锰的溶解度随温度的升高而增大 B、硫酸锰的溶解度随温度的升高而减小 C、100℃的硫酸锰饱和溶液升高温度时有晶体析出 D、硫酸锰饱和溶液的质量分数约为21.9%12. 往200gFeCl3和CuCl2的混合物中加入铁粉。已知反应的先后顺序和化学方程式分别为:2FeCl3+Fe=3FeCl2;CuCl2+Fe=FeCl2+Cu。图为加入铁粉的质量与反应后剩余固体质量关系。则下列说法不正确的是( )
A、硫酸锰的溶解度随温度的升高而增大 B、硫酸锰的溶解度随温度的升高而减小 C、100℃的硫酸锰饱和溶液升高温度时有晶体析出 D、硫酸锰饱和溶液的质量分数约为21.9%12. 往200gFeCl3和CuCl2的混合物中加入铁粉。已知反应的先后顺序和化学方程式分别为:2FeCl3+Fe=3FeCl2;CuCl2+Fe=FeCl2+Cu。图为加入铁粉的质量与反应后剩余固体质量关系。则下列说法不正确的是( )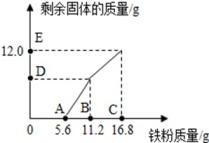 A、B点后溶液的颜色为浅绿色 B、D点对应纵坐标为6.4 C、该200g溶液中的CuCl2质量分数为6.85% D、取DE两点间的剩余固体加入盐酸,均有气泡产生13. 为探究硝酸钾(KNO3)的溶解性,进行了如图所示实验(实验过程)结合硝酸钾在不同温度下的溶解度,判断下列说法不正确的是( )
A、B点后溶液的颜色为浅绿色 B、D点对应纵坐标为6.4 C、该200g溶液中的CuCl2质量分数为6.85% D、取DE两点间的剩余固体加入盐酸,均有气泡产生13. 为探究硝酸钾(KNO3)的溶解性,进行了如图所示实验(实验过程)结合硝酸钾在不同温度下的溶解度,判断下列说法不正确的是( )
温度/℃
10
20
30
40
50
60
KNO3溶解度/g
20.9
31.6
45.8
63.9
85.5
110.0
A、①③中的溶液均为不饱和溶液 B、②③中溶液的质量:③>② C、②③④中溶液的溶质质量分数:③>②>④ D、④中析出晶体的质量是0.9g14. 有一杯t℃时的硝酸钾溶液,在该溶液中加入x克硝酸钾晶体,充分搅拌后有y克没有溶解;若将原溶液加热蒸发掉2克水再冷却至原温度,溶液恰好达到饱和,则t℃时硝酸钾的溶解度为( )A、克 B、克 C、克 D、克15. 固体甲、乙、丙在不同温度下的溶解度如表所示,甲、乙、丙从溶液中析出的晶体不含结晶水。下列说法正确的是( )温度/℃ 0 20 40 60 80 溶解度/g 甲 0.18 0.16 0.14 0.12 0.09 乙 35.7 36.0 36.6 37.3 38.4 丙 13.3 31.6 63.9 110 169 A、固体甲的溶解度随温度的升高而增大 B、20℃时,丙溶液中溶质和溶剂质量比为31.6:100 C、分别将等质量的乙、丙饱和溶液由60℃降温到20℃,溶液中溶质质量大小:丙>乙 D、分别将等质量的甲、丙饱和溶液由60℃降温到20℃,溶液中溶剂质量大小:甲>丙16. t℃时,将一定质量的甲、乙两种溶液进行恒温蒸发,蒸发溶剂的质量与析出晶体的质量之间的关系如图所示。下列说法错误的是( )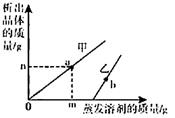 A、蒸发溶剂前甲是饱和溶液 B、b点对应的乙溶液是饱和溶液 C、t℃时,乙的溶解度更大 D、a点时,甲溶液的质量分数为
A、蒸发溶剂前甲是饱和溶液 B、b点对应的乙溶液是饱和溶液 C、t℃时,乙的溶解度更大 D、a点时,甲溶液的质量分数为二、实验探究题
-
17. 为研究溶解度曲线的应用,学习小组查得资料:某钢铁厂处理高盐废水(含氯化钠、硫酸钠及微量的其他盐)的流程、相关物质的溶解度曲线如下图所示。请和小组同学一起研究。

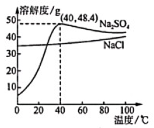 (1)、废水中的硫酸钠是氢氧化钠和硫酸反应的生成物,化学方程式为。(2)、当温度高于℃时,硫酸钠的溶解度随温度升高而降低。(3)、40℃时,将50g硫酸钠固体加入 100g水中,充分搅拌后所得溶液的溶质质量分数为(列出计算式即可)。(4)、降温至0℃的“冷冻结晶”过程,析出的两种物质中较多的是。(5)、结合溶解度曲线解释,“蒸发结晶2”主要得到氯化钠的原因是。18. 小科欲配制80克5%的氯化钠溶液,该实验的部分操作如图所示。
(1)、废水中的硫酸钠是氢氧化钠和硫酸反应的生成物,化学方程式为。(2)、当温度高于℃时,硫酸钠的溶解度随温度升高而降低。(3)、40℃时,将50g硫酸钠固体加入 100g水中,充分搅拌后所得溶液的溶质质量分数为(列出计算式即可)。(4)、降温至0℃的“冷冻结晶”过程,析出的两种物质中较多的是。(5)、结合溶解度曲线解释,“蒸发结晶2”主要得到氯化钠的原因是。18. 小科欲配制80克5%的氯化钠溶液,该实验的部分操作如图所示。 (1)、需要称取氯化钠的质量 克。称量时出现了右盘略低的现象,如图甲,接下来的具体操作是 。(2)、量取水时,选用规格为 (选填“100”或“200”)毫升的量筒更加合理。(3)、丙中玻璃棒的作用是 。(4)、下列操作会导致配制的氯化钠溶液质量分数偏小的有 ____。A、砝码磨损 B、氯化钠固体不纯 C、按照图乙的方法读数 D、将量筒中的水倒入烧杯时,有水洒出
(1)、需要称取氯化钠的质量 克。称量时出现了右盘略低的现象,如图甲,接下来的具体操作是 。(2)、量取水时,选用规格为 (选填“100”或“200”)毫升的量筒更加合理。(3)、丙中玻璃棒的作用是 。(4)、下列操作会导致配制的氯化钠溶液质量分数偏小的有 ____。A、砝码磨损 B、氯化钠固体不纯 C、按照图乙的方法读数 D、将量筒中的水倒入烧杯时,有水洒出三、解答题
-
19. 小科打开雪碧瓶盖,发现瓶中立即出现大量气泡。将雪碧倒入干净的塑料杯中,小科发现雪碧中的气泡上升并且不断变大。再加入几粒葡萄干,发现葡萄干沉入杯底,不久,有些葡萄干吸附了小气泡上升,上升到液面后,又下沉到杯底,如此反复像“跳舞”一样。请用所学知识解释上述现象。20. 盐水选种是一种巧妙的挑选优质种子的方法。长得很饱满的小麦种子,密度超过1.2×103kg/m3;长得很饱满的水稻种子,密度超过1.1×103kg/m3;干瘪的和被虫子蛀坏的种子的密度都比饱满种子的密度都要小得多。下表为食盐溶液其溶质质量分数与密度关系。
溶质质量分数
5%
10%
15%
20%
26%
溶液密度(g/cm3)
1.03
1.07
1.10
1.15
1.20
请回答下列问题:
(1)、应选用表中溶质质量分数为的食盐溶液才能挑选出很饱满的水稻种子。(2)、配制200千克质量分数为20%的食盐溶液需要食盐千克。(3)、若取上述配制好的质量分数为20%的食盐溶液60千克,能配制质量分数为15%的食盐溶液多少千克?需加多少体积的水?
21. 某校化学兴趣小组用一瓶含有少量氯化钠的硫酸钠固体样品,进行如图所示的实验.
请根据以上信息计算(结果保留到小数点后两位):
(1)、反应生成沉淀的质量为 .(2)、样品中氯化钠的质量.(3)、滤液中溶质的质量分数.22. 溶解度研究物质的溶解对于生产、生活有着重要意义。下表是碳酸钠的部分溶解度数据
温度/℃
20
30
40
50
60
80
100
溶解度/g
21.8
39.7
48.8
47.3
46.4
45.1
44.7
(1)、由表中数据可知,20℃时,碳酸钠饱和溶液的溶质质量分数是(精确到1%)。(2)、小东同学进行了如图所示的实验,若使烧杯③中的溶液达到饱和,至少需再加入g 碳酸钠;升温至60℃时,烧杯④中会出现的现象是 。 (3)、20℃时,将装有饱和碳酸钠溶液(底部有碳酸钠粉末)的小试管放入盛水的烧杯中。向烧杯中加入某物质后,试管底部的粉末减少,则加入的物质可能是(填字母序号),该物质形成的溶液中存在的微粒有。A.氢氧化钠 B.碳酸钙 C.硝酸铵 D. 氯化钠23. 准确称取5克铝土矿(含Al2O3 , Fe2O3 , SiO2)样品,放入盛有50克某质量分数的硫酸溶液的烧杯中,充分反应后过滤,再向滤液中加入20%的氢氧化钠溶液,产生沉淀的质量与所加入的氢氧化钠溶液质量的关系如图所示.试求:
(3)、20℃时,将装有饱和碳酸钠溶液(底部有碳酸钠粉末)的小试管放入盛水的烧杯中。向烧杯中加入某物质后,试管底部的粉末减少,则加入的物质可能是(填字母序号),该物质形成的溶液中存在的微粒有。A.氢氧化钠 B.碳酸钙 C.硝酸铵 D. 氯化钠23. 准确称取5克铝土矿(含Al2O3 , Fe2O3 , SiO2)样品,放入盛有50克某质量分数的硫酸溶液的烧杯中,充分反应后过滤,再向滤液中加入20%的氢氧化钠溶液,产生沉淀的质量与所加入的氢氧化钠溶液质量的关系如图所示.试求: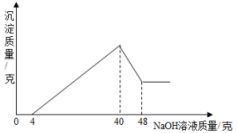 (1)、硫酸溶液的溶质质量分数为多少?(2)、铝土矿中含Al2O3、Fe2O3、SiO2各多少?
(1)、硫酸溶液的溶质质量分数为多少?(2)、铝土矿中含Al2O3、Fe2O3、SiO2各多少?(提示:Al(OH)3+NaOH=NaAlO2+2H2O,NaAlO2易溶于水)
24. 请根据下图A、B、C三种固体物质的溶解度曲线,回答下列问题: (1)、在℃时,A、C两种物质的溶解度相等。(2)、若A物质中混有少量B物质,最好采用的方法提纯。(填“降温结晶”或“蒸发结晶”)。(3)、 在t2℃时向盛有50gA物质的烧杯中加入50g水,充分溶解后,所得溶液的溶质质量分数。
(1)、在℃时,A、C两种物质的溶解度相等。(2)、若A物质中混有少量B物质,最好采用的方法提纯。(填“降温结晶”或“蒸发结晶”)。(3)、 在t2℃时向盛有50gA物质的烧杯中加入50g水,充分溶解后,所得溶液的溶质质量分数。