北京市首师附高2023-2024学年高一上学期期末考试化学试题
试卷更新日期:2024-03-12 类型:期末考试
一、选择题(本大题共20小题,每小题2分,共40分。在每小题所列出的四个选项中,只有一项是最符合题目要求的)
-
1. 下列技术应用中,其工作原理不涉及化学反应的是( )




A.火药使用
B.用和合成
C.转轮排字
D.用氧化铁冶炼铁
A、A B、B C、C D、D2. 氧化还原反应的实质是( )A、化合价的升降 B、分子中各原子重新组合 C、电子的得失或偏移 D、氧原子的得失3. 下列微粒所含有的质子和电子总数都约为的是( )A、 B、 C、 D、NO4. 下列反应中,调节反应条件(温度、反应物用量比)后反应产物不会改变的是( )A、钠与氧气 B、铁与氯气 C、镁粉和氯化铁 D、二氧化碳与氢氧化钠溶液5. 下列有关铁的说法中正确的是( )A、铁与硫粉反应的产物是 B、铁和稀硫酸反应的离子方程式为 C、铁在纯氧中燃烧生成 D、常温下,Fe与浓硫酸不发生化学反应6. 下列离子方程式正确的是( )A、澄清石灰水中通入过量: B、氧化: C、将通入溶液中: D、氢氧化钡溶液与稀硫酸反应:7. 下列各物质含少量杂质,除去这些杂质应选用的试剂或操作方法正确的是( )序号
物质
杂质
除杂应选用的试剂或操作方法
①
KNO3溶液
KOH
加入FeCl3溶液,并过滤
②
FeSO4溶液
CuSO4
加入过量铁粉,并过滤
③
H2
CO2
通过盛NaOH溶液的洗气瓶,
再通过盛有浓硫酸的洗气瓶
④
NaNO3固体
CaCO3
溶解、过滤、蒸发
A、①②③④ B、①③④ C、①②③ D、②③④8. 下列实验仪器或药品配置合理,并且能达到相对应选项中实验目的是( )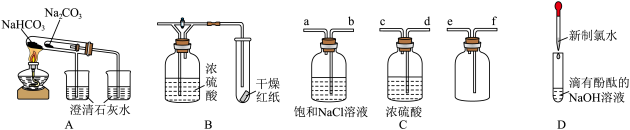 A、验证热稳定性 B、验证潮湿氯气与干燥氯气的漂白性 C、净化并收集干燥氯气的装置连接顺序为dcbafe D、滴有酚酞的溶液红色褪去,证明氯水中有酸9. 在一定条件下采用如下装置用铁粉和水蒸气反应,可以得到铁的氧化物,进一步还原可以得到超细铁粉(加热和夹持装置已略去)。装置如图,下列说法正确的是( )
A、验证热稳定性 B、验证潮湿氯气与干燥氯气的漂白性 C、净化并收集干燥氯气的装置连接顺序为dcbafe D、滴有酚酞的溶液红色褪去,证明氯水中有酸9. 在一定条件下采用如下装置用铁粉和水蒸气反应,可以得到铁的氧化物,进一步还原可以得到超细铁粉(加热和夹持装置已略去)。装置如图,下列说法正确的是( )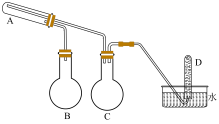 A、装置C的作用是提供水蒸气 B、装置A中发生反应: C、收集到气体时(标况下),则A中固体增重 D、可以用磁铁检验该反应是否完全10. 关于下列物质说法正确的是( )
A、装置C的作用是提供水蒸气 B、装置A中发生反应: C、收集到气体时(标况下),则A中固体增重 D、可以用磁铁检验该反应是否完全10. 关于下列物质说法正确的是( )①氨水;②熔融;③固体;④固体;⑤铜;⑥蔗糖
A、能导电的有①②③④⑤ B、不能导电的有③④⑥ C、属于电解质的有①②③④ D、属于非电解质的有⑤⑥11. 下列说法不正确的是( )A、等质量的CO和原子数之比为 B、常温常压下,物质的量为 C、同温同压下,和的密度之比为 D、的溶液中含氧原子的个数约为12. 下列有关钠的化合物说法不正确的是( )A、完全与反应生成产物,失去电子数约为 B、将澄清石灰水分别加入溶液和溶液中,前者不生成沉淀 C、与水的反应中,每生成氧气转移电子 D、固体中含少量 , 可用加热法除去13. 以Fe粉、稀硫酸、溶液为原料,用如图所示装置制备能较长时间保存的 , 下列说法正确的是( )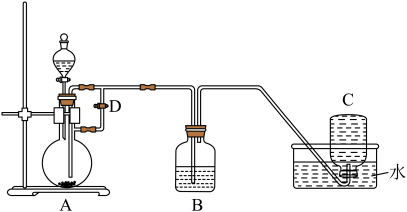 A、反应前圆底烧瓶中放入铁粉,分液漏斗中装入溶液 B、生成在装置A中 C、实验开始前,应先关闭止水夹D D、若铁粉中含有少量 , 不影响本实验14. 中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是( )A、In是第五周期第ⅢA族元素 B、11549In的中子数与电子数的差值为17 C、原子半径:In>Al D、碱性:In(OH)3>RbOH15. 短周期中8种元素a~h,其原子半径、最高正化合价或最低负化合价随原子序数递增的变化如图所示。下列判断不正确的是( )
A、反应前圆底烧瓶中放入铁粉,分液漏斗中装入溶液 B、生成在装置A中 C、实验开始前,应先关闭止水夹D D、若铁粉中含有少量 , 不影响本实验14. 中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是( )A、In是第五周期第ⅢA族元素 B、11549In的中子数与电子数的差值为17 C、原子半径:In>Al D、碱性:In(OH)3>RbOH15. 短周期中8种元素a~h,其原子半径、最高正化合价或最低负化合价随原子序数递增的变化如图所示。下列判断不正确的是( )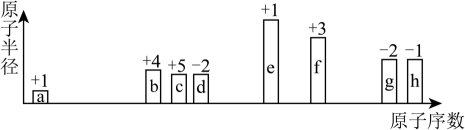 A、d、f组成的化合物能溶于强碱溶液 B、e的阳离子与g的阴离子具有相同的电子层结构 C、a可分别与b或c组成含10个电子的分子 D、最高价氧化物对应水化物的酸性:h>g>b16. 向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,在所得溶液中经检验无Fe3+。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )A、11.2g B、5.6g C、2.8g D、无法计算17. 铁是人体必需的微量元素,下面是一种常见补铁药品说明书中的部分内容:该药品含33%~36%,不溶于水但能溶于人体中的胃酸:与维生素C(Vc)同服可增加本品吸收。某同学设计了以下实验检测该补铁药品中是否含有并探究Vc的作用:
A、d、f组成的化合物能溶于强碱溶液 B、e的阳离子与g的阴离子具有相同的电子层结构 C、a可分别与b或c组成含10个电子的分子 D、最高价氧化物对应水化物的酸性:h>g>b16. 向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,在所得溶液中经检验无Fe3+。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )A、11.2g B、5.6g C、2.8g D、无法计算17. 铁是人体必需的微量元素,下面是一种常见补铁药品说明书中的部分内容:该药品含33%~36%,不溶于水但能溶于人体中的胃酸:与维生素C(Vc)同服可增加本品吸收。某同学设计了以下实验检测该补铁药品中是否含有并探究Vc的作用:
以下说法不正确的是( )
A、试剂1为溶液,目的是溶解药片 B、加入溶液后溶液变为淡红色,说明溶液中有少量 C、加入Vc后红色溶液颜色褪去,说明Vc具有一定的氧化性 D、新制氯水可替换为双氧水进行实验18. 将一定量的铁粉投入硫酸铜和硫酸铁混合溶液中充分反应,下列说法正确的是( )A、反应后若无固体剩余,则溶液中一定含有 B、反应后若无固体剩余,则溶液中一定含有 C、反应后若有固体,则固体一定为Fe和Cu的混合物 D、反应后若有固体,则溶液中的金属离子只有19. 高效净水剂高铁酸钾制备流程如图所示,下列离子方程式正确的是( )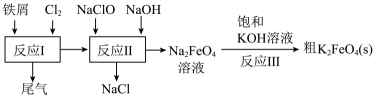 A、净水原理:(胶体) B、用溶液吸收尾气 C、反应Ⅱ: D、反应Ⅲ:20. 下列选项描述与对应图像相符的是( )
A、净水原理:(胶体) B、用溶液吸收尾气 C、反应Ⅱ: D、反应Ⅲ:20. 下列选项描述与对应图像相符的是( )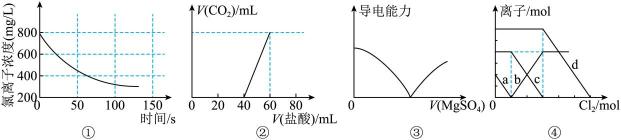 A、图①为新制氯水在阳光直射时,溶液中Cl-浓度随着时间变化的图像 B、图②为Na2CO3、NaHCO3混合液中滴加盐酸产生CO2的图像 C、图③为向Ba(OH)2溶液中滴加MgSO4溶液的导电性变化图像 D、图④为FeBr2、FeI2混合液中各离子物质的量随氯气通入的变化图像,曲线b代表的是Cl-(已知还原性:I->Fe2+>Br-)
A、图①为新制氯水在阳光直射时,溶液中Cl-浓度随着时间变化的图像 B、图②为Na2CO3、NaHCO3混合液中滴加盐酸产生CO2的图像 C、图③为向Ba(OH)2溶液中滴加MgSO4溶液的导电性变化图像 D、图④为FeBr2、FeI2混合液中各离子物质的量随氯气通入的变化图像,曲线b代表的是Cl-(已知还原性:I->Fe2+>Br-)二、填空题(本大题共5小题,共60分)
-
21. 电子工业中,人们常用溶液蚀刻印刷电路板,并进一步从腐蚀液中回收Cu和溶液。实验室模拟流程如图所示:
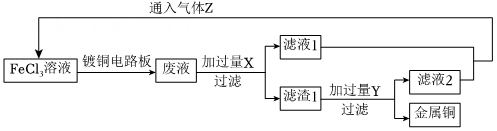
请回答下列问题:
(1)、写出溶液蚀刻镀铜电路板的离子方程式。(2)、写出加入过量X的离子方程式 , 。(3)、若取滤液1加入试管中,然后滴加足量氢氧化钠溶液,产生的现象是;在实际工业流程中,可替代气体Z的试剂为(填字母)。A.酸性溶液 B.氯水 C.溴水 D.硝酸溶液 E.过氧化氢溶液
22. 要配制的溶液,配制过程中有如下操作步骤:①把称量好的绿矾放入小烧杯中,加适量蒸馏水溶解;
②待溶液恢复到室温;
③把①所得溶液小心转入____中;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都小心转入容量瓶,并轻轻摇匀;
⑤继续向容量瓶中加蒸馏水至液面距离刻度1~2cm处,改用____滴加蒸馏水至液面与刻度线相切;
⑥将容量瓶塞紧,反复上下颠倒,摇匀。
请填写下列空白:
(1)、补全相应实验操作中所缺的仪器名称:③ , ⑤。(2)、实验室用绿矾来配制该溶液,用托盘天平称量绿矾g。(3)、实验室保存该溶液为了防止被氧化,一般在溶液底部加入少量(填试剂名称)。(4)、若实验测得该溶液的质量分数为 , 则该溶液的密度为(填表达式)。(5)、由于错误操作,使得实际浓度比所要求的浓度偏小的是____(填写编号)。A、称量的固体中混有少量无水 B、使用容量瓶配制溶液时,俯视液面定容 C、没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中 D、容量瓶底部残留少量蒸馏水,没有干燥完全 E、定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切23. 下图是元素周期表的一部分,参照元素①~⑤在表中的位置,回答问题:族
周期
ⅠA
0
1
ⅡA
~
ⅢA
Ⅳ
ⅤA
ⅥA
ⅦA
2
①
3
②
③
④
⑤
(1)、①的原子结构示意图是。(2)、②、③、④、⑤四种元素中,简单离子半径最小的是(写离子符号)。②、③、④三种元素的单质与酸反应的剧烈程度的次序为>>(填元素符号),从原子结构的角度解释原因。
(3)、②和④各自的最高价氧化物的水化物发生反应的离子方程式为。⑤的单质与②的最高价氧化物的水化物发生反应的离子方程式为。(4)、下列事实能判断②和③的金属性强弱的是(填字母,下同)。a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.单质作为还原剂的时候,失去电子个数
(5)、硒(Se)位于第四周期,与①同主族。下列推断正确的是。a.只具有还原性
b.Se的最低负化合价是价
c.Se的气态氢化物的稳定性比①的强
(6)、室温下向固体表面吹 , 得到两种单质和 , 该反应的方程式为。24. 我国是世界上最早冶炼锌的国家之一,有独立的炼锌发展史。现代炼锌主要采取湿法工艺,以闪锌矿(主要成分为 , 还含铁等元素)、软锰矿(主要成分为)为原料联合生产锌和高纯度二氧化锰的一种流程如下: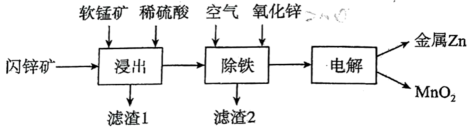 (1)、浸出:加入能促进的溶解,提高锌的浸出率,同时生成硫单质。的作用类似催化剂,“催化”过程可表示为:
(1)、浸出:加入能促进的溶解,提高锌的浸出率,同时生成硫单质。的作用类似催化剂,“催化”过程可表示为:ⅰ:
ⅱ:……
①写出ⅱ的离子方程式:。
②下列实验方案可证实上述“催化”过程。将实验方案补充完整。
a.向酸化的溶液中加入溶液,溶液几乎无色,再加入少量 , 溶液变红。
b.。
(2)、除铁:已知①进入除铁工艺的溶液的pH约为3;②控制溶液pH为2.5~3.5,使铁主要以沉淀的形式除去。结合离子方程式说明,通入空气需同时补充适量的理由是。(3)、电解:总反应(未配平):。若不考虑副反应,为了使溶液中的、均恰好完全反应,理论上需要再添加哪种离子?(填“”、“”或“都不需要”)。25. 某实验小组为了探究“氧化剂对检验的影响”,进行实验1:实验1
试剂
现象
试管
滴管(各1滴)

溶液与1滴溶液
a.饱和氯水
溶液立即变为浅红色
b.稀硝酸
溶液立即变为红色
c.5%溶液
溶液立即变为深红色,无气体产生
(1)、向溶液中滴加1滴溶液,无明显现象,通入 , 无明显变化。①该实验的目的是。
②用离子方程式表示a中出现浅红色的原因:、。
(2)、对a中溶液呈浅红色的原因,甲同学提出以下假设。假设1:氯水加入量少,氧化生成的浓度低。
设计实验ⅰ排除了假设1:取a中浅红色溶液,操作a , 观察到溶液浅红色消失
假设2:氯水氧化性强,氧化了部分。
(已知:与可在溶液中大量共存;易被氧化为)
进行实验ⅱ证明假设2成立:向水中滴加1滴溶液,滴加1滴饱和氯水,操作b,产生白色沉淀,证明溶液里含有。
①操作a为。操作b是。
②补全ⅱ中被氧化的离子方程式:
=
(3)、乙同学针对上述实验1的现象做了进一步思考并设计了实验2,分别取上述溶液于试管中,向其中滴加一定浓度的溶液至溶液红色褪去,同时生成白色沉淀(其成分仅为)。记录消耗溶液的体积,实验记录如表:实验2
试管
消耗溶液的体积(mL)
d.水与1滴溶液和1滴溶液
2.40
e.实验a中溶液
1.52
f.实验b中溶液
1.60
g.实验c中溶液
1.84
则由d~g可以得出的结论是(答出2点)。