内蒙古赤峰市2023-2024学年高二上学期1月期末联考化学试题
试卷更新日期:2024-03-12 类型:期末考试
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 能量以各种不同的形式呈现在人们面前,我们通过化学反应等方式可以实现不同形式的能量间的转化。下列说法错误的是( )A、风能属于可再生能源 B、光伏发电系统能将电能直接转化为太阳能 C、物质燃烧的过程中化学能转化为热能 D、原电池放电的过程实现了化学能转化为电能2. 用草酸标准液滴定酸化后的溶液的方法可测定的质量分数,该过程中不需要使用到的是( )
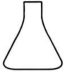



A
B
C
D
A、A B、B C、C D、D3. 25℃时,某溶液中由水电离产生的和的乘积为 , 则该溶液的溶质可能为( )A、 B、 C、 D、NaCl4. 下列事实中没有涉及化学平衡知识的是( )A、将铁制品放在干燥处保存 B、使用含氟牙膏能预防龋齿 C、工业上在10MPa~30MPa条件下合成氨 D、使用热的纯碱溶液除油污5. 下列原子的轨道表示式违背了洪特规则的是( )A、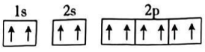 B、
B、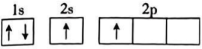 C、
C、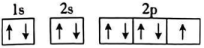 D、
D、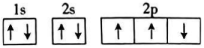 6. 下列关于电化学的说法错误的是( )A、原电池中负极材料一定要参与反应 B、可通过电解熔融的办法获得Ba单质 C、组成的原电池中Al作负极 D、电解水时可在水中加入少量NaOH以增强溶液导电性7. 甲醇是重要的化工原料,应用前景广阔。研究表明,二氧化碳与氢气反应可以合成甲醇,反应为 , 下列有利于提高平衡时转化率的措施有( )A、加入合适的催化剂 B、保持容器容积不变,再通入 C、增大与的初始投料比 D、保持容器容积不变,再通入8. 已知有关数值均正确,下列化学用语正确的是( )A、碳酸氢根离子的水解方程式为 B、甲烷燃烧的热化学方程式为 C、醋酸与NaOH反应的热化学方程式为 D、的电离方程式为9. 现有常温下的甲、乙两种溶液:甲为溶液,乙为溶液。下列说法错误的是( )A、的电离程度:甲=乙 B、均加水稀释到100mL后,pH的变化量:甲=乙 C、均升温到40℃后,甲、乙的pH都变大 D、将甲、乙混合充分反应后,混合溶液呈中性10. 利用下列装置进行的实验,不能达到预期目的的是( )
6. 下列关于电化学的说法错误的是( )A、原电池中负极材料一定要参与反应 B、可通过电解熔融的办法获得Ba单质 C、组成的原电池中Al作负极 D、电解水时可在水中加入少量NaOH以增强溶液导电性7. 甲醇是重要的化工原料,应用前景广阔。研究表明,二氧化碳与氢气反应可以合成甲醇,反应为 , 下列有利于提高平衡时转化率的措施有( )A、加入合适的催化剂 B、保持容器容积不变,再通入 C、增大与的初始投料比 D、保持容器容积不变,再通入8. 已知有关数值均正确,下列化学用语正确的是( )A、碳酸氢根离子的水解方程式为 B、甲烷燃烧的热化学方程式为 C、醋酸与NaOH反应的热化学方程式为 D、的电离方程式为9. 现有常温下的甲、乙两种溶液:甲为溶液,乙为溶液。下列说法错误的是( )A、的电离程度:甲=乙 B、均加水稀释到100mL后,pH的变化量:甲=乙 C、均升温到40℃后,甲、乙的pH都变大 D、将甲、乙混合充分反应后,混合溶液呈中性10. 利用下列装置进行的实验,不能达到预期目的的是( )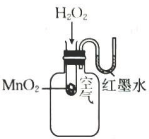

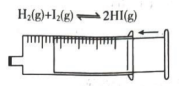
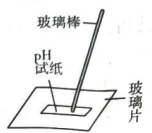
A.探究双氧水分解的热效应
B.制作水果(柠檬)电池
C.探究压强对平衡移动的影响
D.粗测碳酸钠溶液的
A、A B、B C、C D、D11. 设为阿伏加德罗常数的值。下列说法正确的是( )A、常温下,纯水中含有的离子数目约为 B、的稀硫酸中含有的数目为 C、溶液中含有的阳离子数小于 D、硫化钠溶液中含有的的数目小于12. 化工原料异丁烯()可由异丁烷()直接催化脱氢制得,反应方程式为。一定条件下,温度、压强对异丁烷平衡转化率的影响如图所示(假设起始时异丁烯的物质的量为且),下列说法正确的是( )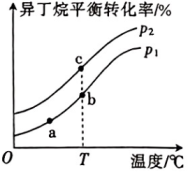 A、压强: B、反应速率: C、平衡常数: D、异丁烯()的质量分数:13. 电解液来源丰富、成本低廉的新型酸碱混合锌铁液流电池的示意图如图,下列说法错误的是( )
A、压强: B、反应速率: C、平衡常数: D、异丁烯()的质量分数:13. 电解液来源丰富、成本低廉的新型酸碱混合锌铁液流电池的示意图如图,下列说法错误的是( )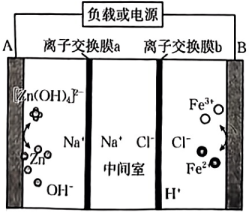 A、放电时,电流由B经导线流向A B、放电时,负极反应式为 C、离子交换膜a为阳离子交换膜 D、充电时,每转移2mol电子,参与反应的铁元素质量为56g14. 氯化银(AgCl,白色)、铬酸银( , 砖红色)都是难溶电解质。T℃下,将溶液分别逐滴滴入体积均为10mL、浓度均为的NaCl溶液和溶液中,所得的沉淀溶解平衡图像如图所示(X为或)。下列叙述正确的是( )
A、放电时,电流由B经导线流向A B、放电时,负极反应式为 C、离子交换膜a为阳离子交换膜 D、充电时,每转移2mol电子,参与反应的铁元素质量为56g14. 氯化银(AgCl,白色)、铬酸银( , 砖红色)都是难溶电解质。T℃下,将溶液分别逐滴滴入体积均为10mL、浓度均为的NaCl溶液和溶液中,所得的沉淀溶解平衡图像如图所示(X为或)。下列叙述正确的是( )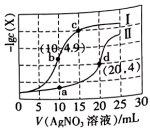 A、T℃下, B、曲线Ⅱ表示与V(溶液)的变化关系 C、向a点对应的体系中加入少量NaCl固体,白色固体逐渐变为砖红色 D、浓度均为的和 , 可通过分步沉淀进行分离
A、T℃下, B、曲线Ⅱ表示与V(溶液)的变化关系 C、向a点对应的体系中加入少量NaCl固体,白色固体逐渐变为砖红色 D、浓度均为的和 , 可通过分步沉淀进行分离二、非选择题:本题共4小题,共58分。
-
15. 在日常生活中,金属腐蚀的现象普遍存在,金属腐蚀常常是自发进行的。回答下列问题:(1)、钢铁腐蚀分为析氢腐蚀和吸氧腐蚀:
①在酸性环境中,主要发生的腐蚀称为(填“析氢”或“吸氧”)腐蚀,此时正极上的电极反应式为。
②发生吸氧腐蚀时,每转移0.2mol电子,消耗气体的体积为mL(标准状况下)。
(2)、钢铁的保护法如图所示:
图1 图2
①图1为(填“牺牲阳极法”或“外加电流法”),此时锌板上发生的电极反应为。
②图2中,a为电源的(填“正”或“负”)极,判断的理由为。
16. a、b、c、d、e均为短周期主族元素,其中a与c的原子序数之和等于e的原子序数,上述五种元素的最外层电子数与原子半径的大小关系如图所示。请按要求回答下列问题: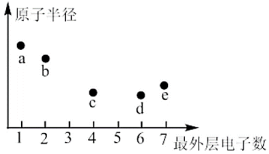 (1)、五种元素中,金属性最强的元素是(填元素符号),这些元素形成的酸性最强的最高价含氧酸和碱性最强的碱形成的盐是(填化学式)。(2)、c、d、e三种元素可形成一种有毒气体 , 该气体分子的结构式为。(3)、上述五种元素的基态原子中,未成对电子数为2的元素有(填元素符号)。(4)、基态b原子中有种不同能量的电子;其基态的核外电子占据的最高能级的电子云轮廓图呈形,该能级的轨道有个伸展方向。(5)、a元素的第二电离能(填“大于”或“小于”)b元素的第二电离能,原因是。17. 回收废旧电池,既可以减轻重金属对环境的污染,又可以变废为宝。对废弃的锂电池正极材料进行氯化处理以回收Li、Co等金属的工艺路线如图:
(1)、五种元素中,金属性最强的元素是(填元素符号),这些元素形成的酸性最强的最高价含氧酸和碱性最强的碱形成的盐是(填化学式)。(2)、c、d、e三种元素可形成一种有毒气体 , 该气体分子的结构式为。(3)、上述五种元素的基态原子中,未成对电子数为2的元素有(填元素符号)。(4)、基态b原子中有种不同能量的电子;其基态的核外电子占据的最高能级的电子云轮廓图呈形,该能级的轨道有个伸展方向。(5)、a元素的第二电离能(填“大于”或“小于”)b元素的第二电离能,原因是。17. 回收废旧电池,既可以减轻重金属对环境的污染,又可以变废为宝。对废弃的锂电池正极材料进行氯化处理以回收Li、Co等金属的工艺路线如图: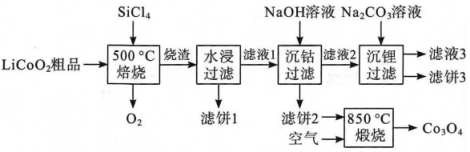
已知:常温下,的电离常数 , 的电离常数、 , , 。
回答下列问题:
(1)、写出一条提高焙烧效率的措施:。(2)、若烧渣是LiCl、和的混合物;写出焙烧时发生反应的化学方程式:。(3)、简述洗涤滤饼3的操作:。(4)、现有pH相同的以下三种溶液。a.NaOH溶液 b.溶液 c.氨水
①(填“>”“<”或“=”)1。
②三种溶液中由水电离出的的浓度的关系是(用a、b、c表示)。
(5)、完全沉淀时(溶液中离子浓度小于时可认为沉淀完全),溶液的pH最小值约为。(6)、煅烧滤饼2时发生反应的化学方程式为 , 得到的的组成类似于 , 则中与的个数比为。18. 将还原转化为有用的化学产品是目前研究的热点之一。回答下列问题:Ⅰ.用铜铝催化剂可将加氢合成甲醇,已知过程中发生的反应如下:
ⅰ.
ⅱ.
ⅲ.
(1)、(用含、的代数式表示),(用含、的代数式表示)。(2)、查阅资料可知, , 则(填“低温"“高温”或“任意温度”)条件下有利于反应ⅲ自发进行。(3)、Ⅱ.和以1:3的物质的量之比通入某密闭容器中,仅发生反应 , 的平衡转化率与温度、气体的总压强的关系如图所示: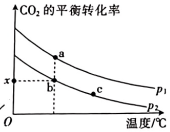
反应速率:(填“>”“<”或“=”)。
(4)、平衡常数:(填“>”“<”或“=”)。(5)、压强:(填“>”“<”或“=”)。(6)、b点时,该反应的平衡常数(分压=总压×物质的量分数,用含x、的代数式表示)。(7)、Ⅲ.常温下,和都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
若生成乙烯和乙烷的体积比为6:5,则消耗的和的体积比为。