内蒙古自治区乌兰察布市2023-2024学年高一上学期1月期末考试化学试题
试卷更新日期:2024-03-12 类型:期末考试
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 医院里医生给“病人”做心电图时,在仪器与皮肤接触部位擦的一种电解质溶液是( )A、氯化钠溶液 B、医用酒精 C、葡萄糖溶液 D、碘酒2. 小明在观看电影时注意到头顶上有不断变幻的光柱。这些光柱产生的主要原因是( )A、空气对流 B、分子扩散 C、丁达尔效应 D、幕布反光3. 分类是认识和研究物质的一种常用的科学方法。下列物质或变化所属类别错误的是( )
选项
物质
所属类别
A
NaCl、、
离子化合物
B
金刚石、石墨、
同素异形体
C
云、雾、有色玻璃
胶体
D
钢铁腐蚀、食物腐败、钟乳石形成
氧化还原反应
A、A B、B C、C D、D4. 符号表征能帮助我们从微观层面认识物质及变化,下列表示微粒的化学用语正确的是( )A、的结构式: B、烧碱的化学式: C、水的电子式: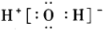 D、在水溶液中的电离方程式:
5. 2023年10月,中国地质科学家在内蒙古白云鄂博矿床,发现了一种新的铌硅酸盐矿物,被命名为现包头矿。铌(Nb)是一种稀有金属元素,在核能、超导、航空航天通信等领域中发挥关键作用。下列关于和的说法中,正确的是( )A、和互为同位素 B、和都含有相同的中子数 C、和含有不同的核外电子数 D、和属于主族元素6. 2024年2月第十四届全国冬季运动会将在内蒙古举行,滑雪是冬运会的重点比赛项目。其中滑雪杖是由质轻高硬度的镁铝合金制成。下列有关镁铝合金的说法中正确的是( )A、该合金熔点比纯铝熔点高 B、该合金硬度比纯铝大 C、该合金适宜在酸碱中浸泡 D、该合金的密度比纯铝的高7. “遥遥领先”的华为芯片制造过程用了蚀刻技术。利用进行硅芯片蚀刻时的产物均为气体,在蚀刻物表面不留任何残留物。该反应微观示意图如下,下列说法正确的是( )
D、在水溶液中的电离方程式:
5. 2023年10月,中国地质科学家在内蒙古白云鄂博矿床,发现了一种新的铌硅酸盐矿物,被命名为现包头矿。铌(Nb)是一种稀有金属元素,在核能、超导、航空航天通信等领域中发挥关键作用。下列关于和的说法中,正确的是( )A、和互为同位素 B、和都含有相同的中子数 C、和含有不同的核外电子数 D、和属于主族元素6. 2024年2月第十四届全国冬季运动会将在内蒙古举行,滑雪是冬运会的重点比赛项目。其中滑雪杖是由质轻高硬度的镁铝合金制成。下列有关镁铝合金的说法中正确的是( )A、该合金熔点比纯铝熔点高 B、该合金硬度比纯铝大 C、该合金适宜在酸碱中浸泡 D、该合金的密度比纯铝的高7. “遥遥领先”的华为芯片制造过程用了蚀刻技术。利用进行硅芯片蚀刻时的产物均为气体,在蚀刻物表面不留任何残留物。该反应微观示意图如下,下列说法正确的是( )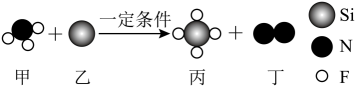 A、甲分子中的共价键为非极性键 B、丙的摩尔质量为104g C、反应前后各元素的价态不变 D、上述反应类型是置换反应8. 准确书写离子方程式有助于我们认识化学反应的实质。下列离子方程式的书写正确的是( )A、铜片插入稀盐酸中: B、氧化铁与稀盐酸混合: C、实验室用大理石和稀盐酸制取: D、硫酸铜溶液与氢氧化钡溶液混合:9. 下列关于溶液的描述中正确的是( )A、该溶液中含有 B、该溶液中 C、该溶液就是溶于1L水中所得的溶液 D、取100mL该溶液加水稀释到500mL,稀释后浓度为10. 关于下列仪器使用的说法错误的是( )
A、甲分子中的共价键为非极性键 B、丙的摩尔质量为104g C、反应前后各元素的价态不变 D、上述反应类型是置换反应8. 准确书写离子方程式有助于我们认识化学反应的实质。下列离子方程式的书写正确的是( )A、铜片插入稀盐酸中: B、氧化铁与稀盐酸混合: C、实验室用大理石和稀盐酸制取: D、硫酸铜溶液与氢氧化钡溶液混合:9. 下列关于溶液的描述中正确的是( )A、该溶液中含有 B、该溶液中 C、该溶液就是溶于1L水中所得的溶液 D、取100mL该溶液加水稀释到500mL,稀释后浓度为10. 关于下列仪器使用的说法错误的是( ) A、①③使用前需要检漏 B、③④应在室温下使用 C、②③④均可用作反应容器 D、②③④可用于配制的NaCl溶液11. 下列物质在一定条件下均能产生氧气,从适合呼吸供氧和减轻负重角度考虑,航天员的舱外航天服中的供氧剂是( )A、 B、 C、 D、12. 根据下列实验操作及现象所得出的相应结论正确的是( )
A、①③使用前需要检漏 B、③④应在室温下使用 C、②③④均可用作反应容器 D、②③④可用于配制的NaCl溶液11. 下列物质在一定条件下均能产生氧气,从适合呼吸供氧和减轻负重角度考虑,航天员的舱外航天服中的供氧剂是( )A、 B、 C、 D、12. 根据下列实验操作及现象所得出的相应结论正确的是( )选项
实验操作
现象
结论
A
向试管中某溶液加入稀盐酸
产生使澄清石灰水变浑浊的无色无味气体
该溶液为小苏打溶液
B
用洁净铂丝蘸取某溶液在火焰上灼烧
火焰呈黄色
该溶液中有 , 无
C
向某溶液中先加KSCN溶液,再滴氯水
先无明显现象后溶液变红
该溶液中一定含有
D
向NaBr溶液中滴加过量氯水,再加入淀粉KI溶液
溶液先变橙色,后变蓝色
氧化性:
A、A B、B C、C D、D13. 根据元素周期律的变化规律,下列比较中,正确的是( )A、非金属性:N>O>F B、还原性:Al>Mg>Na C、碱性强弱:NaOH>Mg(OH)2>Al(OH)3 D、气态氢化物的稳定性:HBr>HCl>HF14. 下列示意图与表述内容相符合的是( )选项
示意图
表述内容
A
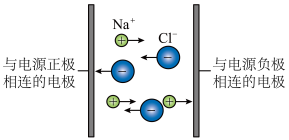
NaCl溶液能够导电
B
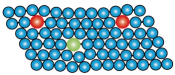
合金内原子层之间的相对滑动变得困难
C
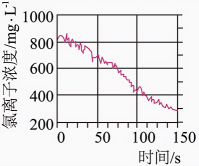
光照过程中氯水的氯离子浓度
D
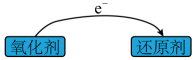
还原剂和氧化剂的关系
A、A B、B C、C D、D15. 某学生学习了检验食品中的铁元素后,设想在课外研究测定某补血剂中铁元素(+2价)含量,其设计实验流程如下: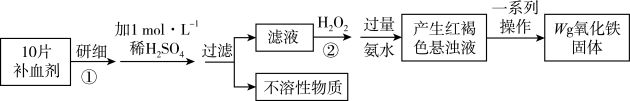
下列说法错误的是( )
A、步骤②可以用新制氯水替代 B、步骤②加入氨水的作用是将完全沉淀 C、每片补血剂中含铁元素的质量为0.07Wg D、取步骤①操作后的溶液,滴加几滴KSCN溶液,若溶液变红,证明补血剂已完全被氧化变质二、填空题(4道大题,总计55分)
-
16. 元素周期表揭示了化学元素间的内在联系,对化学学习和研究有很重要的作用。下表列出了①~⑧八种元素在周期表中的位置:
族
周期
IA
0
1
①
IIA
IIIA
IVA
VA
VIA
VIIA
2
②
③
3
④
⑤
⑥
⑦
⑧
请按要求回答下列问题:
(1)、画出⑧的原子结构示意图。(2)、由③、④、⑦四种元素形成的简单离子半径由大到小的顺序是(用离子符号表示)。(3)、由元素①和②形成的最简单化合物甲的电子式为 , 由元素③和⑥形成化合物乙,则乙与NaOH溶液发生反应的化学方程式为。(4)、硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在元素周期表中的位置如图所示:
i.在元素周期表中位置表示为。
ii.关于硒的下列说法中正确的是。
A.既有氧化性又有还原性 B.原子半径由大到小顺序:
C.热稳定性: D.酸性:
17. 某工厂的工业废水中含有大量的、较多量的和 , 为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀、NaOH溶液) (1)、若废水是由、和组成的混合溶液,其中 , , , (溶液中和浓度忽略不计),则为。(2)、试剂①是。(3)、固体E的成分是(填化学式),操作c名称为。(4)、若取2mL溶液D加入试管中,然后向其中滴加氢氧化钠溶液,可观察到的现象是 , 此过程中涉及氧化还原反应的化学方程式是。(5)、回收的经一系列变化后可制得一种新型绿色净水剂高铁酸钠 , 主要用于饮用水处理。其中一种制备原理如下,请配平该反应的离子方程式:
(1)、若废水是由、和组成的混合溶液,其中 , , , (溶液中和浓度忽略不计),则为。(2)、试剂①是。(3)、固体E的成分是(填化学式),操作c名称为。(4)、若取2mL溶液D加入试管中,然后向其中滴加氢氧化钠溶液,可观察到的现象是 , 此过程中涉及氧化还原反应的化学方程式是。(5)、回收的经一系列变化后可制得一种新型绿色净水剂高铁酸钠 , 主要用于饮用水处理。其中一种制备原理如下,请配平该反应的离子方程式:,
当有生成时,转移电子的数目约为个。
18. 化学与人类生活密切相关,现有以下物质:①漂白粉 ②冰醋酸(纯醋酸) ③葡萄糖 ④胆矾 ⑤干冰 ⑥Cu。请回答下列问题:(1)、以上物质中属于电解质的是(填序号)。(2)、医学上葡萄糖溶液可作为药物的溶媒,同时能给病人补充体液和能量。如图是输液用的葡萄糖(相对分子质量为180)注射液的标签。
葡萄糖注射液
规格:500mL
密度:1.08g/mL
质量分数:5%
生产批号:10032032
①该注射液中葡萄糖的物质的量浓度为。
②实验室需要480mL该浓度的葡萄糖溶液,配制该浓度的溶液需要用普通电子天平称量g葡萄糖固体。
③配制该溶液需要用到的玻璃仪器除了烧杯和玻璃棒外,还缺少、。
(3)、下列操作会使所配制的溶液物质的量浓度偏低的是____(填序号)。A、配制溶液所用的容量瓶洗涤后没有干燥 B、转移溶液后,没有洗涤烧杯和玻璃棒 C、定容时俯视刻度线 D、定容时加水超过刻度线,把溶液倒出一些,重新加水至刻度线(4)、人体血糖(血液中的葡萄糖)正常值为3.9~6.1mmol/L。某人体检报告血糖值检测结果为0.92g/L,则他(她)的血糖值(填“偏高”“正常”或“偏低”)。19. 如图是实验室制备氯气并进行相关性质检验的装置,实验装置如图: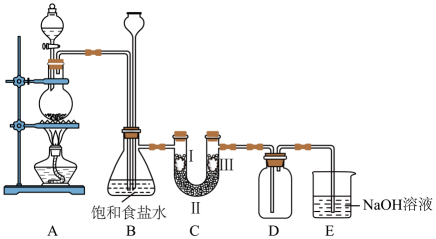
回答下列问题:
(1)、①装置A中是用和浓盐酸反应制备 , 其化学方程式为。②B中加入饱和食盐水的目的。
(2)、装置B有安全瓶作用,监测实验进行时C中是否发生堵塞,请写出C发生堵塞时B中的现象。(3)、设置装置C的实验目的是验证氯气是否具有漂白性,为此C中的Ⅰ、Ⅱ、Ⅲ依次应放入(从下表a、b、c、d中选择)。选项
a
b
c
d
Ⅰ
干燥的有色布条
干燥的有色布条
湿润的有色布条
湿润的有色布条
Ⅱ
碱石灰
无水氯化钙
碱石灰
无水氯化钙
Ⅲ
湿润的有色布条
湿润的有色布条
干燥的有色布条
干燥的有色布条
(4)、装置E的作用是 , 发生的离子方程式是。(5)、某同学设计实验探究“84”消毒液(主要成分NaClO)的漂白性。Ⅰ.在2mL“84”消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.在2mL“84”消毒液中加入2mL醋酸后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.在不同温度时,测得“84”消毒液ORP值随时间的变化曲线如图所示。

已知:ORP表示水溶液中物质的氧化性或还原性强弱,ORP值越大,氧化性越强。
①实验Ⅰ、Ⅱ现象不同的原因是。
②实验Ⅲ中,随时间的变化ORP值不同的原因可能是。