江苏省扬州市2023-2024学年高一上学期1月期末考试化学试题
试卷更新日期:2024-03-12 类型:期末考试
一、单项选择题:共14题,每题3分,共计42分。每题只有一个选项符合题意。
-
1. 我国提出了将在2030年前实现“碳达峰”,2060年前实现“碳中和”的目标,彰显大国的责任与担当。“碳达峰”“碳中和”中的“碳”指的是( )A、二氧化碳 B、碳元素 C、碳单质 D、含碳物质2. 下列物质属于电解质的是( )A、氯化钠 B、蔗糖 C、 D、3. 氯碱工业的原理为: , 下列说法正确的是( )A、的结构示意图:
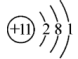 B、的空间填充模型:
B、的空间填充模型: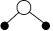 C、中既有离子键也有共价键
D、的电子式:
C、中既有离子键也有共价键
D、的电子式: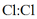 4. 实验室制取时,下列装置不能达到相应实验目的的是( )A、制备
4. 实验室制取时,下列装置不能达到相应实验目的的是( )A、制备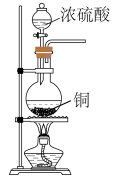 B、检验
B、检验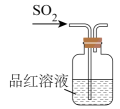 C、干燥
C、干燥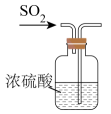 D、收集
D、收集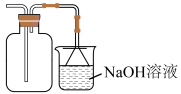 5. 下列物质的性质与用途具有对应关系的是( )A、呈现黄绿色,可用于水体的杀菌消毒 B、苯具有可燃性,可用于萃取水中的 C、具有还原性,可用作葡萄酒的抗氧化剂 D、浓硫酸具有强氧化性,可用于干燥6. 胶体的实验室制备方法如下: , 下列说法不正确的是( )A、该反应是复分解反应 B、反应后溶液呈酸性 C、胶体能净水是因为其具有吸附性 D、向溶液中滴入几滴饱和溶液,也可得到胶体7. 配制溶液时,下列操作不符合规范的是( )A、溶解固体后冷却至室温 B、使用未经干燥的容量瓶 C、用蒸馏水洗涤烧杯内壁及玻璃棒 D、摇匀后发现液面下降再加水至刻度线8. 元素位于元素周期表的第三周期,下列说法正确的是( )A、原子半径: B、元素最高化合价: C、碱性: D、热稳定性:9. 淀粉试纸检验的原理为。下列说法正确的是( )A、中碘元素的化合价为+5 B、是氧化剂 C、发生氧化反应 D、每生成 , 转移电子10. 下列物质转化符合工业生产实际的是( )A、漂白粉 B、饱和食盐水固体 C、溶液 D、11. 下列实验操作能达到实验目的的是( )
5. 下列物质的性质与用途具有对应关系的是( )A、呈现黄绿色,可用于水体的杀菌消毒 B、苯具有可燃性,可用于萃取水中的 C、具有还原性,可用作葡萄酒的抗氧化剂 D、浓硫酸具有强氧化性,可用于干燥6. 胶体的实验室制备方法如下: , 下列说法不正确的是( )A、该反应是复分解反应 B、反应后溶液呈酸性 C、胶体能净水是因为其具有吸附性 D、向溶液中滴入几滴饱和溶液,也可得到胶体7. 配制溶液时,下列操作不符合规范的是( )A、溶解固体后冷却至室温 B、使用未经干燥的容量瓶 C、用蒸馏水洗涤烧杯内壁及玻璃棒 D、摇匀后发现液面下降再加水至刻度线8. 元素位于元素周期表的第三周期,下列说法正确的是( )A、原子半径: B、元素最高化合价: C、碱性: D、热稳定性:9. 淀粉试纸检验的原理为。下列说法正确的是( )A、中碘元素的化合价为+5 B、是氧化剂 C、发生氧化反应 D、每生成 , 转移电子10. 下列物质转化符合工业生产实际的是( )A、漂白粉 B、饱和食盐水固体 C、溶液 D、11. 下列实验操作能达到实验目的的是( )选项
实验目的
实验操作
A
检验溶液中的
向溶液中先加盐酸,再加溶液
B
干燥
将气体通过盛有浓的洗气瓶
C
吸收尾气中的
将气体通入盛有饱和食盐水的烧杯
D
测定氯水的
将氯水滴在试纸上,与标准比色卡对照
A、A B、B C、C D、D12. 硫代硫酸钠中硫元素有0和两种价态,可将水中的余氯转化为 , 减小水中的氯对鱼的危害。易溶于水,不溶于乙醇,在酸性条件下易转化为硫单质和。一种制备的方法为向与混合溶液中通入气体。关于及上述制备反应,下列说法正确的是( )A、具有还原性 B、中两种硫原子性质相同 C、将溶于水时加入乙醇可帮助其溶解 D、该方法制备时须通入过量的至溶液呈酸性13. 硫代硫酸钠中硫元素有0和两种价态,可将水中的余氯转化为 , 减小水中的氯对鱼的危害。易溶于水,不溶于乙醇,在酸性条件下易转化为硫单质和。一种制备的方法为向与混合溶液中通入气体。下列离子方程式书写正确的是( )A、少量与过量溶液反应: B、溶液与稀反应: C、溶液与足量氯水反应: D、溶液在空气中久置变浑:14. 亚氯酸钠是一种高效漂白剂和氧化剂。溶液的实验室制备过程为:反应①:在酸性条件下,还原制备;
反应②:在碱性条件下,与反应,得溶液。
下列说法正确的是( )
A、反应①中用提供酸性环境 B、反应①中参加反应的和的物质的量之比为 C、反应②中的可用代替 D、制备至少需要标准状况下气体二、非选择题(共58分)
-
15. 下表是元素周期表的一部分,请按要求回答问题:
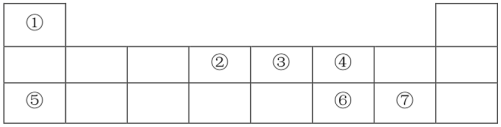 (1)、元素②在周期表中的位置为。元素④的一种原子内有10个中子,该原子是(用核素符号表示)。(2)、元素⑥、⑦的最高价氧化物的水化物中,酸性较强的是(填化学式)。(3)、元素⑤的单质着火不能用水来灭火,其原因是。(4)、肼(N2H4)由元素①、③组成,可与NO2气体反应生成N2和H2O,同时放出大量的热,故常用作火箭燃料。写出该反应的化学方程式,并用双线桥法标出该反应中电子转移的方向和数目:。16. 海水中有丰富的化学资源,可利用海水制盐和提溴。(1)、I海水晒盐获得的粗盐中含有其他盐和难溶性杂质,某兴趣小组在实验室中进行粗盐精制的模拟实验。实验过程如下:称取一定质量的粗盐,加水充分溶解,过滤;向滤液中依次加入稍过量的甲溶液、溶液、乙溶液,过滤;向滤液中加入足量盐酸,蒸发结晶,制得精盐。
(1)、元素②在周期表中的位置为。元素④的一种原子内有10个中子,该原子是(用核素符号表示)。(2)、元素⑥、⑦的最高价氧化物的水化物中,酸性较强的是(填化学式)。(3)、元素⑤的单质着火不能用水来灭火,其原因是。(4)、肼(N2H4)由元素①、③组成,可与NO2气体反应生成N2和H2O,同时放出大量的热,故常用作火箭燃料。写出该反应的化学方程式,并用双线桥法标出该反应中电子转移的方向和数目:。16. 海水中有丰富的化学资源,可利用海水制盐和提溴。(1)、I海水晒盐获得的粗盐中含有其他盐和难溶性杂质,某兴趣小组在实验室中进行粗盐精制的模拟实验。实验过程如下:称取一定质量的粗盐,加水充分溶解,过滤;向滤液中依次加入稍过量的甲溶液、溶液、乙溶液,过滤;向滤液中加入足量盐酸,蒸发结晶,制得精盐。
加水溶解粗盐时,需控制所加入的水的质量。加入水的适宜用量是。(2)、乙溶液为溶液(填化学式)。实验中不取样出来进行分析,判断溶液加入量己“稍过量”的实验方法及现象是。(3)、某同学认为,若粗盐中含的质量为 , 正确进行上述实验操作制得精盐的质量将大于。判断其观点是否合理,并说明理由。(4)、II.从浓海水中提取溴的工艺如下图所示: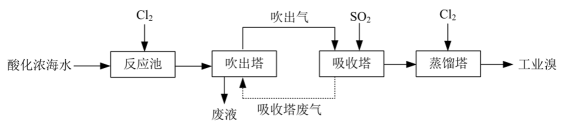
吸收塔中与反应的离子方程式为。
(5)、在反应池中,海水中的己转化为。设计后续步骤将先转化为又转化为 , 目的是。(6)、通入吸收塔的流量与产率关系如题图所示。当流量高于后,产率下降,原因是。 17. 碱式次氯酸镁是一种强氧化性抗菌剂,难溶于水。用镁渣[主要含有等]制备碱式次氯酸镁的流程如下。
17. 碱式次氯酸镁是一种强氧化性抗菌剂,难溶于水。用镁渣[主要含有等]制备碱式次氯酸镁的流程如下。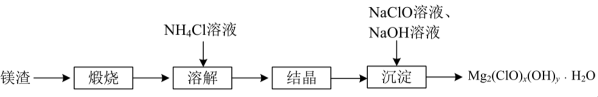 (1)、“煅烧”在700℃高温下进行,煅烧得到的同时,生成气体的化学式为。(2)、“溶解时需加热,反应会生成一种能使红色石蕊试纸变蓝的气体,该反应的化学方程式为。(3)、“沉淀”步骤制备时需控制约为10,碱性太强会产生杂质使沉淀中镁元素含量增大,该杂质的化学式为。用下图所示装置制备。将晶体与溶液、溶液中的一种配成溶液,加入到三颈烧瓶中,80℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中盛放的是溶液(填化学式)。
(1)、“煅烧”在700℃高温下进行,煅烧得到的同时,生成气体的化学式为。(2)、“溶解时需加热,反应会生成一种能使红色石蕊试纸变蓝的气体,该反应的化学方程式为。(3)、“沉淀”步骤制备时需控制约为10,碱性太强会产生杂质使沉淀中镁元素含量增大,该杂质的化学式为。用下图所示装置制备。将晶体与溶液、溶液中的一种配成溶液,加入到三颈烧瓶中,80℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中盛放的是溶液(填化学式)。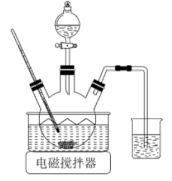 (4)、向的溶液中加入适量溶液、溶液,过滤,洗涤,干燥得到固体。为测定其组成,将所得固体溶于酸,再加入过量的溶液,充分反应生成和。测得生成的为。计算的化学式(写出计算过程)。18. 自然界中含硫物质不断发生转化和转移,形成了硫元素的循环。利用这些转化可以制备重要的化工产品,过程中产生的等会污染环境,需要加以治理。(1)、火山喷发是硫元素在自然界中转化的一种途径,反应过程如图所示。
(4)、向的溶液中加入适量溶液、溶液,过滤,洗涤,干燥得到固体。为测定其组成,将所得固体溶于酸,再加入过量的溶液,充分反应生成和。测得生成的为。计算的化学式(写出计算过程)。18. 自然界中含硫物质不断发生转化和转移,形成了硫元素的循环。利用这些转化可以制备重要的化工产品,过程中产生的等会污染环境,需要加以治理。(1)、火山喷发是硫元素在自然界中转化的一种途径,反应过程如图所示。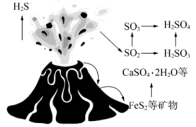
的结构式为。与和溶液反应转化为和 , 理论上转移电子的物质的量为。
(2)、工业上利用的转化制备硫酸,其模拟实验的部分装置如图所示。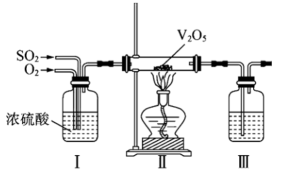
①装置I的作用是(写出两点)。
②装置III用于吸收制备硫酸,适宜的吸收剂是(填字母)。
A.溶液 B.水 C.浓硫酸
③装置II中待反应进行后撤走酒精灯,无需持续加热,原因是。若用、水在催化剂存在时吸收尾气中的 , 吸收完成后,随着氧化的进行,溶液的将(填“增大”“减小”或“不变”)。
(3)、可用作脱除气体的脱硫剂。脱硫和再生的反应机理如图所示。
写出“脱硫”时发生反应的化学方程式。
(4)、的“再生”是在时,用一定浓度的与反应实现(如上图所示)。温度略低于时,“再生”所得固体质量增加,原因是。