福建省厦门市2023-2024学年高二上学期期考化学试题
试卷更新日期:2024-03-12 类型:期末考试
一、选择题(本题共10小题,每小题4分,共40分,每题只有一个选项符合题意)
-
1. 化学与生活密切相关,下列说法正确的是( )A、一氧化碳与血红蛋白存在反应: , 当中毒时,平衡向右移动,使人体组织局部氧气浓度过高而中毒 B、海轮的外壳附上一些锌块,是利用了电解原理的牺牲阳极的阴极保护法 C、汽车尾气治理原理为: , 由于需要借助催化转化器,因此推断该反应在常温下不能自发反应 D、比色分析法可用于某些化学反应速率测定,是利用有色物质浓度与溶液颜色的关系2. 下列反应中,反应物键能大于生成物键能的是( )A、锌粒与稀盐酸反应 B、与NH4Cl反应 C、酸碱中和反应 D、甲烷在O2中燃烧3. 设为阿伏加德罗常数的值,下列叙述正确的是( )A、甲烷的摩尔燃烧焓为甲烷完全燃烧放出热量时,生成个数为 B、氢氧燃料电池中,负极有气体参与反应时,转移的电子数为 C、氯碱工业中,制备烧碱时阴极生成气体的分子数为 D、和于密闭容器中充分反应后,分子的总数为4. 飞秒化学对了解反应机理十分重要。光分解反应经过后的浓度减少。下列说法正确的是( )A、用表示的反应速率是 B、在时,浓度是浓度的2倍 C、末时的反应速率是 D、增大的浓度可以加快反应速率,是因为提高了单位体积内活化分子数目,活化分子百分数增多,单位时间内有效碰撞变多5. 下图为工业合成氨流程图,该反应速率方程为 , 原料气(及少量的混合气体)在进入合成塔前可经过铜氨液净化处理,其反应为: , 有关说法错误的是( )
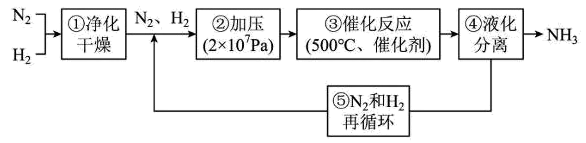 A、步骤①中“净化”可以防止催化剂中毒 B、步骤②中“加压”既可以提高合成氨原料的转化率,又可以加快反应速率 C、为保证足够高的反应速率,反应达到一定转化率时需及时将氨从体系中分离 D、“净化”时适当升高温度,可增大反应速率和的平衡转化率6. 下列电极反应式或离子方程式与所述事实相符且正确的是( )A、惰性电极电解氯化镁溶液总反应: B、铅蓄电池正极反应式: C、吸氧腐蚀正极反应式: D、碱性甲烷燃料电池负极反应式:7. 已知 , 反应开始时,向密闭容器中加入一定量的 , 下列图像与描述错误的是( )
A、步骤①中“净化”可以防止催化剂中毒 B、步骤②中“加压”既可以提高合成氨原料的转化率,又可以加快反应速率 C、为保证足够高的反应速率,反应达到一定转化率时需及时将氨从体系中分离 D、“净化”时适当升高温度,可增大反应速率和的平衡转化率6. 下列电极反应式或离子方程式与所述事实相符且正确的是( )A、惰性电极电解氯化镁溶液总反应: B、铅蓄电池正极反应式: C、吸氧腐蚀正极反应式: D、碱性甲烷燃料电池负极反应式:7. 已知 , 反应开始时,向密闭容器中加入一定量的 , 下列图像与描述错误的是( )A
B
C
D


表示相同时间内体系内的物质的量分数随温度变化图像
表示体系到达平衡后,时迅速将体积缩小后的变化
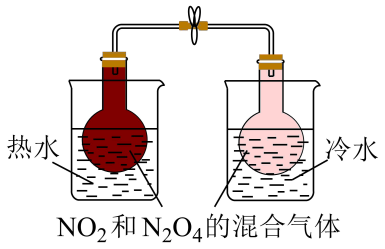
装置可探究温度对该化学平衡的影响,热水中颜色变深,冷水中颜色变浅
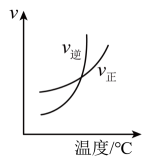
表示该反应正逆反应速率随温度变化图像
A、A B、B C、C D、D8. 氢碘酸(HI)可用“四室式电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列叙述错误的是( ) A、通电后,阴极室溶液pH增大 B、阳极电极反应式为2H2O-4e-===4H++O2↑ C、得到1 mol产品HI,阳极室溶液质量减少8 g D、通电过程中,NaI的浓度逐渐减小9. 科学家提出了碳酸二甲酯(结构简式为:CH3OCOOCH3)一种新的合成方案(吸附在催化剂表面上的物种用*标注),反应机理如下图所示。下列说法错误的是( )
A、通电后,阴极室溶液pH增大 B、阳极电极反应式为2H2O-4e-===4H++O2↑ C、得到1 mol产品HI,阳极室溶液质量减少8 g D、通电过程中,NaI的浓度逐渐减小9. 科学家提出了碳酸二甲酯(结构简式为:CH3OCOOCH3)一种新的合成方案(吸附在催化剂表面上的物种用*标注),反应机理如下图所示。下列说法错误的是( )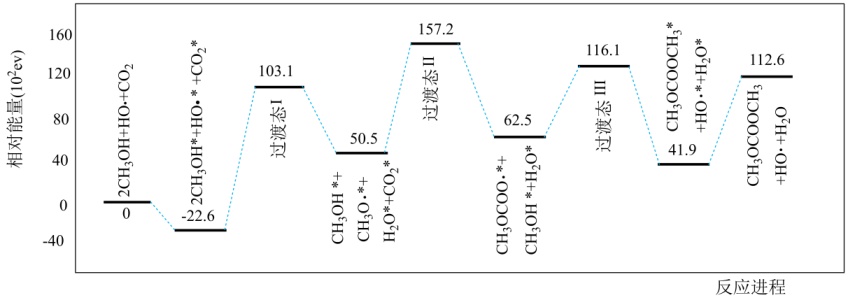 A、反应进程中既有O-H键的断裂,又有O-H键的形成 B、HO·降低了反应的活化能 C、是该反应的决速步骤 D、吸附和脱附过程中共吸收112.6eV的能量10. 在一定的温度和压强下,将按一定比例混合的和通过装有催化剂的反应器可得到甲烷。
A、反应进程中既有O-H键的断裂,又有O-H键的形成 B、HO·降低了反应的活化能 C、是该反应的决速步骤 D、吸附和脱附过程中共吸收112.6eV的能量10. 在一定的温度和压强下,将按一定比例混合的和通过装有催化剂的反应器可得到甲烷。已知:
催化剂的选择是甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测转化率和生成选择性[选择性]随温度变化的影响如图所示。下列有关说法正确的是( )
 A、在间,以为催化剂,升高温度的产率不变 B、延长点的反应时间,一定能提高的转化率 C、反应在任何温度下均不能自发进行 D、由图像分析,工业上应选择的催化剂是 , 合适温度为
A、在间,以为催化剂,升高温度的产率不变 B、延长点的反应时间,一定能提高的转化率 C、反应在任何温度下均不能自发进行 D、由图像分析,工业上应选择的催化剂是 , 合适温度为二、非选择题(本题共4小题,共60分)
-
11. 实验探究是学习化学原理知识的重要方法,请回答下列问题:(1)、Ⅰ.某实验小组用溶液和溶液进行中和热的测定
若实验中大约要使用溶液,则至少需要称量固体。(2)、各取溶液和溶液进行实验,若溶液的密度都是 , 反应后溶液比热容 , 实验测得反应前后的温度差平均值为写出表示该反应的中和热的热化学方程式为:(的值取小数点后一位)(3)、上述实验测得中和热的数值偏小,产生偏差的原因可能是(填字母)。a.两烧杯夹层间碎纸条没有填满
b.配制硫酸溶液,定容时俯视
c.分多次把溶液倒入盛有硫酸的小烧杯中
d.记录混合液的最高温度作为终止温度
(4)、Ⅱ.碘钟反应是一种化学振荡反应,其体现了化学动力学的原理。某小组同学在室温下对某“碘钟实验”的原理进行探究。资料:该“碘钟实验”反应分两步进行:反应(慢) 反应(快)
该“碘钟实验”的总反应是。
(5)、已知反应的速率方程为: , 式中为常数。为确定值进行实验Ⅱ(溶液浓度均为)。实验中借助淀粉实现颜色变化。实验序号
试剂体积
显色时间
溶液
溶液
水
溶液
淀粉溶液
①
10
10
0
4
1
27.0
②
5
10
5
4
1
54.0
③
2.5
10
4
1
108.0
④
10
5
5
4
1
54.0
①表中。
②通过数据计算得知: , 。
12. 实现碳达峰、碳中和是贯彻新发展理念的内在要求,因此二氧化碳的合理利用成为研究热点,有效方式之一就是二氧化碳直接加氢合成高附加值产品。(1)、一定条件下,可用二氧化碳加氢合成甲醇。 , 该反应经过以下步骤实现:Ⅰ.
Ⅱ.
①求
②已知反应Ⅰ是整个反应的决速步,下列示意图中能体现上述反应能量变化的是(填标号)。
A.
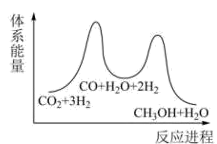
B.
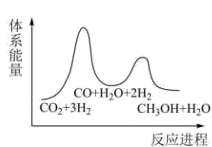
C.

D.
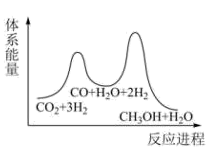 (2)、一定条件下也可用二氧化碳加氢合成甲烷:。
(2)、一定条件下也可用二氧化碳加氢合成甲烷:。①在绝热恒容密闭容器中,一定能说明该反应达到平衡状态的是(填字母)。
A.
B.相同时间内断裂的数目与断裂数目相等
C.容器温度保持不变
D.当与物质的量之比保持不变
一定温度下在恒温恒容密闭容器中初始加入和一定量 , 发生上述反应数据如下:
0
1
2
3
4
5
6
2.0
1.5
1.1
0.8
0.6
0.5
0.5
3.2
②该温度下反应的化学平衡常数为
(3)、一定条件下也可用二氧化碳加氢合成甲酸①温度为时,等物质的量的和充入体积为的恒容密闭容器中发生反应:。实验测得:为速率常数。时,。
②温度从到时, , 则时平衡压强(填“"“”或“")时平衡压强,理由是。
(4)、一定条件下可用二氧化碳提供电能,“溶解”水中的二氧化碳发生电化学反应,产生电能和氢气,其工作原理如图所示。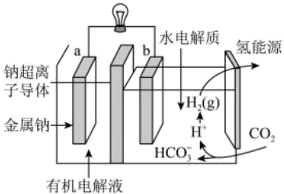
①左室有机电解液是有机溶剂加特定的盐加热制成,该装置的有机电解液(填“能”或“不能”)用乙醇做溶剂。
②写出二氧化碳生成氢气的电极反应式:。
13. 电解法可用于提纯金属。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应),某小组在实验室条件下以CuSO4溶液为电解液,用电解的方法实现粗铜精炼,并将电解液和阳极泥进行回收。(1)、步骤一:电解精炼铜,用下图装置电解时。
①粗铜应该为极(填“A”或“B”);
②CH3OH参加的电极方程式为;
③当A极质量变化ag,当B极质量变化bg时,左池消耗O2的质量为g;
④电解结束后,右池溶液中CuSO4的浓度会(填“增大”或“不变”或“减小”)。
(2)、步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
①电解液中的溶质除了硫酸铜还有;
②操作a中用到的玻璃仪器除烧杯外还有;
③残渣含有少量的黄金,为了回收金,查阅了相关资料(见下表)
反应原理
化学平衡常数
反应1
Au+6HNO3Au(NO3)3+3NO2↑+3H2O
K1=2×10-8
反应2
Au(NO3)3+4HClH[AuCl4]+3HNO3
K2=4×1011
反应3
Au+3HNO3+4HClH[AuCl4]+3NO2↑+3H2O
K3
请通过计算化学平衡常数来解释为什么金很难与浓硝酸反应,但却可溶于王水(浓硝酸与浓盐酸的混合物)。
14. 一种以钛铁矿( , 含等杂质)为主要原料制备钛白粉的工艺流程如图所示。
已知:①“酸浸”后钛元素主要以形式存在;
②在时生成沉淀,时沉淀完全。
(1)、“酸浸”时,常将钛铁矿粉碎,并进行搅拌,其目的是。(2)、“酸浸”时,发生反应的化学方程式为。(3)、滤渣①的主要成分是(填化学式)。(4)、流程中加入铁粉的目的是还原体系中的。为探究最佳反应条件,某化学兴趣小组在保持反应时间相同的情况下进行探究得到结果如下。保持其它反应条件不变,还原体系中(Ⅲ)(价的铁元素)含量随变化如图所示。
①试分析点以后体系中(Ⅲ)含量随着大而增大的原因是。
②保持其它反应条件不变,还原体系中(Ⅲ)含量随温度变化如图所示。由图可知,还原体系中(Ⅲ)的最佳反应温度为
 (5)、如图为剑桥法用固体二氧化钛生产海绵钛的装置示意图,其原理是在较低的阴极电位下,(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为 , 产生的气体中的化学式为。
(5)、如图为剑桥法用固体二氧化钛生产海绵钛的装置示意图,其原理是在较低的阴极电位下,(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为 , 产生的气体中的化学式为。