上海市浦东新区建平中学2023-2024学年高一上学期期末教学质量检测化学试卷
试卷更新日期:2024-03-12 类型:期末考试
一、选择部分
-
1. 下列化学用语不正确的是( )A、的原子结构示意图是:
 B、的电子式是:
B、的电子式是: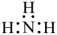 C、的分子结构式是:
C、的分子结构式是: D、的形成过程是:
D、的形成过程是: 2. S与Cl为同一周期元素,下列事实正确且能比较两者非金属性强弱的是( )A、热稳定性: B、酸性: C、氢化物的沸点: D、将氯气通入溶液中,观察到有淡黄色沉淀产生3. 下列叙述中正确的是( )A、含离子键的化合物一定是离子化合物 B、含共价键的化合物一定是共价化合物 C、全部由非金属元䋈组成的化合物一定是共价化合物 D、在离子化合物中不可能有共价键
2. S与Cl为同一周期元素,下列事实正确且能比较两者非金属性强弱的是( )A、热稳定性: B、酸性: C、氢化物的沸点: D、将氯气通入溶液中,观察到有淡黄色沉淀产生3. 下列叙述中正确的是( )A、含离子键的化合物一定是离子化合物 B、含共价键的化合物一定是共价化合物 C、全部由非金属元䋈组成的化合物一定是共价化合物 D、在离子化合物中不可能有共价键二、填空部分
-
4. 《自然》杂志曾报道我国科学家通过测量中和两种核素的比例确定“北京人”生存年代的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:(1)、和____。A、是同种元素 B、是同种核素 C、具有相同中子数 D、具有相同性质(2)、自然界一共存在三种硅的稳定同位素,分别是、、。
①原子的结构示意图为。
②计算硅元素的近似相对原子质量的计算为 , 其中……是指各同位素的。
(3)、向盐酸中逐滴滴加硅酸钠溶液,当达到6~7时得到一种乳白色、半透明的分散系,其分散质为粒径在的粒子。该分散系属于(选填“溶液”“浊液”“胶体”),简单的证明方法是。5. 短周期元素Q、R、T、X、Y在元素周期表中的位置如图所示,期中X所处的周期序数与主族序数相等。请回答下列问题: (1)、R元素在元素周期表中的位置为(2)、Q元素的最高价氧化物对应的水化物电离的方程式是。(3)、Y的氢化物稳定性(强/弱),原因是。(4)、R、T、X元素形成的简单离子的半径由小到大的顺序为(用离子符号表示)。T元素的氢化物可用于在室温下实验室制备氧气,该化合物的结构式是 , 在相同条件下,T的三原子组成的单质相对于氢气的密度是。(5)、Q有多种氧化物,其中甲的相对分子质量最小,一定条件下,的甲气体与的氧气相混合点燃,完全反应后气体被足量的溶液完全吸收后没有气体残留,所生成Q的含氧酸盐只有一种,则该含氧酸盐的化学式是 , 属于晶体。
(1)、R元素在元素周期表中的位置为(2)、Q元素的最高价氧化物对应的水化物电离的方程式是。(3)、Y的氢化物稳定性(强/弱),原因是。(4)、R、T、X元素形成的简单离子的半径由小到大的顺序为(用离子符号表示)。T元素的氢化物可用于在室温下实验室制备氧气,该化合物的结构式是 , 在相同条件下,T的三原子组成的单质相对于氢气的密度是。(5)、Q有多种氧化物,其中甲的相对分子质量最小,一定条件下,的甲气体与的氧气相混合点燃,完全反应后气体被足量的溶液完全吸收后没有气体残留,所生成Q的含氧酸盐只有一种,则该含氧酸盐的化学式是 , 属于晶体。三、选择部分
-
6. 实验室海带提碘的实验中不涉及的操作是( )A、浸泡 B、萃取 C、过滤 D、蒸发7. 下列玻璃仪器在相应实验中应用不合理的是( )
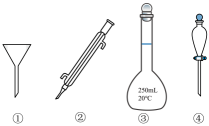 A、①用于粗盐提纯实验除去泥沙 B、②用于蒸馏法分离乙醇和 C、③用于实验室稀释浓硫酸 D、④用于提碘实验萃取后分液8. 海水提溴与海带提碘,共同点是 ( )A、浓缩方法 B、采用热空气吹出 C、四氯化碳萃取 D、氧化剂可选择氯水
A、①用于粗盐提纯实验除去泥沙 B、②用于蒸馏法分离乙醇和 C、③用于实验室稀释浓硫酸 D、④用于提碘实验萃取后分液8. 海水提溴与海带提碘,共同点是 ( )A、浓缩方法 B、采用热空气吹出 C、四氯化碳萃取 D、氧化剂可选择氯水四、填空部分
-
9. 模拟用空气吹出法从海水中提取溴的工艺流程,如下图:
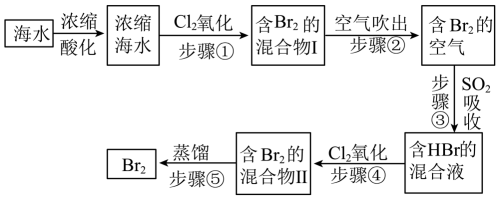
请回答下列问题。
(1)、将海水浓缩的方法是。(2)、步骤②通入热空气吹出 , 利用了的性质。(3)、步骤①中的氯气改为过氧化氢,则其反应的离子方程式是 , 步骤③反应的离子方程式是。从理论上分析,下列也能吸收溴的是(不定项选择)。A. B. C. D.
(4)、已知海水中含量为 , 在上述流程步骤①的氯气氧化过程中,若将海水中的溴元素完全氧化得到含的混合物Ⅰ,至少需要标准状况下的体积L(Cl2在水中溶解和与水反应均忽略)。10. 海水提纯精盐的过程是用化学沉淀法去除粗盐中的杂质离子和 , 有学生设计出如下粗盐提纯工艺流程图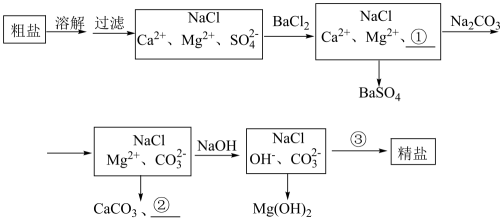 (1)、①上述溶解过程所需仪器除烧杯外,还需要的玻璃仪器为。(2)、②除杂的原则尽量不引入新杂质,但图中新引入的杂质离子①为 , ②对应的物质是。(3)、上述流程图中③处加入的试剂是(填名称),写出流程中③处发生的离子反应方程式 , 。(4)、化学沉淀法中和加入的顺序能否交换?(填“能”或“否”)。(5)、③处加入的市售试剂通常较浓,配制1L1mol/L的③处溶液,所需1.19g/mL,质量分数为的浓溶液,体积L(保留两位有效数字)。11. 已被世界卫生组织(WHO)列为级的安全高效灭菌消毒剂,我国从2000年起就逐渐用取代对饮用水进行消毒。下图是某实验室用于制备一定量较纯净的的装置(某些夹持装置等省略)。
(1)、①上述溶解过程所需仪器除烧杯外,还需要的玻璃仪器为。(2)、②除杂的原则尽量不引入新杂质,但图中新引入的杂质离子①为 , ②对应的物质是。(3)、上述流程图中③处加入的试剂是(填名称),写出流程中③处发生的离子反应方程式 , 。(4)、化学沉淀法中和加入的顺序能否交换?(填“能”或“否”)。(5)、③处加入的市售试剂通常较浓,配制1L1mol/L的③处溶液,所需1.19g/mL,质量分数为的浓溶液,体积L(保留两位有效数字)。11. 已被世界卫生组织(WHO)列为级的安全高效灭菌消毒剂,我国从2000年起就逐渐用取代对饮用水进行消毒。下图是某实验室用于制备一定量较纯净的的装置(某些夹持装置等省略)。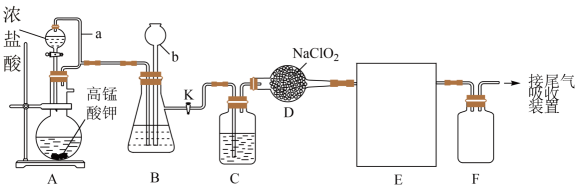
①实验室可用亚氯酸钠固体(NaClO2)与氯气反应来制备。
②通常情况下,是一种有剌激性气味的黄绿色气体、常温下1L水约溶解 , 遇热水不稳定,其熔点为-59.5℃,沸点为11℃。请回答:
(1)、盛放浓盐酸的仪器名称是。(2)、①请将A装置中发生反应的方程式配平并用单线桥法标出电子转移的方向和数目。②氧化产物是 , 被还原的元素为。
③若生成(标准状况下)气体,则反应中转移电子个数为。
④该反应中氧化剂和还原剂的物质的量之比为。
(3)、写出D中制备反应的化学反应方程式。(4)、下列操作或描述正确的是____。A、装置A中导气管a起平衡气压作用,可以使浓盐酸顺利流下 B、A装置中的高锰酸钾可用二氧化锰替代 C、E装置用以收集 , 宜采用冰水浴冷却 D、F可起防倒吸作用,若用氢氧化钠溶液吸收尾气,只含一种溶质(5)、B中所盛试剂是 , C中所盛试剂是。(6)、已知氯气与氢氧化钠溶液在较低温度下生成和 , 在较高温度下生成和在一定温度下,将一定是氯气通入氢氧化钠溶液中,溶液中生成的和个数之比为 , 则该反应中氧化剂与还原剂质量之比为。五、选择部分
-
12. 在无色溶液中能大量共存的一组离子是( )A、 B、 C、、 D、13. 常温下0.1mol/LFe2(SO4)3溶液中,各组离子能大量共存的是( )A、 B、 C、 D、14. 下列反应的离子方程式书写正确的是( )A、溶液和溶液反应: B、与溶液反应: C、与盐酸反应: D、醋酸和氢氧化铜反应:
六、填空部分
-
15. 溶液甲可能含有八种离子中的若干种。为确定溶液的组成,将其分成两等份,进行如下实验:
①向一份溶液中加入足量溶液并加热,产牛气体(标准状况);
②向另一份溶液中加入的溶液 , 恰好可以与溶液中的离子完全反应,过滤得到43g的沉淀B和一定体积的滤液;
③向上述沉淀中加入过量的盐酸,白色沉淀部分溶解,剩余23.3g沉淀,产生的气体通入足量澄清石灰水中,得到沉淀C;
④向上述滤液中加溶液 , 恰使溶液中离子完全沉淀;
据此,请回答下列问题(用相应的离子符号表示):
(1)、实验①中可得到含有的离子是;(2)、定量分析实验②中43g沉淀成分。(写出化学式);(3)、实验③中得到沉淀C的质量为;(4)、甲溶液中一定不存在的离子是;可能存在的离子是;(5)、甲溶液一定存在的离子中,物质的量最大的离子是;物质的量最小的离子是 , 此物质的量最小的离子其物质的量为。