【精品解析】浙教版八年级下册科学寒假预习精选题-第二单元-第6节 表示物质的符号
试卷更新日期:2024-03-08 类型:同步测试
一、单选题
-
1. 下列关于二氧化氮的化学式NO2表示意义的叙述不正确的是( )A、表示二氧化氮这种物质 B、表示一个二氧化氮分子 C、二氧化氮这种物质由一种氮元素和两种氧元素组成 D、一个二氧化氮分子由一个氮原子和两个氧原子构成2. 胱氨酸(C₆H₁₂O₄N₂S)能保护细胞免于铜中毒。 下列有关说法正确的是( )A、胱氨酸由5种原子构成 B、分子中质子数大于电子数 C、铜中毒中的铜指铜元素 D、组成元素C和N 是同族元素3. 科学家使用普通氧分子和带正电的氧离子,制造出了一种由4个氧原子构成的新型氧分子(O₄)。下列叙述正确的是……( )A、O₄是一种新型的化合物 B、O₄和O₂的性质完全相同 C、O₄和O₂混合后形成的是混合物 D、一个O₄分子中含有2个O₂分子4. 84消毒液是常见的含氯消毒剂,其有效成分中的氯元素的化合价为+1,则84消毒液的有效成分是…………………………( )A、氯化钠(NaCl) B、次氯酸钠(NaClO) C、氯酸钠(NaClO₃) D、亚氯酸钠(NaClO₂)5. 图甲模型表示失去一个电子的钠离子和得到一个电子的氯离子的组合,图乙模型表示失去两个电子的镁离子和得到一个电子的氯离子的组合,则丙模型可能表示下列哪一个化学式…( )
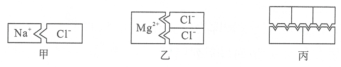 A、CO₂ B、Mg₃N₂ C、Al₂O₃ D、CaCO₃6. “3H₂SO₄”中有“1”(已省略不写)“2”“3”“4”四个数字,关于它们表示的意义,下列说法不正确的是………………………( )A、“1”表示硫元素的个数 B、“2”表示每个分子中含有的氢原子的个数 C、“3”表示分子的个数 D、“4”表示每个分子中含有的氧原子的个数7. 下列化学用语,数字“2”的说法正确的是…………………( )
A、CO₂ B、Mg₃N₂ C、Al₂O₃ D、CaCO₃6. “3H₂SO₄”中有“1”(已省略不写)“2”“3”“4”四个数字,关于它们表示的意义,下列说法不正确的是………………………( )A、“1”表示硫元素的个数 B、“2”表示每个分子中含有的氢原子的个数 C、“3”表示分子的个数 D、“4”表示每个分子中含有的氧原子的个数7. 下列化学用语,数字“2”的说法正确的是…………………( )①2H ②2NH3③SO₂④ ⑥Mg2+⑥2OH-⑦H2O
A、表示离子个数的是⑤⑥ B、表示离子所带电荷数的是④⑤ C、表示分子中原子个数的是③⑦ D、表示分子个数的是①②8. 小明在学习了元素和物质的知识后,进行了梳理,其中正确的是……………………………………………( )A、铁元素的质量分数由高到低: B、氮元素的化合价由高到低:HNO₃、NO₂、NH₃、NO C、地壳中最多的金属元素和非金属元素组成的化合物为:Al₂O₃ D、海水中元素含量从高到低:氯、钠、氧、氢9. 下列各组化合物中含有同种原子团的是( )A、NH₄Cl和CO(NH₂)₂ B、Na₂SO₃和 SO₃ C、KMnO₄和 K₂MnO₄ D、KClO₃和 Ca(ClO₃)₂10. 下列各个化学变化前后,加点元素的化合价数值变化最大的是 ( )A、C→CO₂ B、KClO₃→KCl C、KMnO₄→K₂MnO₄ D、NH₃→NH₄Cl11. 乙烯(C₂H₄)、丙烯(C₃H₆)、丁烯(C₄H₈)的组成和结构都很相似,这类物质被称为烯烃。据此推断分子中碳原子数为 n的烯烃的化学式可写为 ( )A、CnH₂n B、CnH₂n₊₂ C、CnH₂n-₂ D、CnHn12. 1869年俄国科学家门捷列夫首创元素周期表。他把元素原子按照质子数由小到大进行排列;把原子的电子层数相同的排在一个横行,叫做“周期”,即周期数与该原子的电子层数相同;把原子最外层电子数相同的排在一个纵行,叫做“族”,其数值与该原子的最外层电子数相同。根据以上材料,第三周期第六族元素的有关推断错误的是 ( )A、该元素原子的质子数为 16 B、该元素可能有多种化合价 C、与该元素同周期的还有8种元素 D、该元素属于非金属元素13. 以下对 O₂、CO₂、SO₂、MnO₂四种物质的组成的说法中,正确的是 ( )A、都含有2个氧原子 B、都含有氧分子 C、都含有2个氧元素 D、都含有氧元素14. 下列物质的化学式书写正确的是( )A、氧化镁(Mg2O) B、碳酸钠(NaCO3) C、硝酸钾(KNO3) D、氯气(Cl)二、填空题
-
15. 煤、石油、天然气常被称为三大化石燃料,其中天然气的主要成分是甲烷(CH₄),请回答下列问题。(1)、CH₄中碳元素的化合价为。(2)、甲烷是最简单的有机化合物。从宏观角度来看,甲烷是由组成的;从微观角度看,甲烷是由构成的,一个甲烷分子是由构成的。16. A、B²-、C+三种微粒都具有10个核外电子,C₂B组成的化合物的化学式为 , C、B与氢三种元素组成的化合物的化学式为。17. 若某溶液中仅含 Na⁺、Mg²⁺、和Cl⁻四种离子,其中离子个数比为则 Na⁺:的个数比为。18. 根据化学式的书写规则,写出下列物质的化学式。
氦气:氖气:
氢气:硅:
一氧化碳:
二氧化硫:
铁条:木炭:
硫黄:氧气:
氮气:氯气:
19. 由碳、氢两种元素组成的环状有机化合物中,从含三个碳原子到含十个碳原子的碳氢化合物依次按丙、丁、戊、己、庚、辛、壬、癸来标记碳原子数,并根据碳原子数命名为“环某烷”。如环丙烷,其化学式为 , 结构式如图甲所示,也可简写为图乙。现有一种由碳、氢两种元素组成的有机环状化合物,其结构式简写成图丙,该物质的名称是 , 化学式为。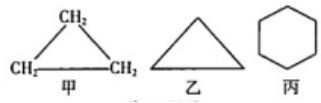 20. 请用数字和符号表示:
20. 请用数字和符号表示:水;硫酸根离子;3个镁原子;两个铁离子;氧化钙中钙元素化合价;氯化钠的化学式;3个二氧化碳分子;金元素。
三、实验探究题
-
21. 元素周期表将已知元素科学有序地排列起来,便于我们研究它们的性质和用途。右表表示元素周期表的一部分,请回答下列问题。
H
He
①
N
②
Ne
③
Ar
(1)、元素在周期表中的分布是有规律的,表中①②③所代表的三种元素中,属于非金属的是。(2)、表中氮元素的化合价有多种,请写出化合价为+1价的氮的氧化物(用化学式表示)。(3)、氦气的化学式为。(4)、随着新元素的不断发现,元素周期表还将逐渐完善。最近,科学家用大量高速钙原子轰击锫原子,形成了117号元素的原子,该元素原子核中一定含有117个。22. 隔夜菜是否能吃,主要在于烧熟后的隔夜菜中亚硝酸盐含量的变化是否符合食品安全要求。蔬菜中的硝酸盐来自生长过程中所施氮肥,空气中微生物(如硝酸盐还原菌),会产生一种还原酶,使蔬菜中的部分硝酸盐还原成亚硝酸盐。烧熟后的菜在食用和保存阶段都会有一些细菌进入:做熟的蔬菜更适合细菌生长。某研究小组对烧熟的菜中亚硫酸盐含量做了测试,数据如下表:盖有保鲜膜的菜肴在4℃的冰箱中放置不同时间的亚硝酸盐含量(单位:mg/kg)
菜肴
半小时
6小时
18小时
24小时
炒青菜
0.6861
0.7982
4.3333
5.3624
韭菜炒蛋
1.8153
1.9249
2.8390
5.6306
红烧肉
2.4956
4.2558
4.0668
5.5188
红烧鲫鱼
/
2.0948
3.2300
7.2397
将一份红烧鲫鱼样本(不盖保鲜膜)在常温下放置4小时,测定其亚硝酸盐含量为8.9483mg/g。
请根据以上材料,回答下列问题:
(1)、亚硝酸盐中含有亚硝酸根离子NO2﹣ , 其中氮元素的化合价是价。(2)、根据表中的数据,菜中的亚硝酸盐含量变化的共同规律是:。(3)、要使烧熟后的隔夜菜中亚硝酸盐含量尽可能低,保存的条件应该是。(4)、用多种菜做实验的目的是。23. 了解物质的组成和结构,有助于认识物质的性质.(1)、如图表示核电荷数为11~17的元素最高和最低化合价.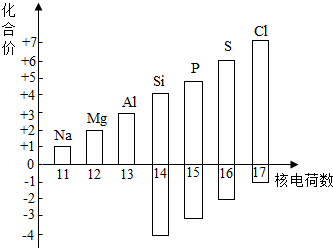
①从图中可以看出,氯元素的最高正价是 .
②若某元素既可显正价,又可显负价,则最高正价与最低负价绝对值的代数和为 .
③写出图中元素的化合价随着核电荷数递增的一条变化规律 .
四、解答题
-
24. 图、表是整理数据、发现其中规律的一种重要工具。1~18号元素原子最外层电子数与原子序数的关系如图所示。据图回答下列问题。
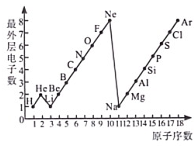 (1)、第三周期11~18号元素原子最外层电子数变化的趋势是。(2)、最外层电子数为4的是(写名称,下同)元素和元素。原子的核外电子排布,特别是最外层的电子数目,与元素的化学性质有密切关系,
(1)、第三周期11~18号元素原子最外层电子数变化的趋势是。(2)、最外层电子数为4的是(写名称,下同)元素和元素。原子的核外电子排布,特别是最外层的电子数目,与元素的化学性质有密切关系,则和氧元素化学性质最相似的是元素。
(3)、在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低。探究钾元素(原子序数为19)单质与水反应的生成物。甲同学猜想生成物为KOH和H₂;乙同学猜想生成物为KOH和O₂,你认为同学的猜想不合理,请从化合价的角度解释原因。25. 有A、B、C、D四种元素,已知A元素是人体中含量最多的元素,B元素的原子可以直接构成最坚硬的矿物单质,C元素的原子失去一个电子后只剩下一个质子,D+的电子层结构与氖原子相同。请回答下列问题。(1)、由A元素组成单质的化学式为。(2)、B元素的元素符号为。(3)、C元素的离子符号为。(4)、A、C、D三种元素组成化合物的化学式为。26. 如下图,向A.B 两个体积相同的集气瓶中分别装有等分子数的无色硫化氢(H2S)气体和二氧化硫气体。抽开毛玻璃片,瓶口对紧,颠倒几次,使两种气体充分混合。一会儿, 两瓶内壁可见附着淡黄色固体颗粒。若用●表示氢原子,○表示氧原子,
 表示硫原子,上述反应过程可用下图表示:
表示硫原子,上述反应过程可用下图表示: (1)、硫化氢、二氧化硫中硫元素的化合价分别为(2)、反应完毕,瓶内壁上的淡黄色固体颗粒是 (填化学式)(3)、如果两个瓶子是质地较软的塑料瓶,将会观察到塑料瓶 ,原因是。27. 化合价是一个重要的化学概念。下面是对元素化合价的部分探究过程。
(1)、硫化氢、二氧化硫中硫元素的化合价分别为(2)、反应完毕,瓶内壁上的淡黄色固体颗粒是 (填化学式)(3)、如果两个瓶子是质地较软的塑料瓶,将会观察到塑料瓶 ,原因是。27. 化合价是一个重要的化学概念。下面是对元素化合价的部分探究过程。[提出问题一] 元素正负化合价有何规律?
推测一:金属元素在化合物中都显正价;
推测二:非金属元素在化合物中只有负价。
[举例及分析一]
(1)、NaCl、FeO、Al2O3中金属元素化合价分别为+1、+2、+3,其他金属在化合物中也都显正价,推测一正确。金属都显正价的可能原因是。(2)、H2O、SO2、CO2中氢、氧、硫、碳元素的化合价分别为+1、-2、+4、+4,说明推测二(填“成立”或“不成立”)。(3)、金属元素与非金属元素形成化合物时,非金属元素显价。(4)、[提出问题二] 一种元素在化合物中只有一种化合价吗?推测一:一种元素在化合物中只有一种化合价;
推测二:。
(5)、[举例及分析二]①由NaCl、NaOH、Na2CO3、Na2SO4等物质中钠元素都显+1价,得出推测一成立。
②由H2S、SO2、SO3、H2SO3等物质中硫元素化合价不同,硫元素化合价分别为-2、+4、+6、 , 得出推测二成立。
(6)、[结论] 通过上述举例分析及结合教材上所给元素的化合价,可知。(7)、[提出问题三] 在同种化合物中,同种元素一定具有相同的化合价吗?推测一:在同种化合物中,同种元素一定具有相同的化合价;
推测二:在同种化合物中,同种元素不一定具有相同的化合价。
[举例及分析三]
NH4NO3中氮元素的化合价为、。
[结论] 在同种化合物中,同种元素不一定具有相同的化合价。