天津市河北区2023-2024学年高一上学期1月期末质量检测化学试题
试卷更新日期:2024-03-08 类型:期末考试
一、选择题(本卷共30题,每题2分,共60分。在每题给出的四个选项中,只有一项是最符合题目要求的,请将答案填入下表中。)
-
1. 下列元素属于短周期主族元素的是( )A、I B、Fe C、P D、K2. 当光束通过下列分散系时,能观察到丁达尔效应的是( )A、蔗糖溶液 B、硫酸铜溶液 C、氢氧化铁胶体 D、饱和食盐水3. 下列属于电解质的是( )A、氯化钠溶液 B、氢氧化钠 C、二氧化碳 D、金属锌4. 下列物质属于两性氧化物的是( )A、 B、 C、 D、5. 下列物质含有非极性共价键的是( )A、 B、 C、 D、6. 危险化学品要在包装标签上印有警示性标志,氢氧化钠应选用的标志是( )A、
 B、
B、 C、
C、 D、
D、 7. 下列各组中的离子,能在溶液中大量共存的是( )A、、 , , B、、 , 、 C、、、、 D、、、、8. 下列物质进行焰色试验,其火焰为黄色的是( )A、Na2SO4 B、Mg(OH)2 C、KCl D、HNO39. 下列物质互为同素异形体的是( )A、和 B、和 C、和 D、和10. 下列物质能与水反应,且不属于氧化还原反应的是( )A、金属钠 B、氧化钠 C、过氧化钠 D、氢氧化钠11. 合金具有许多优良的性能。下列物质属于合金的是( )A、氧化铜 B、硬铝 C、水银 D、钠12. 下列反应的离子方程式正确的是( )A、铁粉与氯化铁溶液反应: B、用稀盐酸除去铁表面的铁锈: C、用大理石与稀盐酸反应制备二氧化碳: D、稀硫酸与氢氧化钡溶液反应:13. 下列变化需要加入氧化剂才能实现的是( )A、Fe→Fe2+ B、CO2→CO C、N2O5 →HNO3 D、NaClO3 →Cl214. 下列关于钠的叙述中,不正确的是( )A、钠燃烧时发出黄色的火焰 B、常温下钠与氧气反应生成氧化钠 C、钠离子有很强的还原性 D、钠原子的最外层只有1个电子15. 下列物质的保存方法,与其化学性质无关的是( )A、金属钠保存在煤油中 B、浓盐酸需密闭保存 C、新制氯水存放于密闭棕色瓶中 D、过氧化钠需干燥密闭保存16. 下列关于物质用途的说法不合理的是( )A、用于制玻璃 B、用作油漆的红色颜料 C、铝制餐具用于蒸煮酸性食物 D、用作棉、麻、纸张的漂白剂17. 下列物质中,既含有氯分子,又含有氯离子的是( )A、氯化钠溶液 B、新制氯 C、漂白粉 D、液氯18. 下列关于铁及其化合物的叙述正确的是( )A、氢氧化铁受热分解可制得 B、、都有磁性 C、不稳定,在空气里受热,能迅速氧化成 D、高温下,铁能与水蒸气反应生成19. 能证明某溶液中只含而不含的实验及现象是( )A、只需滴加溶液,溶液不显红色 B、先滴加氯水,再滴加溶液后显红色 C、先滴加溶液,溶液呈红色,再加足量铁粉红色消失 D、先滴加KSCN溶液,溶液不显红色,再滴加少量氯水后显红色20. 下列关于碱金属单质的说法不正确的是( )A、都具有还原性 B、都能与水反应产生 C、都具有金属光泽 D、都能与反应生成过氧化物21. 下列有关物质性质的比较,可以用元素周期律加以解释的是( )A、酸性: B、溶解度(25℃): C、沸点: D、热稳定性:22. 已知如下三个实验均能发生化学反应:
7. 下列各组中的离子,能在溶液中大量共存的是( )A、、 , , B、、 , 、 C、、、、 D、、、、8. 下列物质进行焰色试验,其火焰为黄色的是( )A、Na2SO4 B、Mg(OH)2 C、KCl D、HNO39. 下列物质互为同素异形体的是( )A、和 B、和 C、和 D、和10. 下列物质能与水反应,且不属于氧化还原反应的是( )A、金属钠 B、氧化钠 C、过氧化钠 D、氢氧化钠11. 合金具有许多优良的性能。下列物质属于合金的是( )A、氧化铜 B、硬铝 C、水银 D、钠12. 下列反应的离子方程式正确的是( )A、铁粉与氯化铁溶液反应: B、用稀盐酸除去铁表面的铁锈: C、用大理石与稀盐酸反应制备二氧化碳: D、稀硫酸与氢氧化钡溶液反应:13. 下列变化需要加入氧化剂才能实现的是( )A、Fe→Fe2+ B、CO2→CO C、N2O5 →HNO3 D、NaClO3 →Cl214. 下列关于钠的叙述中,不正确的是( )A、钠燃烧时发出黄色的火焰 B、常温下钠与氧气反应生成氧化钠 C、钠离子有很强的还原性 D、钠原子的最外层只有1个电子15. 下列物质的保存方法,与其化学性质无关的是( )A、金属钠保存在煤油中 B、浓盐酸需密闭保存 C、新制氯水存放于密闭棕色瓶中 D、过氧化钠需干燥密闭保存16. 下列关于物质用途的说法不合理的是( )A、用于制玻璃 B、用作油漆的红色颜料 C、铝制餐具用于蒸煮酸性食物 D、用作棉、麻、纸张的漂白剂17. 下列物质中,既含有氯分子,又含有氯离子的是( )A、氯化钠溶液 B、新制氯 C、漂白粉 D、液氯18. 下列关于铁及其化合物的叙述正确的是( )A、氢氧化铁受热分解可制得 B、、都有磁性 C、不稳定,在空气里受热,能迅速氧化成 D、高温下,铁能与水蒸气反应生成19. 能证明某溶液中只含而不含的实验及现象是( )A、只需滴加溶液,溶液不显红色 B、先滴加氯水,再滴加溶液后显红色 C、先滴加溶液,溶液呈红色,再加足量铁粉红色消失 D、先滴加KSCN溶液,溶液不显红色,再滴加少量氯水后显红色20. 下列关于碱金属单质的说法不正确的是( )A、都具有还原性 B、都能与水反应产生 C、都具有金属光泽 D、都能与反应生成过氧化物21. 下列有关物质性质的比较,可以用元素周期律加以解释的是( )A、酸性: B、溶解度(25℃): C、沸点: D、热稳定性:22. 已知如下三个实验均能发生化学反应:①
②
③
将铁钉放入硫酸铜溶液中
向硫酸亚铁溶液中滴入几滴氯水
将铜丝放入氯化铁溶液中
下列判断正确的是( )
A、实验①中铁做还原剂 B、实验②中既表现氧化性又表现还原性 C、实验③中发生的是置换反应 D、上述实验证明氧化性:23. 下列“实验结论”与“实验操作及现象”相符的一组是( )选项
实验操作及现象
实验结论
A
向某溶液中加入稀盐酸,有无色气体生成
该溶液中一定含有
B
向紫色石蕊溶液中滴加氯水,溶液先变红,随后褪色
氯水中含有酸性物质和漂白性物
C
向某溶液中加入溶液,有白色沉淀生成
该溶液中一定含有
D
将盐酸滴入磷酸钙中得到
C的非金属性强于P
A、A B、B C、C D、D24. 下列关于F、Cl、Br、I性质的比较,不正确的是( )A、单质的颜色随核电荷数的增加而加深 B、单质的氧化性随核电荷数的增加而减弱 C、它们的氢化物的稳定性随核电荷数的增加而增强 D、它们的原子核外电子层数随核电荷数的增加而增多25. 下列关于化学键的说法中不正确的是( )A、化学键是一种作用力 B、非极性键不是化学键 C、化学键可以使离子相结合,也可以使原子相结合 D、化学反应过程中,反应物分子内的化学键断裂,产物分子中的化学键形成26. 在500mL 溶液中加入足量铝粉,反应完全后,共收集到标准状况下的气体体积为33.6L。该溶液的物质的量浓度为( )A、 B、 C、 D、27. 如图所示,A处通入未经干燥的 , 关闭B阀时,C处的红布条看不到明显现象;当打开B阀后,C处红布条逐渐褪色,则D瓶中盛放的溶液可能是:①饱和NaCl溶液 ②NaOH溶液 ③ ④浓硫酸 A、①② B、①③ C、②④ D、③④28. 下列说法正确的是( )A、溶液中含有 B、标准状况下,的质量是 C、与足量反应时,转移的电子数约为 D、完全中和的盐酸,至少需要的溶液29. 下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )
A、①② B、①③ C、②④ D、③④28. 下列说法正确的是( )A、溶液中含有 B、标准状况下,的质量是 C、与足量反应时,转移的电子数约为 D、完全中和的盐酸,至少需要的溶液29. 下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( ) A、气态氢化物的稳定性: B、X与Y可以形成原子个数比为和的两种化合物 C、Y和W两者最高价氧化物对应的水化物能相互反应 D、由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是30. 加氢转化为燃料是实现减排的一个重要策略。我国科学家在调控加氢反应的选择性方面取得新进展,其过程的示意图如下.下列分析不正确的是( )
A、气态氢化物的稳定性: B、X与Y可以形成原子个数比为和的两种化合物 C、Y和W两者最高价氧化物对应的水化物能相互反应 D、由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是30. 加氢转化为燃料是实现减排的一个重要策略。我国科学家在调控加氢反应的选择性方面取得新进展,其过程的示意图如下.下列分析不正确的是( ) A、该过程中,分子中非极性键发生断裂 B、的电子式为:
A、该过程中,分子中非极性键发生断裂 B、的电子式为: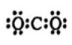 C、该反应中作氧化剂
D、该反应的化学方程式为
C、该反应中作氧化剂
D、该反应的化学方程式为
二、填空题(本题包括3小题,共40分)
-
31. 下表列出了①~⑨九种元素在周期表中的位置。
族
周期
ⅠA
ⅡA
ⅢA IVA VA VIA VIIA 0 1
①
2
②
③
④
3
⑤
⑥
⑦
⑧
⑨
请按要求回答下列问题:
(1)、元素⑦的原子结构示意图:;元素⑤与⑧组成的化合物的电子式:;该化合物中化学键类型为。(2)、元素⑤~⑧中原子半径最大的是(填元素符号)。(3)、元素①~⑨中化学性质最不活泼的是(填元素符号)(4)、元素③的最简单氢化物,分子的空间结构呈形。(5)、元素⑤和⑥的最高价氧化物对应的水化物分别为X和Y,其中属于两性氢氧化物的是(填化学式),X和Y反应的离子方程式:。(6)、元素⑤在元素③构成的常见单质中加热燃烧生成产物M,写出M与二氧化碳反应的化学方程式。32. 请用你学到的化学知识填空。I.某工厂的工业废水中含有大量的和较多的。为了减少污染并变废为宝,工厂计划从该废水中回收和金属铜。请根据以下流程图,回答下列问题。
 (1)、操作I的名称是 , 固体A是(填化学式),固体C是(填化学式)。(2)、为防止溶液氧化变质,应在溶液中加入少量 , 其原因是。(3)、把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中和物质的量浓度恰好相等。则已反应的和未反应的的物质的量之比为。(4)、Ⅱ. 实验室制氯气可用下图装置,并进行氯气性质实验。
(1)、操作I的名称是 , 固体A是(填化学式),固体C是(填化学式)。(2)、为防止溶液氧化变质,应在溶液中加入少量 , 其原因是。(3)、把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中和物质的量浓度恰好相等。则已反应的和未反应的的物质的量之比为。(4)、Ⅱ. 实验室制氯气可用下图装置,并进行氯气性质实验。
写出实验室制备氯气的化学方程式:。
将氯气通入冷的石灰乳中可制备用于环境消毒的漂白粉,写出此反应的化学方程式。
(5)、将氯气通入溶液中可发生置换反应,写出反应的离子方程式;通过单质之间的置换证明氧化性(填“”,“”或“”)。33. 请用你学到的化学知识填空。I.实验空用固体配制的溶液,回答下列问题.
(1)、需要固体g。(2)、配制溶液时,必须用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒、。(3)、用胶头滴管滴加蒸馏水至刻度线时,某同学按照如图所示进行操作,配成的溶液的实际浓度(填“偏大”或“偏小”)。 (4)、II、某小组同学依据性质差异,采用比较的方法设计实验鉴别和 .
(4)、II、某小组同学依据性质差异,采用比较的方法设计实验鉴别和 .实验Ⅰ
实验Ⅱ
实验Ⅲ



实验I中,分别向两支试管中滴加几滴水,A中温度计示数略有降低,B中温度计略开高.说明固体b与水作用的过程中(填“放出”或“吸收”)热量,可判断固体b为。
(5)、实验II中,向试管C和D中分别加入水,充分振荡,试管C中固体有剩余,试管D中固体完全溶解。①判断固体d为(填化学式)。
②分别向两支试管中滴加2滴酚酞,(填“C”或“D”)试管中红色较浅。
③实验Ⅲ中,分别向溶液e和溶液f中逐滴加入稀盐酸,F中开始滴加就可以观察到气泡;E中开始无气泡产生,一段时间后产生气泡。结合离子方程式解释E中开始无气泡产生的原因。