山西省太原市2023-2024学年高一上学期期末学业诊断化学试题
试卷更新日期:2024-03-08 类型:期末考试
一、选择题:本题共20小题,第1~10题每小题2分,第11~20题每小题3分,共50分。在每小题给出的四个选项中,只有一项是符合题目要求的,请将正确选项的序号填入答案栏内。
-
1. 科学家利用粒子加速器在实验室创造出了超重铝 , 下列有关说法错误的是( )A、质子数为13 B、中子数为29 C、最外层电子数为13 D、原子序数为132. 下列材料中所涉及的合金不属于新型合金的是( )A、“深海一号”能源站使用的钢架 B、“蛟龙号”载人舱是用钛合金制造的 C、“飞机涡扇”使用的耐高温合金材料 D、新能源汽车使用的储氢合金3. 适度饮水有益于健康,但过量你水会使体内电解质浓度过低,导致生理紊乱而引起“水中毒”,下列属于人体内常见电解质的是( )A、二氧化碳 B、氯化钠 C、硫酸钡 D、葡萄糖4. 下列物质结构与对应的化学用语表达正确的是( )A、甲烷的结构式: B、氨气的电子式: C、氯化钠的电子式: D、的结构示意图:
 5. 下列物质中,只含有共价键的是( )A、 B、 C、 D、6. 下列有关性质的比较,不能用元素周期律解释的是( )A、碱性: B、热稳定性: C、酸性: D、与水反应的难易:7. 下列化合物不能通过单质直接化合得到的是( )A、 B、 C、 D、8. 下列物质中的硫元素不能表现出氧化性的是( )A、 B、 C、 D、9. 下列各组中的离子,能在溶液中大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、10. 下列反应的离子方程式书写正确的是( )A、金属钾与水反应: B、金属铁与稀盐酸反应: C、氯气与水反应: D、过量与溶液反应:11. 下列关于铝及其化合物的说法错误的是( )A、相比纯铝,铝合金熔点高,硬度大 B、金属铝与溶液反应生成氢气 C、是两性氧化物,是两性氢氧化物 D、铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物12. 雷雨天时空气中有生成。下列说法正确的是( )A、和互为同位素 B、和的相互转化是物理变化 C、等物质的量的和含有相同的质子数 D、在相同的温度和压强下,等体积的和含有相同的分子数13. 以下是某高一同学整理课本上铁及其化合物的有关知识,其中错误的是( )A、高炉炼铁过程中,发生了氧化还原反应 B、是一种红棕色粉末,俗称磁性氧化铁 C、不稳定,在空气中加热迅速被氧化成 D、炽热的铁水或钢水倒入模具之前,模具必须进行充分的干燥14. 下列关于的叙述正确的是( )A、是无色、无臭、有毒的气体 B、与溶液反应生成 C、能使紫色的酸性溶液褪色 D、有毒,不能用作食品添加剂15. 化学与我国科学进步密不可分。下列说法错误的是( )A、我国锂电池出口额明显提升,锂单质在空气中燃烧生成过氧化锂 B、我国首艘氢燃料电池动力示范船首航成功,氢有氕、氘、氚三种核素 C、我国自主研发获得公斤级丰度为99%的钼-100同位素,钼是一种金属元素 D、我国科学家研制出全球首个110 GHz纯硅调制器,硅原子的M层电子数等于416. 2016年IUPAC将第117号元素命名为Ts(中文名“石田”tián),Ts的原子核外最外层电子数是7。下列说法错误的是( )A、Ts是第七周期、第ⅦA族元素 B、形成的氢化物可以表示为 C、Ts的同位素原子具有相同的电子数 D、Ts在同族元素中非金属性最弱17. 下列关于F、Cl、Br、I的比较,错误的是( )A、单质的熔点随核电荷数的增加而升高 B、单质的颜色随核电荷数的增加而加深 C、单质的氧化性随核电荷数的增加而减弱 D、它们的氢化物稳定性随核电荷数的增加而增强18. 下列各组物质相互混合反应,最终有白色沉淀生成的是( )
5. 下列物质中,只含有共价键的是( )A、 B、 C、 D、6. 下列有关性质的比较,不能用元素周期律解释的是( )A、碱性: B、热稳定性: C、酸性: D、与水反应的难易:7. 下列化合物不能通过单质直接化合得到的是( )A、 B、 C、 D、8. 下列物质中的硫元素不能表现出氧化性的是( )A、 B、 C、 D、9. 下列各组中的离子,能在溶液中大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、10. 下列反应的离子方程式书写正确的是( )A、金属钾与水反应: B、金属铁与稀盐酸反应: C、氯气与水反应: D、过量与溶液反应:11. 下列关于铝及其化合物的说法错误的是( )A、相比纯铝,铝合金熔点高,硬度大 B、金属铝与溶液反应生成氢气 C、是两性氧化物,是两性氢氧化物 D、铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物12. 雷雨天时空气中有生成。下列说法正确的是( )A、和互为同位素 B、和的相互转化是物理变化 C、等物质的量的和含有相同的质子数 D、在相同的温度和压强下,等体积的和含有相同的分子数13. 以下是某高一同学整理课本上铁及其化合物的有关知识,其中错误的是( )A、高炉炼铁过程中,发生了氧化还原反应 B、是一种红棕色粉末,俗称磁性氧化铁 C、不稳定,在空气中加热迅速被氧化成 D、炽热的铁水或钢水倒入模具之前,模具必须进行充分的干燥14. 下列关于的叙述正确的是( )A、是无色、无臭、有毒的气体 B、与溶液反应生成 C、能使紫色的酸性溶液褪色 D、有毒,不能用作食品添加剂15. 化学与我国科学进步密不可分。下列说法错误的是( )A、我国锂电池出口额明显提升,锂单质在空气中燃烧生成过氧化锂 B、我国首艘氢燃料电池动力示范船首航成功,氢有氕、氘、氚三种核素 C、我国自主研发获得公斤级丰度为99%的钼-100同位素,钼是一种金属元素 D、我国科学家研制出全球首个110 GHz纯硅调制器,硅原子的M层电子数等于416. 2016年IUPAC将第117号元素命名为Ts(中文名“石田”tián),Ts的原子核外最外层电子数是7。下列说法错误的是( )A、Ts是第七周期、第ⅦA族元素 B、形成的氢化物可以表示为 C、Ts的同位素原子具有相同的电子数 D、Ts在同族元素中非金属性最弱17. 下列关于F、Cl、Br、I的比较,错误的是( )A、单质的熔点随核电荷数的增加而升高 B、单质的颜色随核电荷数的增加而加深 C、单质的氧化性随核电荷数的增加而减弱 D、它们的氢化物稳定性随核电荷数的增加而增强18. 下列各组物质相互混合反应,最终有白色沉淀生成的是( )①金属钠投入到溶液中
②投入到溶液中
③溶液和溶液
④向饱和溶液中通入过量
A、③④ B、①④ C、②③ D、②③④19. 下列除去杂质的方法正确的是( )A、用铁粉除去溶液中含有的少量 B、用新制氯水除去溶液中含有的少量 C、铁粉中混有少量铝粉:加入烧碱溶液充分反应,过滤、洗涤、干燥 D、溶液中混有少量:加入过量氨水充分反应,过滤、洗涤、干燥20. 蔗糖与浓硫酸发生作用的过程如下图所示:
下列关于该过程的分析错误的是( )
A、过程中蔗糖分子发生了化学键的断裂 B、过程②固体体积膨胀,体现了浓硫酸的酸性 C、过程①白色固体变黑,主要体现了浓硫酸的脱水性 D、过程中产生能使品红溶液褪色的气体,体现了浓硫酸的强氧化性二、必做题:本题包括3小题,共40分。
-
21. 作为元素周期律表现形式的元素周期表,反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。下表是元素周期表中的一部分,请参照以下六种元素(每种字母分别代表一种元素)在表中的位置,回答下列问题:
族
周期
ⅠA
0
1
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
X
Y
Z
3
M
N
W
回答下列问题:
(1)、M的原子结构示意图为。(2)、M与Z可形成一种离子化合物 , 其电子式为。(3)、原子半径:XZ(填“大于”或“小于”,下同);简单氢化物的稳定性:ZN。(4)、X、Y的最高价氧化物对应水化物的酸性:(填化学式)。(5)、由M和Z组成的一种化合物可用作核潜艇中氧气的来源,该化合物的名称是 , 其中含有的化学键类型是、。22. 为了探究同周期、同主族元素性质的递变规律,某小组同学设计并实施了如下实验,并在此基础上进行推测。(1)、①同学甲取一小段镁条,用砂纸打磨后,放到试管中,再加入2 mL水,滴入2滴酚酞溶液,加热试管,可以观察到的现象是。对比金属钠与水的反应,该同学由此得出实验结论为金属性:Na(填“大于”或“小于”)Mg。②向两支试管分别加入溶液和溶液,然后滴加氨水,直到不再产生白色沉淀为止。再分别将沉淀取出,分别装在两支试管中滴加2 mol/L NaOH溶液,边滴边振荡,观察到的现象是 , 观察到的现象是 , 写出该现象中发生反应的离子方程式:。
(2)、①同学乙在点滴板的3个孔穴中分别滴入3滴NaBr溶液、NaI溶液和水,然后向NaBr溶液和NaI溶液各滴入3滴新制的氯水(如图所示),能说明非金属性Cl大于Br的实验现象是。
②写出少量新制氯水与NaI溶液反应的离子方程式:。
③以上实验(填“能”或“不能”)证明氧化性:。
(3)、二硫化硒洗剂具有抗皮脂溢出作用,还具有一定的抗真菌作用。已知元素硒(Se)位于周期表第四周期,且与氧、硫位于同一主族。同学丙根据单质S在空气中燃烧生成 , 推测单质Se在空气中燃烧可生成。(填化学式)(4)、碳酸铯常温常压下为白色固体,极易溶于水,在空气中放置迅速吸湿,水溶液呈强碱性。已知元素铯(Cs)位于周期表中第六周期、第ⅠA族,碳酸铯的化学式是。23. 已知部分中学常见物质间的转化关系如图所示。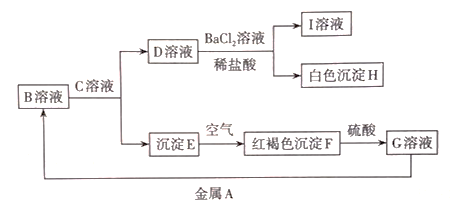
回答下列问题:
(1)、写出E转化为F的化学方程式:。(2)、若C溶液是NaOH溶液,检验其所含金属阳离子的方法是(填名称):检验G溶液中金属阳离子的方法和现象是。(3)、根据以下反应类型的要求,写出由单质铁与盐溶液获得的反应的离子方程式:①置换反应:。
②化合反应:。
(4)、若金属A是铜片,则G转化为B的反应离子方程式为。写出A与浓硫酸反应的化学方程式:。
(5)、某工厂使用的煤中硫的质量分数为0.64%,该工厂每天燃烧这种媒100 t,如果煤中的硫全部转化为 , 把产生的全部用来生产硫酸,试计算理论上每天可得到硫酸的质量是t。三、选做题:本题包括A、B两组题,共10分。其中A组题目较简单。请任选组做答,如两组都做,按A组题计分。
-
24. 碳酸亚铁()是生产补血剂的一种原料,实验室以铁屑为原料制备的流程如下:

回答下列问题:
(1)、用电离方程式表示在水中的变化:。(2)、“气体1”是(填化学式);若“溶解”时生成的“气体1”在标准状况下的体积为2.24 L,则参加反应的铁的质量为g。(3)、实验室配制100 mL 2mol/L 溶液。①需要18 mol/L浓的体积为mL(计算结果保留两位有效数字)。
②下列仪器中,需要的有(填标号),还缺少的玻璃仪器为(填仪器名称)。
 25. 某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其他铁的化合物。某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究:
25. 某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其他铁的化合物。某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究: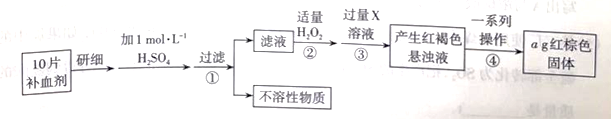
请回答下列问题:
(1)、用的浓硫酸配制100 mL 的硫酸溶液.所需浓硫酸的体积为mL(计算结果保留一位小数)。(2)、下列操作中,容量瓶所具备的功能有____(填字母)。A、配制一定体积准确浓度的标准溶液 B、长期贮存溶液 C、用来溶解固体溶质 D、常用来代替量筒量取一定体积的液体(3)、在下列配制过程示意图中,有错误的是(填字母)。 (4)、下列说法正确的____。A、洗涤烧杯2~3次,并将洗涤液移入容量瓶以减少误差 B、某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低 C、定容时仰视观察,所配溶液浓度会偏低 D、容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可(5)、验证步骤②反应后的溶液中是否含有的实验操作为(可选择的试剂有氯水、KSCN溶液、NaOH溶液、酸性溶液)。(6)、步骤②加入适量发生反应的离子方程式为。(7)、经一系列操作后,所获得固体的质量为 , 则每片补血剂中含硫酸亚铁的质量为g。
(4)、下列说法正确的____。A、洗涤烧杯2~3次,并将洗涤液移入容量瓶以减少误差 B、某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低 C、定容时仰视观察,所配溶液浓度会偏低 D、容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可(5)、验证步骤②反应后的溶液中是否含有的实验操作为(可选择的试剂有氯水、KSCN溶液、NaOH溶液、酸性溶液)。(6)、步骤②加入适量发生反应的离子方程式为。(7)、经一系列操作后,所获得固体的质量为 , 则每片补血剂中含硫酸亚铁的质量为g。