辽宁省县级重点高中协作体2023-2024学年高二上学期末考试化学试题
试卷更新日期:2024-03-08 类型:期末考试
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 化学与生活密切相关,下列说法错误的是( )A、节日燃放的烟花与电子的跃迁有关 B、用纯碱作洗涤剂利用了盐类水解原理 C、电解质水饮料中含有水、氯化钠、葡萄糖等多种电解质 D、两种不同金属材质的电线相接易发生腐蚀2. 2023年4月12日21时,中国有“人造太阳”之称的全超导托卡马克核聚变实验装置(EAST)创造了新的世界纪录,成功实现稳态高约束模式等离子体运行403秒,对提升核聚变能源经济性、可行性,加快实现聚变发电具有重要意义。其原理为 , 下列有关说法正确的是( )A、聚变发电有利于减少碳排放量 B、核聚变为放热反应 C、聚变发电,可使核能全部转化成电能 D、、互为同素异形体3. 下列有关说法正确的是( )A、同一能层内的电子运动区域一定相同 B、的酸性强于 C、VSEPR模型相同的分子,空间结构也相同 D、水结冰后密度变小说明共价键具有方向性4. 下列基态原子的核外电子在原子轨道上的能量大小关系错误的是( )A、 B、 C、 D、5. 现有三种元素的基态原子的电子排布式如下:①;②;③。则下列说法中错误的是( )A、①③为金属元素 B、原子半径:③>①>② C、最高正化合价:①-②=③ D、第一电离能:②>①>③6. 下列有关晶体的说法正确的是( )A、含有共价键的晶体一定是共价晶体 B、含有离子键的晶体一定是离子晶体 C、所有晶体均含有化学键 D、含有金属元素的晶体一定是金属晶体7. 下列方法能使氨水中的电离平衡正向移动且的浓度也增大的是( )A、通入气体 B、加入固体 C、加入NaOH固体 D、适当降低温度8. 下列有关以0.1 mol·L NaOH标准液滴定未知浓度的HCl溶液的操作正确的是( )
A.量取25.00 mL待测液
B.除去碱式滴定管中的气泡
C.滴定时,眼睛注视锥形瓶内溶液颜色的变化
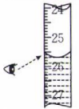
D.滴定结束时读数
A、A B、B C、C D、D9. 电催化还原的某种催化剂的结构如图,下列说法错误的是( )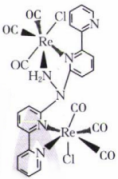 A、Re的配位数为6 B、结构中N的杂化方式均相同 C、Rc提供空轨道 D、CO中C的电负性小,易于提供配位电子对10. 常温下,下列离子组在指定溶液中能大量共存的是( )A、使酚酞变红的溶液中:、、、 B、1 mol⋅L 溶液中:、、、 C、加入石蕊呈红色的溶液中:、、、 D、的溶液中:、、、11. 如图所示,A、B、C、D、E、F均为石墨电极,甲池与乙池中溶液的体积均为0.2 L,浓度均为1 mol⋅L , 按图示接通电路,反应一段时间后,检测到电路中通过0.02 mol , 烧杯a中溶液变蓝。下列说法正确的是( )
A、Re的配位数为6 B、结构中N的杂化方式均相同 C、Rc提供空轨道 D、CO中C的电负性小,易于提供配位电子对10. 常温下,下列离子组在指定溶液中能大量共存的是( )A、使酚酞变红的溶液中:、、、 B、1 mol⋅L 溶液中:、、、 C、加入石蕊呈红色的溶液中:、、、 D、的溶液中:、、、11. 如图所示,A、B、C、D、E、F均为石墨电极,甲池与乙池中溶液的体积均为0.2 L,浓度均为1 mol⋅L , 按图示接通电路,反应一段时间后,检测到电路中通过0.02 mol , 烧杯a中溶液变蓝。下列说法正确的是( )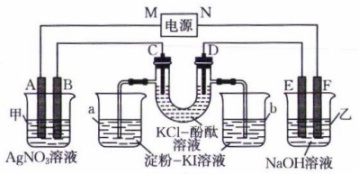 A、M为电源负极 B、C极与E极产生的气体质量差为0.55 g C、烧杯b中溶液颜色变为浅红色 D、忽略体积变化,甲池中溶液的12. 超分子因其特殊结构在某些方面有着重要应用。超分子化学已成为今后化学发展的另一个全新的领域。月桂酰丙氨酸形成超分子结构的过程如图。下列说法错误的是( )
A、M为电源负极 B、C极与E极产生的气体质量差为0.55 g C、烧杯b中溶液颜色变为浅红色 D、忽略体积变化,甲池中溶液的12. 超分子因其特殊结构在某些方面有着重要应用。超分子化学已成为今后化学发展的另一个全新的领域。月桂酰丙氨酸形成超分子结构的过程如图。下列说法错误的是( )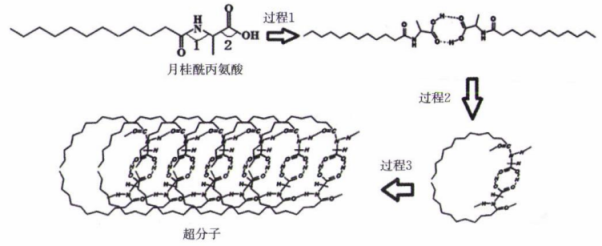 A、该超分子中含有的化学键有极性键、非极性键、氢键 B、月桂酰丙氨酸中键角: C、以上三个过程表现了超分子的自组装特征 D、超分子中形成的空腔能识别某些分子或离子13. 肼()是一种强还原剂,在碱性溶液中能将银、镍等金属离子还原成金属单质,因此可用于镜面镀银,原理为。下列说法正确的是( )A、Ag为d区元素 B、肼分子中心原子的VSEPR模型为四面体形 C、肼分子结构对称,为非极性分子 D、肼与氨气的组成元素相同,性质也完全相同14. 某化合物的晶胞结构示意图如图,晶胞参数为a nm,设为阿伏加德罗常数的值,以晶胞参数建立坐标系,1号原子的坐标为 , 3号原子的坐标为。下列说法错误的是( )
A、该超分子中含有的化学键有极性键、非极性键、氢键 B、月桂酰丙氨酸中键角: C、以上三个过程表现了超分子的自组装特征 D、超分子中形成的空腔能识别某些分子或离子13. 肼()是一种强还原剂,在碱性溶液中能将银、镍等金属离子还原成金属单质,因此可用于镜面镀银,原理为。下列说法正确的是( )A、Ag为d区元素 B、肼分子中心原子的VSEPR模型为四面体形 C、肼分子结构对称,为非极性分子 D、肼与氨气的组成元素相同,性质也完全相同14. 某化合物的晶胞结构示意图如图,晶胞参数为a nm,设为阿伏加德罗常数的值,以晶胞参数建立坐标系,1号原子的坐标为 , 3号原子的坐标为。下列说法错误的是( )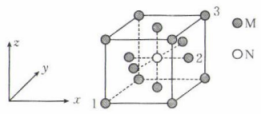 A、晶体中M、N的个数比为4∶1 B、2号原子的坐标为 C、M、N之间的最短距离为nm D、位于面心的M围成正八面体15. 常温下,向100 mL 0.1 mol·L三元酸溶液中滴加0.1 mol⋅L的NaOH溶液,溶液中含A微粒的物质的量分数(δ)随溶液pH的变化如图所示,下列说法正确的是( )
A、晶体中M、N的个数比为4∶1 B、2号原子的坐标为 C、M、N之间的最短距离为nm D、位于面心的M围成正八面体15. 常温下,向100 mL 0.1 mol·L三元酸溶液中滴加0.1 mol⋅L的NaOH溶液,溶液中含A微粒的物质的量分数(δ)随溶液pH的变化如图所示,下列说法正确的是( )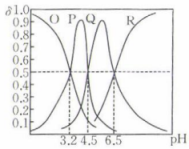 A、P为HA的物质的量分数与溶液pH的关系曲线 B、该三元酸的第一步电离是完全的 C、当加入100 mL NaOH溶液时,溶液显酸性 D、常温下,的水解常数
A、P为HA的物质的量分数与溶液pH的关系曲线 B、该三元酸的第一步电离是完全的 C、当加入100 mL NaOH溶液时,溶液显酸性 D、常温下,的水解常数二、非选择题:本题共4小题,共55分。
-
16. 某农药由原子序数依次增大的V、W、X、Y、Z五种前四周期元素组成。请根据下列相关信息,回答问题。
元素
相关信息
V
核外电子数与周期序数相等
W
成对电子数与未成对电子数之比为3∶1
X
在火山口附近可发现其淡黄色固体单质
Y
有四个电子层,且最外层电子数与最内层电子数相等
Z
基态Z元素原子的价层电子排布式为
(1)、Y元素在周期表中的位置为第周期第族;基态Z元素原子的最外层电子所占据的原子轨道的电子云轮廓图为形。(2)、V、W、X三种元素的电负性由大到小的顺序是(用元素符号表示);W、X的最简单氢化物的熔、沸点由大到小的顺序是(用化学式表示),原因为。(3)、Y、Z两种元素的最高价氧化物对应的水化物的酸性或碱性最强的是(填化学式)。(4)、W、X可组成空间结构为平面三角形的分子,该分子的化学式为。分子中的大π键可用符号表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为),则该平面三角形分子中的大π键应表示为 .17. 某化学兴趣小组用如图装置探究反应的进行程度。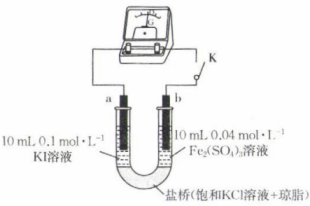
已知:①a、b均为石墨电极;②实验中使用的电流计有电流通过时,指针偏向正极;③空气不影响该实验。
(1)、闭合开关,电流计指针偏向右边,此时电极a为极,电极b的电极反应式为 .(2)、一段时间后,电流计指针回到原点。断开开关,取1 mL a极附近溶液于试管中,加入淀粉溶液,观察到混合溶液颜色变为色;取1 mL b极附近溶液于试管中,滴加几滴溶液,可以观察到。(3)、往U形管右侧溶液中加入0.5 g 粉末,充分溶解后,重新闭合开关,观察到指针偏向左边。闭合开关后,a极的电极反应式为;检验b极附近溶液中是否含有 , 可以选用的试剂是(填化学式)溶液。(4)、结合以上实验现象可知硫酸铁溶液和碘化钾溶液反应的化学方程式为;实验装置盐桥中的电解质溶液不选用饱和溶液的原因可能是 .18. 硫酸锌是制造锌钡白和锌盐的主要原料,口服硫酸锌可纠正锌缺乏,恢复酶系统的功能。用锌白矿(主要成分为ZnO,还含有、、等杂质)制备的流程如图: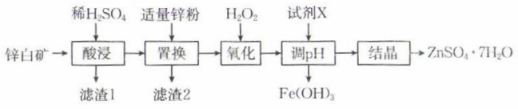
常温下,相关金属离子形成氢氧化物沉淀的pH如表所示(离子浓度小于mol⋅L时视为沉淀完全):
金属离子
开始沉淀的pH
沉淀完全的pH
1.1
3.1
7.6
9.6
6.4
8.0
(1)、基态锌离子的价层电子轨道表示式为。(2)、“酸浸”前通常需要将锌白矿粉碎,其目的是。(3)、滤渣1的主要成分为(填化学式)。(4)、加入“氧化”时发生反应的离子方程式为。(5)、加入试剂X调节溶液的pH在 , 使铁元素转化为沉淀而除去,试剂X可以选用下列中的(填标号)。A.ZnO B. C.
根据题中数据计算常温下的溶度积 .
(6)、pH过大时,锌元素会以形式存在,则中存在的作用力为____(填标号)。A、离子键 B、共价键 C、σ键 D、π键19. C、Si、Ge、Sn是同族元素,该族元素的单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:(1)、C、Si、Ge、Sn的第一电离能从大到小的顺序是(用元素符号表示);在基态Ge原子中,电子占据的最高能层的符号为 , 该能层中有种不同运动状态的电子。(2)、有晶体和非晶体两种,可通过方法鉴别二者。(3)、C、Si、Ge、Sn均能与卤素化合,已知常温下为无色液体,遇水有白雾出现,发烟,则属于(填“共价”“分子”或“离子”)晶体;遇水有白雾出现的化学方程式为 .(4)、是一种优秀的透明导电材料,其晶胞结构如图所示。晶胞参数分别为a pm、apm、c pm,晶胞中立方体的边长为a pm,阿伏加德罗常数的值为。
①白球表示的是(填元素符号)。
②晶体的密度为g⋅cm。