辽宁省县级重点高中协作体2023-2024学年高一上学期期末考试化学试题
试卷更新日期:2024-03-08 类型:期末考试
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 科学技术是第一生产力。下列说法正确的是( )A、谷神星一号遥八运载火箭固体燃料燃烧时发生了氧化反应 B、钛合金力学超材料与该合金中的单一金属相比,熔点更高、密度更大 C、嫦娥五号月壤中发现撞击成因的磁铁矿,磁铁矿的主要成分为Fe2O3 D、新一代“人造太阳”原料中的2H与3H互为同素异形体
-
2. 在化学反应中,若氧化反应和还原反应发生在同一物质的同一元素上,则这种自身的氧化还原反应被称为岐化反应。下列反应属于岐化反应的是( )A、 B、 C、 D、
-
3. 下列化学用语表示正确的是( )A、CH4分子结构模型:
 B、NH4Cl的电子式:
B、NH4Cl的电子式: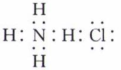 C、H2O2的结构式:H-O-O-H
D、中子数为46的硒原子:
C、H2O2的结构式:H-O-O-H
D、中子数为46的硒原子:
-
4. 下列物质属于电解质且为共价化合物的是( )A、 B、 C、 D、
-
5. 常温下,下列离子组在指定溶液中能大量共存的是( )A、遇酚䣭变红的溶液中: B、加入铝粉产生氢气的溶液中: C、的溶液中: D、的溶液中:、、、
-
6. 设为阿伏加德罗常数的值。下列说法正确的是( )A、将的盐酸稀释10倍后所得溶液中的数目为 B、常温常压下,中含有的共价键的数目为 C、中含有的共价键数为 D、与足量的铁反应转移的电子数为
-
7. 直径为几十纳米的纳米金颗粒具有高电子密度和介电特性,它的一种制备方法是氯金酸与硼氢化钠(化学式为显+3价)反应:。下列有关说法错误的是( )A、纳米金分散在空气中形成的分散系属于胶体 B、硼氢化钠为还原剂 C、氧化产物为和 D、每生成 , 转移电子
-
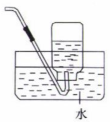
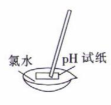
8. 下列实验操作和装置能达到相应实验目的的是( )
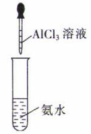
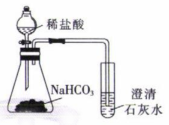
A.制备Al(OH)3
B.收集氯气
C.准确测量氯水的pH
D.比较C和Cl的非金属性
A、A B、B C、C D、D -
9. 部分含铁物质的分类与相应化合价的关系如图所示。下列说法错误的是( )
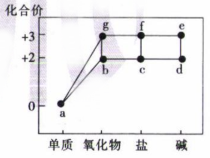 A、b、g均是碱性氧化物化合价 B、d→e→f→c可以实现一步转化 C、纯净的d为白色固体 D、c溶液常用于刻蚀印刷电路板的铜箔
A、b、g均是碱性氧化物化合价 B、d→e→f→c可以实现一步转化 C、纯净的d为白色固体 D、c溶液常用于刻蚀印刷电路板的铜箔 -
10. 铯(Cs)是制造真空器件、光电管、原子钟等的重要材料,金属铯的密度为 , 熔点为。下列说法正确的是( )A、的原子序数为87 B、碱性: C、铯与水反应时,铯浮在水面上,反应剧烈,发生爆炸 D、铯的熔点大于钠
-
11. 下列离子方程式书写正确的是( )A、氧化铁与稀硫酸反应: B、铝与烧碱溶液反应: C、足量的氯气通入溶液中: D、纯碱溶液中滴加几滴稀盐酸:
-
12. 以下实验设计能达到实验目的的是( )
选项
实验目的
实验设计
A
除去0.1mol·L-1NaHCO3溶液中的Na2CO3
向溶液中通入足量CO2
B
检验Fe2+
取适量待测液,先加入适量氯水,后加入适量KSCN溶液,观察溶液是否变红
C
除去二氧化碳中的HCl气体
将混合气体通过足量的碱石灰
D
鉴别NaCl和NaOH固体
灼烧,观察火焰颜色
A、A B、B C、C D、D -
13. X、Y、Z、W是原子序数依次增大的短周期主族元素,可以构成某复合型高分子聚合物M{[Z2(YX)a(WY4)b]m},M分子结构庞大,吸附能力强。X形成的单质是相同条件下密度最小的气体,Y与W同主族,Y的L层电子数为K层电子数的三倍,Z是地壳中含量最多的金属元素。下列说法正确的是( )A、原子半径大小关系:W>Z>Y B、Z的最高价氧化物为两性氧化物 C、M在水中能形成胶体,具有净水、杀菌、消毒的功能 D、M化学式中存在a+b=6
-
14. 溴是国民经济生产所需的重要基础原料。某化学兴趣小组用模拟海水(含有Na+、Mg2+、Cl-、Br-和H2O)提溴的流程如图所示,已知SO2能与溴水发生反应:。下列说法错误的是( )
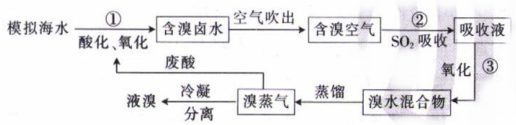 A、反应①②③中均有电子的转移 B、空气吹出时利用了溴易挥发的性质 C、反应①中的氧化剂可以选择碘水 D、若反应①③中的氧化剂均为氯气,最终要获得80gBr2 , 理论上至少需要消耗71gCl2
A、反应①②③中均有电子的转移 B、空气吹出时利用了溴易挥发的性质 C、反应①中的氧化剂可以选择碘水 D、若反应①③中的氧化剂均为氯气,最终要获得80gBr2 , 理论上至少需要消耗71gCl2 -
15. 通过分析热重曲线(样品质量随温度变化的曲线),我们可以知道样品及其可能产生的中间产物等与质量的关系。Mg(NO3)2·6H2O受热会先失去结晶水,然后再发生其他的分解反应,所得到的热重曲线如图所示。下列说法错误的是( )
 A、68~170℃时,Mg(NO3)2·6H2O失去部分结晶水 B、389℃时,所得固体为Mg(NO3)2 C、Mg(NO3)2·6H2O的摩尔质量为256g·mol-1 D、550℃时,所得固体为Mg(NO2)2
A、68~170℃时,Mg(NO3)2·6H2O失去部分结晶水 B、389℃时,所得固体为Mg(NO3)2 C、Mg(NO3)2·6H2O的摩尔质量为256g·mol-1 D、550℃时,所得固体为Mg(NO2)2
二、非选择题:本题共4小题,共55分。
-
16. 下表列出了①~⑨九种元素在元素周期表中的位置:
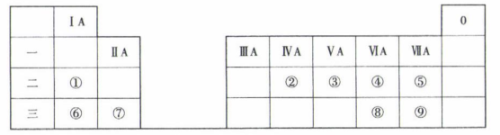
请按要求回答下列问题:
(1)、④与⑤相比较,非金属性更强的是(填元素符号):表中九种元素中,M层电子数与K层电子数相等的是(填元素符号)。(2)、⑤与⑨的简单气态氢化物中热稳定性较强的是(填化学式):②⑧⑨的最高价氧化物对应的水化物中酸性最强的是(填化学式)。(3)、①④⑥三种元素对应的简单离子中,离子半径最大的是(填离子符号);用电子式表示⑧的最简单氢化物的形成过程:。(4)、④和⑥形成的一种化合物常用作供氧剂,该物质与CO2反应的化学方程式为。 -
17. 硫酸锰(MnSO4)是常见的锰盐,常用作微量分析试剂、媒染剂和油漆干燥剂。工业上用软锰矿石制备硫酸锰的流程如图所示。
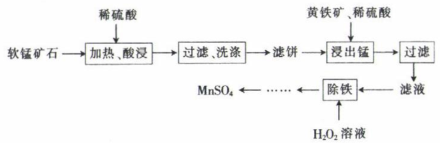
已知:①软锰矿石的主要成分为MnO2 , 杂质主要为Mg、Ca、Fe的氧化物,MnO2与稀硫酸不反应;
②黄铁矿的主要成分为FeS2;
③CaSO4微溶于水。
回答下列问题:
(1)、S原子的结构示意图为;“加热、酸浸”时为了提高浸取速率,可以采取的措施有(填一种):滤饼的主要成分为。(2)、“加热、酸浸”时不宜使用浓盐酸,原因之一是会产生一种污染性气体,生成该气体反应的化学方程式为。(3)、加入黄铁矿和稀硫酸“浸出锰”时,会发生反应:(未配平)。该反应的氧化剂和还原剂的物质的量之比为。(4)、“浸出锰”之后“过滤”,滤液中含有Fe3+和Fe2+ , 加入H2O2溶液将Fe2+氧化为Fe3+ , 反应的离子方程式为 , 该过程的温度不宜过高,可能的原因是。 -
18. 甲、乙两同学分别取A、B两份等物质的量浓度的NaOH溶液各10mL,分别向A、B溶液中通入不等量的CO2 , 充分反应后再继续向两溶液中逐滴加入0.5mol·L-1盐酸,产生气体的物质的量与所加盐酸的体积的关系如图所示,请回答下列问题:
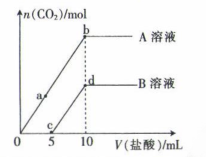 (1)、Na2CO3属于(填“离子”或“共价”)化合物:CO2的结构式为。(2)、a点对应的溶液中溶质为(填化学式)。(3)、ab段反应的离子方程式为;忽略溶液混合造成的体积变化,b点NaCl的物质的量浓度为mol·L-1;d点生成的CO2的总体积为mL(换算成标准状况)。(4)、原NaOH溶液的物质的量浓度为mol·L-1。
(1)、Na2CO3属于(填“离子”或“共价”)化合物:CO2的结构式为。(2)、a点对应的溶液中溶质为(填化学式)。(3)、ab段反应的离子方程式为;忽略溶液混合造成的体积变化,b点NaCl的物质的量浓度为mol·L-1;d点生成的CO2的总体积为mL(换算成标准状况)。(4)、原NaOH溶液的物质的量浓度为mol·L-1。 -
19. 某实验小组配制100mL0.1mol·L-1的KMnO4溶液并探究其与Na的反应。(1)、I.配制100mL0.1mol·L-1的KMnO4溶液需要用托盘天平称量gKMnO4 , 实验中需要用到的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管、。(2)、下列操作会导致配制的溶液的物质的量浓度偏大的是(填标号)。
a.砝码生锈
b.溶解时有液体溅出
c.定容时俯视刻度线
d.摇匀后发现液面低于刻度线,继续加水至刻度线
(3)、II.取适量0.1mol·L-1的KMnO4溶液于烧杯中,加入一颗绿豆大小的钠,剧烈反应,溶液逐渐变为浅绿色。实验室中,钠单质保存在煤油中以隔绝空气和水,钠与水反应的化学方程式为。
(4)、关于钠与盐溶液反应的过程,通常认为是钠先与水反应生成氢氧化钠,氢氧化钠再与溶液中的盐发生反应。对于钠与KMnO4溶液反应后溶液变为浅绿色的原因,同学们提出了如下两种猜想:猜想1:生成的H2使KMnO4溶液变为浅绿色。
猜想2:生成的NaOH使KMnO4溶液变为浅绿色。
甲同学设计如图装置进行实验。
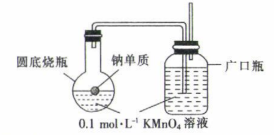
①实验过程中观察到圆底烧瓶内溶液变为浅绿色,广口瓶内溶液颜色 , 证明猜想1错误。
②乙同学认为甲同学的方案不严谨,理由是随着反应进行,圆底烧瓶内的温度会升高,干扰实验。为了排除温度对实验的干扰,可以进行的改进措施有。
③丙同学取适量0.1mol·L-1的KMnO4溶液于试管中,滴加NaOH溶液,发现溶液变为浅绿色(浅绿色为溶液中的颜色)并有气泡产生,证明猜想2正确,该反应的离子方程式为。
