广东省深圳市2024年高考第一次调研考试化学试卷
试卷更新日期:2024-03-07 类型:高考模拟
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 传承中华瑰宝,发扬戏曲文化。下列戏曲表演用品主要由无机非金属材料制成的是( )




A.商周傩戏使用的青铜面具
B.战国礼乐使用的青瓷甬钟
C.宋元杂剧使用的缂丝团扇
D.清皮影戏使用的牛皮人偶
A、A B、B C、C D、D2. 2023年,我国科技事业收获丰硕成果。下列与科技成就相关的描述正确的是( )A、打造北斗卫星系统——与星载铷钟所用的物理性质不同 B、实施海底封存——液化时,其共价键被破坏 C、开启航运氢能时代——氢氧燃料电池工作时可将热能转化为电能 D、突破量子通信技术——作为传输介质的光纤,其主要成分为晶体硅3. 走进美丽广东,体会文化魅力。下列有关说法不正确的是( )A、粤绣所用“金银线”中含有的醋酸纤维素,属于有机高分子材料 B、加热牛奶和蛋清混合物制作双皮奶,该过程涉及蛋白质的变性 C、岭南古建筑采用青砖黛瓦风格,青砖中青色来自氧化铁 D、航海船舶的外壳安装锌块,利用了牺牲阳极法的防腐原理4. 利用如图所示装置实现的制备、检验及氨水的制备。下列相关说法不正确的是( )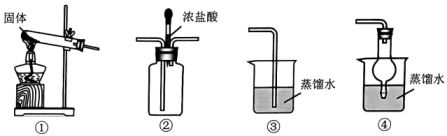 A、①中固体为 B、将制得的通入②中,滴入浓盐酸后,②中产生大量白烟 C、为得到氨水,应选择④作为氨气的吸收装置 D、向溶液中滴加氨水至过量,可生成5. 丰富多彩的校本课程为学生提供了劳动实践的机会。课程中所涉及的劳动实践与化学知识没有关联的是( )
A、①中固体为 B、将制得的通入②中,滴入浓盐酸后,②中产生大量白烟 C、为得到氨水,应选择④作为氨气的吸收装置 D、向溶液中滴加氨水至过量,可生成5. 丰富多彩的校本课程为学生提供了劳动实践的机会。课程中所涉及的劳动实践与化学知识没有关联的是( )选项
劳动实践
化学知识
A
烘焙糕点:加入小苏打做膨松剂
固体溶于水吸热
B
酿葡萄酒:向葡萄汁中添加适量的
具有杀菌和抗氧化作用
C
种植瓜果:施肥时,将碳酸氢铵埋入土壤中
受热易分解
D
自制肥皂:向植物油中加入NaOH溶液
油脂在碱性条件下水解
A、A B、B C、C D、D6. 利用“氧氯化法”以乙烯为原料制备氯乙烯过程中的物质转化关系如图所示。下列说法不正确的是( )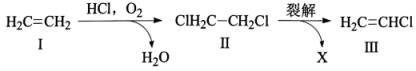 A、化合物Ⅰ分子中所有原子共平面 B、化合物Ⅱ与NaOH的乙醇溶液反应可得到化合物Ⅰ C、裂解时,另一产物X为HCl D、化合物Ⅲ发生加聚反应的产物为
A、化合物Ⅰ分子中所有原子共平面 B、化合物Ⅱ与NaOH的乙醇溶液反应可得到化合物Ⅰ C、裂解时,另一产物X为HCl D、化合物Ⅲ发生加聚反应的产物为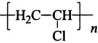 7. 我国科学家设计了水/有机混合高能锂硫电池,其工作原理如图所示。下列说法正确的是( )
7. 我国科学家设计了水/有机混合高能锂硫电池,其工作原理如图所示。下列说法正确的是( )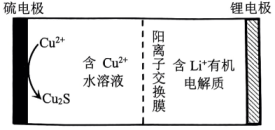 A、硫电极为负极 B、通过阳离子交换膜向锂电极方向迁移 C、硫电极上发生的反应为 D、理论上,每消耗1molS,同时消耗2molLi8. 化学处处呈现美。下列说法不正确的是( )A、金刚石中的碳原子采取杂化轨道形成空间网状结构 B、溶液与溶液反应生成蓝色沉淀 C、缺角的NaCl晶体在饱和NaCl溶液中变为完美立方体块,体现晶体的自范性 D、绚烂烟花的产生是电子由基态跃迁到激发态时,能量以光的形式释放引起的9. 按图所示装置(部分夹持装置略)检验浓硫酸与木炭反应的产物。下列说法正确的是( )
A、硫电极为负极 B、通过阳离子交换膜向锂电极方向迁移 C、硫电极上发生的反应为 D、理论上,每消耗1molS,同时消耗2molLi8. 化学处处呈现美。下列说法不正确的是( )A、金刚石中的碳原子采取杂化轨道形成空间网状结构 B、溶液与溶液反应生成蓝色沉淀 C、缺角的NaCl晶体在饱和NaCl溶液中变为完美立方体块,体现晶体的自范性 D、绚烂烟花的产生是电子由基态跃迁到激发态时,能量以光的形式释放引起的9. 按图所示装置(部分夹持装置略)检验浓硫酸与木炭反应的产物。下列说法正确的是( )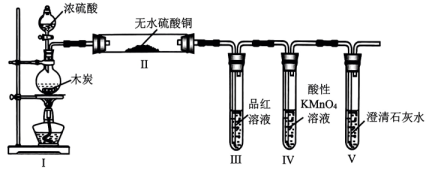 A、Ⅰ中烧瓶内的反应体现了浓硫酸的酸性和强氧化性 B、Ⅱ中无水硫酸铜可替换为无水 C、Ⅲ中溶液褪色,证明产物中有 D、Ⅳ中溶液褪色且Ⅴ中产生沉淀,证明产物中一定有10. 下列陈述Ⅰ与陈述Ⅱ均正确,且有关联的是( )
A、Ⅰ中烧瓶内的反应体现了浓硫酸的酸性和强氧化性 B、Ⅱ中无水硫酸铜可替换为无水 C、Ⅲ中溶液褪色,证明产物中有 D、Ⅳ中溶液褪色且Ⅴ中产生沉淀,证明产物中一定有10. 下列陈述Ⅰ与陈述Ⅱ均正确,且有关联的是( )选项
陈述Ⅰ
陈述Ⅱ
A
可通过石油分馏获得汽油
石油分馏属于化学变化
B
可用pH试纸测量新制氯水的pH
新制氯水中含有
C
明矾可用于自来水消毒
水解生成的胶体具有吸附性
D
加适量石膏可降低盐碱地(含较多的)土壤的碱性
可与反应生成更难溶的
A、A B、B C、C D、D11. 利用下图所示装置进行实验,先向W形管中通入 , 一段时间后,再用注射器向其中加入浓盐酸,当充满整个W形管后点燃酒精灯。下列说法正确的是( )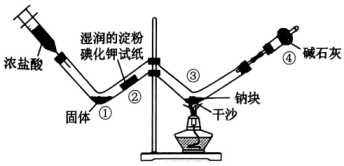 A、①处固体为 B、②处试纸变蓝,说明具有氧化性 C、③处可观察到钠块剧烈燃烧,且产生大量白雾 D、④处碱石灰的主要作用是防止空气中的、水蒸气与钠反应12. 元素及其化合物性质丰富。下列相关反应的化学方程式或离子方程式书写正确的是( )A、将置于水中: B、将通入石灰乳中: C、水蒸气通过灼热铁粉: D、氨的催化氧化:13. 光催化氧化甲烷制甲醛的机理如图所示。设为阿伏加德罗常数的值。下列说法不正确的是( )
A、①处固体为 B、②处试纸变蓝,说明具有氧化性 C、③处可观察到钠块剧烈燃烧,且产生大量白雾 D、④处碱石灰的主要作用是防止空气中的、水蒸气与钠反应12. 元素及其化合物性质丰富。下列相关反应的化学方程式或离子方程式书写正确的是( )A、将置于水中: B、将通入石灰乳中: C、水蒸气通过灼热铁粉: D、氨的催化氧化:13. 光催化氧化甲烷制甲醛的机理如图所示。设为阿伏加德罗常数的值。下列说法不正确的是( )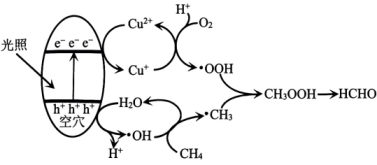 A、在光催化剂表面会发生反应 B、为中间产物 C、上述过程中有非极性键的断裂与生成 D、每生成30gHCHO,总反应转移电子数目为14. W、X、Y、Z是原子序数依次增大的主族元素,在前三周期均有分布。基态X原子有四种不同空间运动状态的电子;Y为地壳中含量最多的元素,其简单离子与Z的简单离子具有相同电子数;工业上常通过电解Z的氧化物制取其单质。下列说法不正确的是( )A、元素电负性:Y>X>Z B、简单氢化物的沸点:Y>X C、原子半径:X>Y>W D、与Z同周期且第一电离能小于Z的元素有2种15. 我国科学家研发了一种由废水(含、等)提铀并同步产电的工艺,其工作原理和相关物质转化关系如图所示。下列有关该过程的说法不正确的是( )
A、在光催化剂表面会发生反应 B、为中间产物 C、上述过程中有非极性键的断裂与生成 D、每生成30gHCHO,总反应转移电子数目为14. W、X、Y、Z是原子序数依次增大的主族元素,在前三周期均有分布。基态X原子有四种不同空间运动状态的电子;Y为地壳中含量最多的元素,其简单离子与Z的简单离子具有相同电子数;工业上常通过电解Z的氧化物制取其单质。下列说法不正确的是( )A、元素电负性:Y>X>Z B、简单氢化物的沸点:Y>X C、原子半径:X>Y>W D、与Z同周期且第一电离能小于Z的元素有2种15. 我国科学家研发了一种由废水(含、等)提铀并同步产电的工艺,其工作原理和相关物质转化关系如图所示。下列有关该过程的说法不正确的是( ) A、电子从Fe电极经导线流向CCF电极 B、CCF电极上发生的反应有: C、生成的反应中, D、利用电解法再次获得含溶液,需将附着、的电极置于阳极16. 常温下,向某溶剂(不参与反应)中加入一定量X、Y和M,所得溶液中同时存在如下平衡:(ⅰ)(ⅱ)(ⅲ)X、Y的物质的量浓度c随反应时间t的变化关系如图所示,300s后反应体系达到平衡状态。下列说法正确的是( )
A、电子从Fe电极经导线流向CCF电极 B、CCF电极上发生的反应有: C、生成的反应中, D、利用电解法再次获得含溶液,需将附着、的电极置于阳极16. 常温下,向某溶剂(不参与反应)中加入一定量X、Y和M,所得溶液中同时存在如下平衡:(ⅰ)(ⅱ)(ⅲ)X、Y的物质的量浓度c随反应时间t的变化关系如图所示,300s后反应体系达到平衡状态。下列说法正确的是( )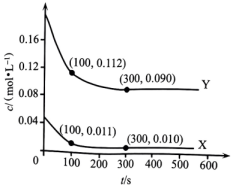 A、100~300s内, B、时,反应(ⅲ)的逆反应速率大于正反应速率 C、若反应(ⅲ)的 , 则X比Y更稳定 D、若再向容器中加入上述溶剂,则、均不变
A、100~300s内, B、时,反应(ⅲ)的逆反应速率大于正反应速率 C、若反应(ⅲ)的 , 则X比Y更稳定 D、若再向容器中加入上述溶剂,则、均不变二、非选择题:本题共4小题,共56分。
-
17. 实验室利用以铜为电极电解稀溶液的方法测定的值。(1)、Ⅰ.电解液的配制:
将溶液配制为溶液。①量取浓时,适宜的量筒规格为(填标号)。
A.10mL B.25mL C.50mL D.100mL
②配制溶液时,进行如下操作:
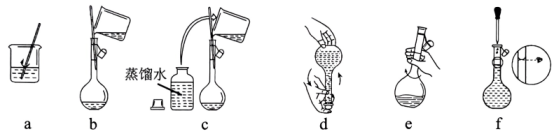
溶解→冷却→操作ⅰ→洗涤→注入→混匀→定容→操作ⅱ→装瓶贴标签下图、(填标号)所示操作依次为操作ⅰ、操作ⅱ。
 (2)、Ⅱ.值的测定:通过测定阳极铜片质量的变化量和通过电路的电量Q , 结合两者之间的关系进行计算(已知:一个电子的电量为q , )。
(2)、Ⅱ.值的测定:通过测定阳极铜片质量的变化量和通过电路的电量Q , 结合两者之间的关系进行计算(已知:一个电子的电量为q , )。在20℃、101kPa下,电流为0.2A,以精铜片为电极,电解溶液,10min后关闭电源。观察和测量结果如下:
a.阳极上有少量气泡产生,且铜片质量减少mg;
b.阴极上有大量气泡产生;
c.电解质溶液变蓝。
①为准确测量,电解前需将已除去油污的铜片 , 并用蒸馏水洗净擦干后再称重。
②经检验,阳极上产生的气体为 , 电极反应为;该副反应的发生,可能导致的测定值比其理论值(填“偏大”或“偏小”)。
(3)、为避免阳极副反应的发生,探究实验条件的影响。查阅资料:电解过程中,电解电压低将导致反应速率慢,电压高则易引发电极副反应。电流强度相同时,电压与电解质溶液的浓度成反比。
提出猜想:猜想ⅰ:电流强度越大,越容易引发电极副反应。
猜想ⅱ:硫酸浓度越低,越容易引发电极副反应。
进行实验:其他条件相同时,进行如下表实验,利用电流传感器测定通过电路的电量Q , 并测算3min内阳极铜片质量的减少量。
实验编号
理论电流I/A
实测电量Q/C
溶液的体积/mL
蒸馏水的体积/mL
阳极铜片减少的质量/g
1
0.1
18.33
a
0
0.0060
2
0.1
18.34
20
180
0.0055
3
0.2
36.70
b
c
0.0095
4
0.3
55.02
20
180
0.0130
①根据表中信息,补充数据:a= , b=。
②由实验2、3和4可知,猜想ⅰ成立,结合表中数据,给出判断理由:。
③根据实验1~4相关数据,由实验(填实验编号)测算的值误差最小。
实验结论:
④根据最优实验条件的数据计算,(已知:)。
18. 锆被称为原子时代的头号金属。一种以氧氯化锆(主要含 , 还含有少量Fe、Cr、Hf等元素)为原料生产金属锆的工艺流程如下:
已知:
①“酸溶”后溶液中各金属元素的存在形式为:、、、;
②25℃时, , ;
③部分易升华物质在接近沸点时升华速率较快。“加氢还原”前后相关物质沸点如下:
物质
沸点/℃
331
315
1300
700
1150
回答下列问题:
(1)、“酸溶”后,Hf元素的化合价为。(2)、“萃取”时,锆元素可与萃取剂形成多种络合物,写出生成的离子方程式:。(3)、“沉淀”后,“废液”中 , 则“废液”中。(4)、“沸腾氯化”时,转化为 , 同时生成一种还原性气体,该反应的化学方程式为。(5)、①“还原”的主要目的是。②沸点远低于的可能原因为。
(6)、某种掺杂CaO的晶胞如图所示,Ca位于晶胞的面心。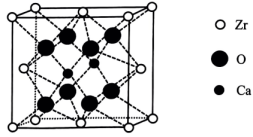
①晶体中每个O周围与其最近的O个数为。
②已知该晶胞为立方晶胞,晶胞中O与Zr的最小间距为anm,设为阿伏加德罗常数的值,该晶体的密度为(列出计算式)。
③如图所示结构(
 -Zr
-Zr  -O
-O  -Ca)与上述晶胞结构不一致的是(填标号)。
-Ca)与上述晶胞结构不一致的是(填标号)。A.
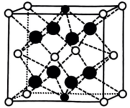 B.
B.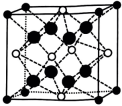
C.
 D.
D.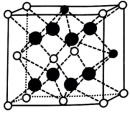 19. 用“氧化-萃取法”可从卤水中提取碘,其方法为向酸化的卤水中加入溶液,再加入萃取剂(R)进行萃取。该过程涉及以下反应:
19. 用“氧化-萃取法”可从卤水中提取碘,其方法为向酸化的卤水中加入溶液,再加入萃取剂(R)进行萃取。该过程涉及以下反应:(ⅰ)
(ⅱ)
(ⅲ)
(1)、根据盖斯定律,反应 。(2)、基态碘原子价层电子的轨道表示式为。(3)、①反应条件会影响碘的萃取率。其他条件不变时,不同温度下达平衡时碘萃取率]曲线如图所示: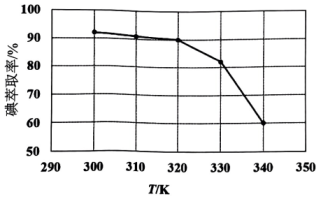
萃取温度从300K升高至320K,碘萃取率缓慢下降。结合平衡移动原理,分析其原因(忽略萃取剂的挥发、的挥发及分解产生的影响)。当萃取温度超过320K时,的分解导致碘萃取率明显下降。
②下列说法不正确的是(填标号)。
A.增大溶液的pH,碘萃取率降低 B.增大萃取剂用量,碘萃取率升高
C.萃取体系平衡后加水稀释,变小 D.增大的浓度,反应(ⅰ)的速率增大
(4)、未加萃取剂时,固定总碘浓度为 , 平衡时溶液中的、、分布系数与溶液中初始关系如图所示。[总碘浓度=各组分折合为后的浓度之和, , 如]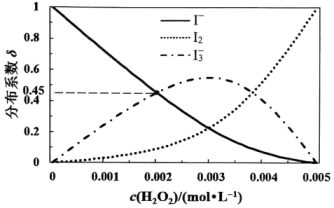
①设平衡时、、分别为、、 , 则a、b、c之间的关系式为=0.01。
②计算反应的平衡常数(结果保留3位有效数字)。
(5)、测定卤水中的方法:取25.00mL卤水于锥形瓶中,加适量氧化剂恰好将全部氧化为加溶液酸化后,再加入适量KI溶液,密闭静置后,用标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点;平行测定3次,平均消耗 , 则卤水中。(已知:)20. 我国科学家从土曲霉中发现了一种抗阿尔茨海默症效果良好的药物,其中间体化合物IX的合成路线如下(部分反应条件省略): (1)、化合物Ⅰ中的含氧官能团的名称为。(2)、化合物Ⅰ还可与化合物M在一定条件下反应,生成化合物Ⅱ,原子利用率为100%,M的化学式为。(3)、在分子组成上比化合物Ⅳ()少的化合物N有多种同分异构体,能发生银镜反应且属于芳香族化合物的有种,其中核磁共振氢谱有4组峰的结构简式为(任写一种)。(4)、根据化合物Ⅴ的结构特征,分析预测其可能的化学性质,完成下表。
(1)、化合物Ⅰ中的含氧官能团的名称为。(2)、化合物Ⅰ还可与化合物M在一定条件下反应,生成化合物Ⅱ,原子利用率为100%,M的化学式为。(3)、在分子组成上比化合物Ⅳ()少的化合物N有多种同分异构体,能发生银镜反应且属于芳香族化合物的有种,其中核磁共振氢谱有4组峰的结构简式为(任写一种)。(4)、根据化合物Ⅴ的结构特征,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
a
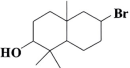
b
浓 , 加热
消去反应
(5)、下列与反应⑦相关的描述不正确的有____(填标号)。A、反应过程中,有断裂和键形成 B、中的空间结构为正四面体形 C、化合物Ⅶ和Ⅷ的分子中均含有手性碳原子 D、化合物Ⅶ分子中,存在由p轨道“头碰头”形成的键(6)、参照上述合成路线,请设计以 为主要原料合成
为主要原料合成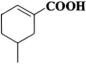 的路线(不用注明反应条件)。
的路线(不用注明反应条件)。