海南省2023年化学中考真题
试卷更新日期:2024-03-05 类型:中考真卷
一、选择题(每小题只有一个选项符合题意,每小题3分,共42分)
-
1. 干燥空气中体积分数约占78%且化学性质不活泼的气体是( )A、氧气 B、氮气 C、二氧化碳 D、水蒸气2. 下列是海南非物质文化遗产名录中的技艺,其中涉及化学变化的是( )




A.海南椰雕
B.黎锦编织
C.海盐晒制
D.陶瓷烧制
A、A B、B C、C D、D3. 下列符号表示2个氧分子的是( )A、 B、 C、4O D、2O4. 某实验小组做“配制一定溶质质量分数的氯化钠溶液”实验的部分操作如下,其中错误的是( )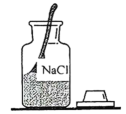

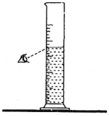
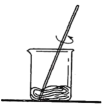
A.取用固体
B.称量
C.量取液体
D.溶解
A、A B、B C、C D、D5. 五月荔枝红。荔枝开花期间要消耗大量的钾肥,下列属于钾肥的是( )A、 B、 C、 D、6. 某同学用试纸测定了生活中一些物质的 , 其中呈碱性的是( )A、炉具清洁剂 B、蔗糖水 C、柠檬汁 D、厕所清洁剂7. 首届上海国际碳中和博览会于2023年6月在国家会展中心举办,下列做法与该博览会主题不一致的是( )A、研发清洁能源 B、推广火力发电 C、提倡绿色出行 D、发展新能源汽车8. 2023年5月28日,国产大型客机C919成功完成首次商业飞行。下列C919应用的材料中,不属于金属材料的是( )A、碳纤维复合材料 B、第三代铝锂合金 C、钛合金 D、钢材料9. 钴是可充电电池的重要组成元素,如图为钴元素在元素周期表中的信息,下列有关钴的说法正确的是( )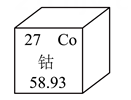 A、属于非金属元素 B、元素符号为 C、原子的最外层电子数为27 D、相对原子质量为58.9310. 掌握一定的灭火原理有助于减少灾害的发生,下列做法错误的是( )A、炒菜锅着火用锅盖盖灭 B、燃气泄漏着火先关闭燃气阀门 C、电器着火用水直接扑灭 D、酒精灯碰倒着火用湿抹布盖灭11. 下列劳动过程均涉及科学原理,其中解释错误的是( )
A、属于非金属元素 B、元素符号为 C、原子的最外层电子数为27 D、相对原子质量为58.9310. 掌握一定的灭火原理有助于减少灾害的发生,下列做法错误的是( )A、炒菜锅着火用锅盖盖灭 B、燃气泄漏着火先关闭燃气阀门 C、电器着火用水直接扑灭 D、酒精灯碰倒着火用湿抹布盖灭11. 下列劳动过程均涉及科学原理,其中解释错误的是( )选项
劳动过程
原理解释
A
用洗洁精洗净碗碟上的油渍
洗洁精使油脂产生乳化现象
B
用白醋洗掉水壶中的水垢(主要成分为碳酸钙)
醋酸和碳酸钙反应生成可溶盐
C
大雨过后井水浑浊,用明矾净水
明矾溶于水产生有吸附性的胶状物
D
将铁锅洗净后擦干防止生锈
铁与水直接反应生成铁锈
A、A B、B C、C D、D12. 氯化铵在不同温度时的溶解度如下表。20℃时,小明开展了如下图所示的实验探究(假设加热过程中溶剂的量不减少)。下列说法错误的是( )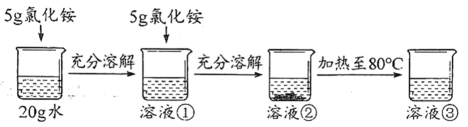
温度/℃
20
40
60
80
溶解度/g
37.2
45.8
55.2
65.6
A、溶液①和溶液③都是氯化铵的不饱和溶液 B、向溶液②中加入少量硫酸铜,溶液不变色 C、溶液③的溶质质量分数一定大于溶液① D、溶液③降低温度至40℃时已变成饱和溶液13. 某实验小组利用如图所示的装置开展了系列实验探究活动,将X滴加到锥形瓶中,根据Z中观察到的现象得出结论正确的是( )
选项
X
Y
Z
现象
结论
A
水
水
水倒吸进入锥形瓶
溶解放热
B
稀盐酸
大理石
滴加了紫色石蕊溶液的蒸馏水
溶液变红
可使石蕊变红
C
过氧化氢溶液
80℃热水和水下的一小块白磷
白磷燃烧
燃烧需要使可燃物温度达到着火点
D
稀硫酸
锌粒
肥皂水
一段时间后,将导管移出水面,产生的肥皂泡向上飘
氢气的密度比空气小
A、A B、B C、C D、D14. 取3.0g纯净物甲与一定质量的乙在一定条件下恰好完全反应,生成3.6g丙和6.6g丁,反应的微观示意图如下。下列说法正确的是( )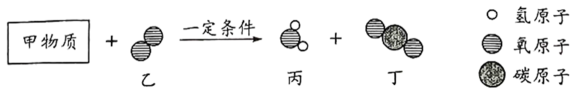 A、甲的化学式为 B、反应物和生成物中共有三种氧化物 C、反应后分子总数增加 D、甲物质中碳元素的质量分数为40%
A、甲的化学式为 B、反应物和生成物中共有三种氧化物 C、反应后分子总数增加 D、甲物质中碳元素的质量分数为40%二、填空题(每空2分、共26分)
-
15. 化学使生活更美好。选择下列物质填空(填序号):
①石墨②聚乙烯③氯化钠④熟石灰
(1)、常用作调味品的是。(2)、可用于中和酸性废水的是。(3)、可用于制作电极的是。(4)、可用于制作食品包装袋的是。16. 海南粉是海南特色小吃,其配料包括:米粉、豆芽菜、笋丝、酸菜、牛肉干、花生、黑芝麻、大蒜末等。 (1)、米粉由大米加工而成,主要富含的基本营养素为____。A、糖类 B、油脂 C、蛋白质(2)、配料中的花生又称“长生果”,富含、P、K、、等(填“元素”“原子”或“分子”),有助于防治心血管疾病。(3)、大蒜切开捣碎后生成的大蒜素能够杀菌,大蒜素的化学式为 , 该分子中S原子和O原子的个数比为。17. 某工业废料中含有和(不考虑其他成分),小红设计如下实验方案用该工业废料制备和。
(1)、米粉由大米加工而成,主要富含的基本营养素为____。A、糖类 B、油脂 C、蛋白质(2)、配料中的花生又称“长生果”,富含、P、K、、等(填“元素”“原子”或“分子”),有助于防治心血管疾病。(3)、大蒜切开捣碎后生成的大蒜素能够杀菌,大蒜素的化学式为 , 该分子中S原子和O原子的个数比为。17. 某工业废料中含有和(不考虑其他成分),小红设计如下实验方案用该工业废料制备和。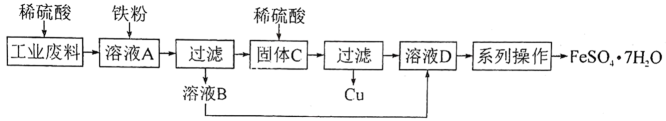 (1)、实验室进行过滤操作,用到的玻璃仪器有、烧杯和玻璃棒。(2)、加入铁粉后溶液A中发生的化学反应有:、。(3)、固体C的成分为。(4)、“系列操作”中最后通过冷却结晶得到晶体。能够采用冷却结晶的方法进行提纯的物质,其溶解度与温度的关系是。18. 位于海南省东方市的某化肥厂,利用南部海域气田供应的富含二氧化碳的天然气生产甲醇(),生产过程中涉及到的主要反应为: , 。若该厂采用上述方法制备68.8t甲醇,同时回收了0.3t氢气(其他反应忽略不计)。(1)、属于(填“有机物”或“无机物”)。(2)、该天然气中和的质量比为(最简整数比)。
(1)、实验室进行过滤操作,用到的玻璃仪器有、烧杯和玻璃棒。(2)、加入铁粉后溶液A中发生的化学反应有:、。(3)、固体C的成分为。(4)、“系列操作”中最后通过冷却结晶得到晶体。能够采用冷却结晶的方法进行提纯的物质,其溶解度与温度的关系是。18. 位于海南省东方市的某化肥厂,利用南部海域气田供应的富含二氧化碳的天然气生产甲醇(),生产过程中涉及到的主要反应为: , 。若该厂采用上述方法制备68.8t甲醇,同时回收了0.3t氢气(其他反应忽略不计)。(1)、属于(填“有机物”或“无机物”)。(2)、该天然气中和的质量比为(最简整数比)。三、简答题(19小题4分,20小题6分,共10分)
-
19. 物质是由微观粒子构成的,请从微观视角解释生活中的下列现象。(1)、玉兰花开后,很远都能闻到花香。(2)、40L的钢瓶中可以容纳6000L氧气。20. 新装修的房屋会释放出甲醛,除开窗通风还可用活性炭或光触媒辅助去除室内甲醛。在紫外线照射下,光触媒催化甲醛分解为和。相同条件下活性炭和光触媒去除室内甲醛的相关研究数据如图(该实验在自然光照的密闭室内进行)。
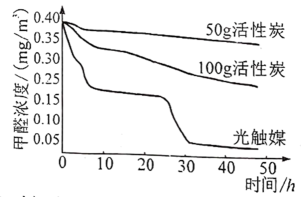 (1)、活性炭和光触媒去除甲醛的原理分别是什么?(2)、在光触媒的实验中,8~24小时和32~48小时两个时间段内,甲醛浓度均没有明显下降,可能原因是什么?(3)、若使用其中一种方法去除室内甲醛,根据该实验结果,提出一条合理建议。
(1)、活性炭和光触媒去除甲醛的原理分别是什么?(2)、在光触媒的实验中,8~24小时和32~48小时两个时间段内,甲醛浓度均没有明显下降,可能原因是什么?(3)、若使用其中一种方法去除室内甲醛,根据该实验结果,提出一条合理建议。四、实验题(21小题6分,22小题8分,共14分)
-
21. 如图是电解水的实验装置,回答下列问题。
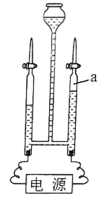 (1)、a中收集到的气体是。(2)、电解时通常会向水中加入少量氢氧化钠,其目的是。(3)、电解水的实验可以证明水是由氢元素和氧元素组成的,得出该结论的理论依据是(从微观的角度说明)。22. 小林看到自热食品中的发热包产品说明如图所示,咨询老师后得知该配方中氧化钙和铝粉的质量相等,为了探究其发热原理,设计了如下实验,实验结果记录如下(室温25℃)。
(1)、a中收集到的气体是。(2)、电解时通常会向水中加入少量氢氧化钠,其目的是。(3)、电解水的实验可以证明水是由氢元素和氧元素组成的,得出该结论的理论依据是(从微观的角度说明)。22. 小林看到自热食品中的发热包产品说明如图所示,咨询老师后得知该配方中氧化钙和铝粉的质量相等,为了探究其发热原理,设计了如下实验,实验结果记录如下(室温25℃)。
序号
实验方案
最高温度/℃
达到最高温度所需时间/min
开始降温时间/min
1
5.0g氧化钙15水
68
1
2.5
2
38
1.1
3.8
3
5.0g铝粉15水
无明显变化
4
2.5g氧化钙2.5g铝粉15水
43
1.2
2.5
5
4.0g氧化钙1.0g碳酸钠15水
29
1
7.5
6
4.0g铝粉1.0g碳酸钠15水
无明显变化
7
2.0g氧化钙2.0g铝粉1.0g碳酸钠15水
96
8.1
13.4
(1)、序号2的实验方案为。(2)、根据实验结果,该发热包与纯氧化钙发热包相比具有的优势是。(3)、查阅资料可知,该发热包的反应原理如下:a.(反应启动)
b.
C.(主要放热)
①请把反应c的化学方程式补充完整。
②根据反应c的相关信息,写出该发热包使用时的注意事项:。
五、计算题
-
23. 镁是一种重要金属,广泛应用于制造火箭、导弹和飞机的部件等。工业上通过电解熔融氯化镁制备单质镁:(熔融)。请计算:(1)、中镁元素的化合价为。(2)、应用此法制备48t镁,至少需要消耗的质量是多少?