江苏省南通市2023年中考化学真题
试卷更新日期:2024-03-05 类型:中考真卷
一、选择题
-
1. 近代著名实业家张謇在南通办教育、建纱厂,留下了宝贵遗产。纱厂生产的棉纱属于( )A、塑料 B、纤维 C、橡胶 D、合金2. 同时含有氮、磷、钾中两种或三种元素的化肥属于复合肥。下列属于复合肥的是( )A、KNO3 B、Ca3(PO4)2 C、KCl D、NH4HCO33. “粗盐中难溶性杂质的去除”涉及的实验操作中不正确的是( )A、
 溶解粗盐
B、
溶解粗盐
B、 过滤杂质
C、
过滤杂质
C、 蒸发结晶
D、
蒸发结晶
D、 熄灭酒精灯
4. 含碳物质种类丰富、应用广泛。下列物质的性质与用途具有对应关系的是( )A、活性炭具有吸附性,可用于水的净化 B、一氧化碳具有毒性,可用于高炉炼铁 C、碳酸氢钠受热易分解,可用于治疗胃酸过多症 D、聚氯乙烯塑料热稳定性差,可用作电线外面的绝缘层5. 阅读下列材料,完成问题。
熄灭酒精灯
4. 含碳物质种类丰富、应用广泛。下列物质的性质与用途具有对应关系的是( )A、活性炭具有吸附性,可用于水的净化 B、一氧化碳具有毒性,可用于高炉炼铁 C、碳酸氢钠受热易分解,可用于治疗胃酸过多症 D、聚氯乙烯塑料热稳定性差,可用作电线外面的绝缘层5. 阅读下列材料,完成问题。大气臭氧层是地球的太阳镜,能吸收紫外线,保护生物。大气平流层中同时发生氧气与臭氧的相互转化,经过漫长时间形成臭氧层。氧气与臭氧的相互转化如图所示。
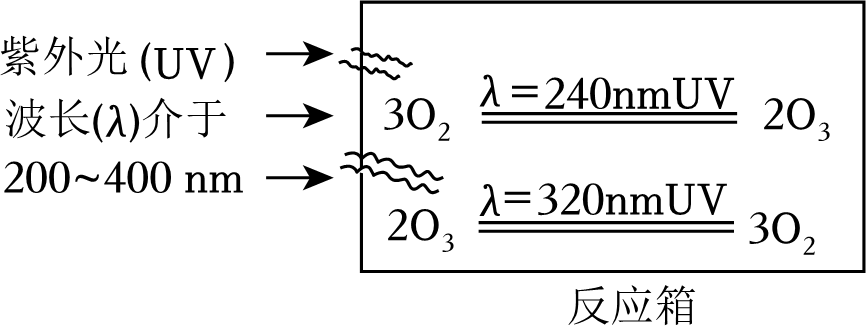 (1)、下列有关空气、氧气和臭氧的说法正确的是( )A、空气中含量最高的是氧气 B、可用向下排空气法收集氧气 C、葡萄糖在人体内的缓慢氧化需要氧气 D、氧气比臭氧更容易吸收太阳紫外线(2)、关于反应箱中氧气与臭氧的相互转化,下列说法不正确的是( )A、气体总质量保持不变 B、元素种类保持不变 C、分子总数保持不变 D、原子总数保持不变6. 学习小组通过下列实验探究CuSO4溶液的性质。
(1)、下列有关空气、氧气和臭氧的说法正确的是( )A、空气中含量最高的是氧气 B、可用向下排空气法收集氧气 C、葡萄糖在人体内的缓慢氧化需要氧气 D、氧气比臭氧更容易吸收太阳紫外线(2)、关于反应箱中氧气与臭氧的相互转化,下列说法不正确的是( )A、气体总质量保持不变 B、元素种类保持不变 C、分子总数保持不变 D、原子总数保持不变6. 学习小组通过下列实验探究CuSO4溶液的性质。实验Ⅰ把一根砂纸打磨过的Al丝浸入CuSO4溶液中,一段时间后观察到Al丝表面出现红色物质。
实验Ⅱ向CuSO4溶液中滴加少量NaOH溶液,出现沉淀。
下列说法正确的是( )
A、实验Ⅰ中溶液颜色不变 B、实验Ⅰ说明Al的活动性比Cu的强 C、实验Ⅱ中只发生物理变化 D、实验Ⅱ中沉淀为CuO7. 常温下,工业可利用Na2SO4+KCl→NaCl+K2SO4(未配平)原理制备K2SO4。Na2SO4、KCl、NaCl和K2SO4 的溶解度曲线如图所示。下列说法正确的是( ) A、KCl的溶解度一定大于NaCl的溶解度 B、Na2SO4的溶解度随温度的升高一直增大 C、60℃时,Na2SO4、KCl溶液中溶质的质量分数一定相等 D、该制备反应利用了常温下K2SO4溶解度相对较小的性质8. 下列实验方案能达到实验目的的是( )
A、KCl的溶解度一定大于NaCl的溶解度 B、Na2SO4的溶解度随温度的升高一直增大 C、60℃时,Na2SO4、KCl溶液中溶质的质量分数一定相等 D、该制备反应利用了常温下K2SO4溶解度相对较小的性质8. 下列实验方案能达到实验目的的是( )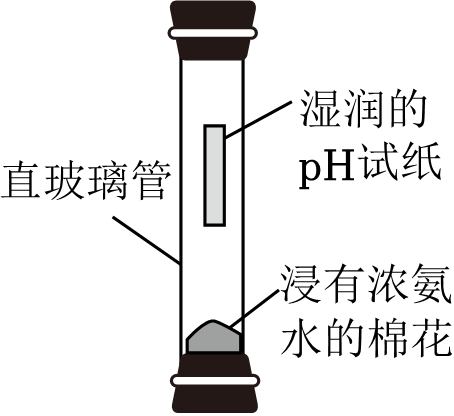 A、稀释浓硫酸:将水直接倒入盛有浓硫酸的烧杯中 B、探究氨分子运动现象:按第19题图所示装置进行实验 C、配制质量分数为5%的氯化钠溶液:将5g氯化钠溶于100g水 D、验证牛奶中含有锌元素:向牛奶中加入稀硫酸,观察是否有气泡产生9. 已知常温下Ca(OH)2溶解度为0.17g。向一定量饱和Ca(OH)2溶液中滴加盐酸,溶液pH随V(盐酸)变化的曲线如图所示。为检测某生石灰样品中钙元素含量,实验如下:
A、稀释浓硫酸:将水直接倒入盛有浓硫酸的烧杯中 B、探究氨分子运动现象:按第19题图所示装置进行实验 C、配制质量分数为5%的氯化钠溶液:将5g氯化钠溶于100g水 D、验证牛奶中含有锌元素:向牛奶中加入稀硫酸,观察是否有气泡产生9. 已知常温下Ca(OH)2溶解度为0.17g。向一定量饱和Ca(OH)2溶液中滴加盐酸,溶液pH随V(盐酸)变化的曲线如图所示。为检测某生石灰样品中钙元素含量,实验如下:步骤1取0.60g样品于锥形瓶中,向其中加入200mL蒸馏水,盖上表面皿充分振荡。
步骤2向冷却后的锥形瓶中滴入几滴酚酞,再逐滴加入稀盐酸至反应完全。反应完全时锥形瓶内溶液红色恰好褪去。经换算,消耗m(HCl)=0.73g。
下列说法正确的是( )
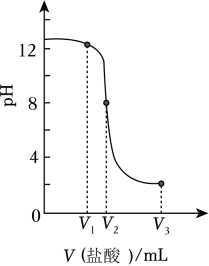 A、步骤1中充分振荡后得到澄清透明的溶液 B、步骤2中红色恰好褪去时,消耗V3mL盐酸 C、步骤2中化学反应方程式为2HCl+CaO=CaCl2+H2O D、该样品中钙元素的质量分数为66.67%
A、步骤1中充分振荡后得到澄清透明的溶液 B、步骤2中红色恰好褪去时,消耗V3mL盐酸 C、步骤2中化学反应方程式为2HCl+CaO=CaCl2+H2O D、该样品中钙元素的质量分数为66.67%二、非选择题
-
10. 海水中含有大量的氯化钠、氯化镁等,研究它们的组成和性质具有重要意义。(1)、构成水分子的微粒是氢原子和 。海水晒盐时,液态水蒸发为水蒸气的过程中,水分子的结构 (填“发生”或“没有”)改变。(2)、钠原子的结构示意图为
 , 氯原子的结构示意图为
, 氯原子的结构示意图为 。
。①钠原子转变为钠离子时,发生变化的是 (填“质子数”或“电子数”)。
②x的数值为 。
(3)、氯化镁中镁元素和氯元素的化合价分别为 。化合物中各元素正负化合价的代数和为 。(4)、工业可利用反应MgCl2(熔融)Mg+X↑ 制取Mg。单质X的化学式为 。(5)、NaCl可用作雪天道路抗冻剂。冰水混合物中,水与冰会发生水分子交换。0℃时,水与冰发生交换的水分子数目相等,该微观过程如图1所示。向冰水混合物中加入NaCl,水分子交换的微观过程如图2所示。从水分子交换的角度解释NaCl降低水凝固点的原理:。 11. 实验室以软锰矿(主要含MnO2的矿石)为原料制备MnO2的流程如图1:
11. 实验室以软锰矿(主要含MnO2的矿石)为原料制备MnO2的流程如图1: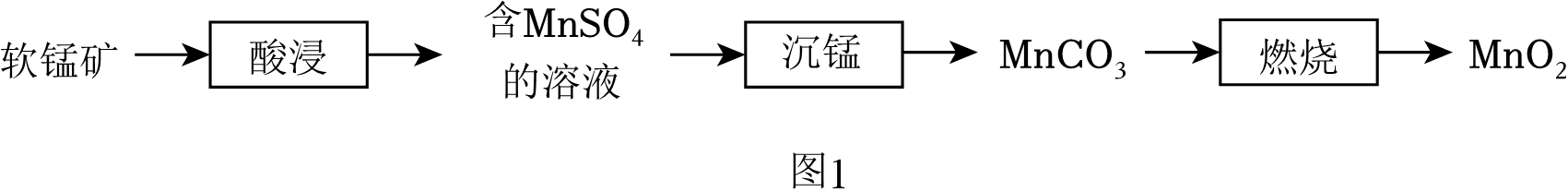 (1)、MnO2催化分解KClO3的化学反应方程式为 。(2)、“酸浸”时,为使软锰矿充分反应,可采取的措施有 (写一条)。(3)、“沉锰”反应为MnSO4+2NH4HCO3MnCO3↓+(NH4)2SO4+H2O+CO2↑,加热温度不能过高的原因是 。(4)、在空气中“煅烧”MnCO3会生成不同的锰氧化物,各锰氧化物质量分数随煅烧温度的变化关系如图2所示。
(1)、MnO2催化分解KClO3的化学反应方程式为 。(2)、“酸浸”时,为使软锰矿充分反应,可采取的措施有 (写一条)。(3)、“沉锰”反应为MnSO4+2NH4HCO3MnCO3↓+(NH4)2SO4+H2O+CO2↑,加热温度不能过高的原因是 。(4)、在空气中“煅烧”MnCO3会生成不同的锰氧化物,各锰氧化物质量分数随煅烧温度的变化关系如图2所示。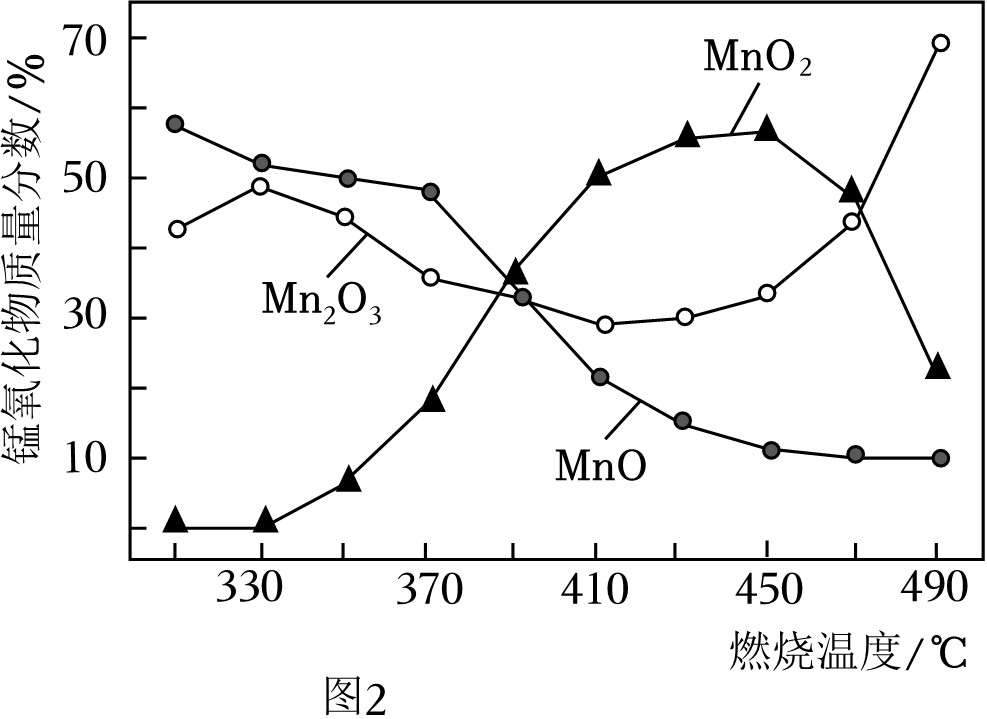
①370﹣410℃发生主要反应为2MnO+O22MnO2。该反应属于基本反应类型中的 反应。
②已知酒精灯外焰的最高温度可达600℃以上。称取一定质量的MnO2与KClO3混合均匀,充分加热后冷却,溶解、过滤、洗涤、烘干后称量,发现固体质量减少。MnO2质量减少的主要原因是 。
12. 学习小组用石蜡自制蜡烛并探究其燃烧。(1)、剪去易拉罐的盖子,在中间吊一根棉线作烛芯,将其置于盛有冷水的水槽中。向易拉罐中倒入液态石蜡并添加少量硬脂酸。充分冷却,从易拉罐中取出蜡烛。①蜡烛属于 (填“混合物”或“纯净物”)。
②将易拉罐置于冷水槽中,有助于液态石蜡凝固,这是利用了金属的 性。
(2)、点燃蜡烛,火焰明亮,烛芯周围有液体产生。①能说明蜡烛燃烧时放出热量的现象是 。
②正二十二烷(C22H46)是石蜡的成分之一。正二十二烷完全燃烧的产物与甲烷的相同。写出正二十二烷完全燃烧的化学反应方程式:。
(3)、在燃着的蜡烛上方扣一个烧杯,一段时间后蜡烛熄灭,烧杯内壁出现水雾,烧杯底部变黑且干燥(如第23题图所示)。资料显示,蜡烛不完全燃烧产生的炭黑具有超疏水性,水滴在其表面不易附着聚集,利用这种性质可以制作超疏水性材料。①蜡烛熄灭的可能原因有 。
②铁质水管覆盖超疏水性材料可提高水管的抗腐蚀性,其原理是 。
 13. 学习小组制取 CO2 和 SO2 , 并探究其水溶液的性质。
13. 学习小组制取 CO2 和 SO2 , 并探究其水溶液的性质。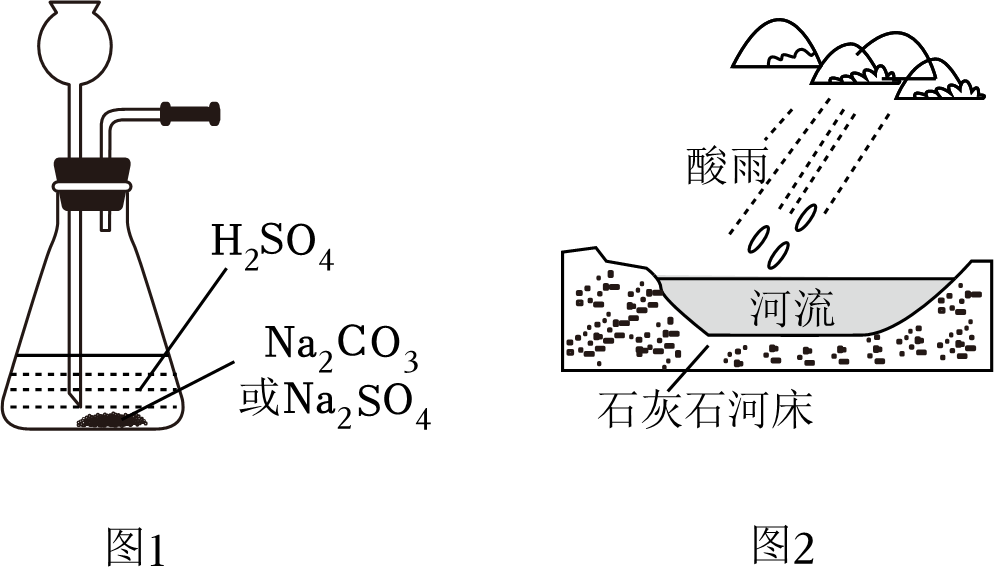 (1)、Ⅰ制取CO2和SO2
(1)、Ⅰ制取CO2和SO2在常温、气体压强为101kPa时,1体积水里最多能溶解大约1体积CO2 或40体积SO2。学习小组利用图1所示装置制取CO2和SO2。
利用该装置制取CO2的化学反应方程式为 。(2)、不能用排水法收集SO2的理由是 。(3)、Ⅱ探究CO2和SO2水溶液的性质在通风橱中分别向100mLH2O中通入CO2和SO2至饱和,用pH计测定饱和溶液pH,静置2h后,再次读取溶液pH。结果如表所示。
饱和溶液pH
静置2h后溶液pH
CO2水溶液
3.94
4.12
SO2水溶液
0.88
0.79
①测定pH最简便的方法是使用pH试纸,操作时玻璃棒的作用是 (填字母)。
A.搅拌
B.引流
C.蘸取溶液
②静置2h后,CO2水溶液酸性 (填“增强”或“减弱”)。
③有同学根据溶液的pH认为CO2也是造成酸雨的重要因素。请判断该推论是否正确,并说明理由:。
(4)、取静置后的SO2水溶液于试管中,向其中滴加过量Ba(OH)2溶液,有沉淀产生。【提出问题】该沉淀是什么?
【查阅资料】①SO2水溶液、BaSO3都能与O2发生氧化反应。
②BaSO3和BaSO4都难溶于水。
③BaSO3能溶于浓度较大的盐酸,BaSO4不溶于盐酸。
【提出猜想】沉淀可能为BaSO4或BaSO4、BaSO3的混合物。
【实验验证】请设计实验验证沉淀中一定含有BaSO4。简述实验过程(包括操作和现象):。(实验中须使用的试剂:10%的盐酸)
(5)、煤燃烧排放的SO2可能导致酸雨。南通市2021年酸雨发生率为1.7%,比2020年减少1%。你了解的本地决策部门为降低SO2排放做出的举措有 (写一条)。(6)、酸雨对环境的影响因地区地质而异。如图2中河流受酸雨损害的程度较小的原因是 。14. 化学储氢材料研发是当下科技研究的热点之一。(1)、下列化学储氢材料中含氢量最高的是 ____(填字母)。A、NH3 B、N2H4 C、CH4(2)、我国科学家发明了一种将甲烷中的氢转化为氢气的工艺(原理如图所示)。总反应的化学反应方程式为CH4+H2O=CO+3H2
①反应器Ⅰ中的化学反应方程式为 。
②当甲烷的转化率(×100%)为80%时,理论上1.0吨甲烷与足量水蒸气反应生成氢气的总质量是吨?