广东省江门市江海区2023-2024学年九年级上学期期末调研考试化学试题
试卷更新日期:2024-03-05 类型:期末考试
一、选择题:本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题意
-
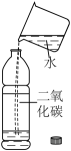
1. 人体每日需要摄入适量的钙,这里的“钙”指的是( )A、元素 B、单质 C、分子 D、原子2. “垃圾分类我先行”,我们要养成垃圾分类的好习惯。矿泉水瓶、快递纸箱属于( )A、
 B、
B、 C、
C、 D、
D、 3. 我国传统文化源远流长,下列相关制作过程中一定发生了化学变化的是( )A、丝绸刺绣 B、手工剪纸 C、玉柄雕琢 D、烧制陶器4. 下列图示实验操作中,错误的是( )A、
3. 我国传统文化源远流长,下列相关制作过程中一定发生了化学变化的是( )A、丝绸刺绣 B、手工剪纸 C、玉柄雕琢 D、烧制陶器4. 下列图示实验操作中,错误的是( )A、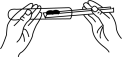 取用固体粉末
B、
取用固体粉末
B、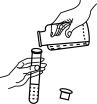 倾倒液体
C、
倾倒液体
C、 滴加液体
D、
滴加液体
D、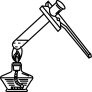 加热液体
5. 生活中的下列物质,属于纯净物的是( )A、食醋 B、果汁 C、饮用蒸馏水 D、洗发水6. 20世纪以来,我国化学基础研究取得了长足发展,其中为相对原子质量的测定作出卓越贡献的科学家是( )A、钱学森 B、张青莲 C、屠呦呦 D、袁隆平7. 央视栏目《典籍里的中国》展现了中国智慧。用墨书写的典籍保存至今仍不变色,体现了碳单质具有的性质是( )A、质软 B、导电性 C、可燃性 D、常温稳定性8. 学校兴趣小组在跨学科实践课上制作了一台简易化学“制氧机”,如图所示,请完成下面小题。
加热液体
5. 生活中的下列物质,属于纯净物的是( )A、食醋 B、果汁 C、饮用蒸馏水 D、洗发水6. 20世纪以来,我国化学基础研究取得了长足发展,其中为相对原子质量的测定作出卓越贡献的科学家是( )A、钱学森 B、张青莲 C、屠呦呦 D、袁隆平7. 央视栏目《典籍里的中国》展现了中国智慧。用墨书写的典籍保存至今仍不变色,体现了碳单质具有的性质是( )A、质软 B、导电性 C、可燃性 D、常温稳定性8. 学校兴趣小组在跨学科实践课上制作了一台简易化学“制氧机”,如图所示,请完成下面小题。 (1)、该制氧机通过A、B两种物质产生氧气,A是过碳酸钠(2Na2CO3·3H2O2),B是二氧化锰(MnO2)。其中二氧化锰中锰元素的化合价为( )A、+4 B、+3 C、+2 D、+1(2)、制氧时反应仓内黑色粉末翻腾,变得浑浊,仓壁变得温热,过滤仓底部导气管口有气泡冒出。此时过滤仓中的水起不到的作用是( )A、观察氧气生成的速率 B、降低吸入氧气温度 C、加快氧气的生成速率 D、过滤杂质提纯氧气(3)、下列与“制氧机”实践课有关的说法错误的是( )A、制取过程涉及化学变化 B、制取的氧气可用作燃料 C、制取完成后二氧化锰可回收再用 D、反应仓的仓体材料应选择无毒环保的9. 钕(Nd)等稀土元素是一类有重要用途的资源。下列说法正确的是( )
(1)、该制氧机通过A、B两种物质产生氧气,A是过碳酸钠(2Na2CO3·3H2O2),B是二氧化锰(MnO2)。其中二氧化锰中锰元素的化合价为( )A、+4 B、+3 C、+2 D、+1(2)、制氧时反应仓内黑色粉末翻腾,变得浑浊,仓壁变得温热,过滤仓底部导气管口有气泡冒出。此时过滤仓中的水起不到的作用是( )A、观察氧气生成的速率 B、降低吸入氧气温度 C、加快氧气的生成速率 D、过滤杂质提纯氧气(3)、下列与“制氧机”实践课有关的说法错误的是( )A、制取过程涉及化学变化 B、制取的氧气可用作燃料 C、制取完成后二氧化锰可回收再用 D、反应仓的仓体材料应选择无毒环保的9. 钕(Nd)等稀土元素是一类有重要用途的资源。下列说法正确的是( )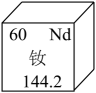 A、一个钕原子含60个质子 B、钕属于非金属元素 C、一个钕原子的质量为144.2g D、三氧化二钕的化学式为O3Nd210. 2023年“中国水周"活动主题为“强化依法治水,携手共护母亲河”。以下关于蓬江河流域水资源的说法错误的是( )A、加入明矾能促进河水中悬浮杂质沉降 B、B.可用肥皂水检验河水是否为硬水 C、合理使用农药、化肥以减少水体污染 D、河水经过过滤、吸附操作可得到纯净的水11. “宏观-微观-符号”相结合是化学学科独有的思维方式。下列化学用语书写错误的是( )A、3个氧原子—O3 B、2个氢分子—2H2 C、5个钠离子—5Na+ D、氧化铜—CuO12. 劳动创造美好生活。下列劳动项目所涉及的化学知识正确的是( )
A、一个钕原子含60个质子 B、钕属于非金属元素 C、一个钕原子的质量为144.2g D、三氧化二钕的化学式为O3Nd210. 2023年“中国水周"活动主题为“强化依法治水,携手共护母亲河”。以下关于蓬江河流域水资源的说法错误的是( )A、加入明矾能促进河水中悬浮杂质沉降 B、B.可用肥皂水检验河水是否为硬水 C、合理使用农药、化肥以减少水体污染 D、河水经过过滤、吸附操作可得到纯净的水11. “宏观-微观-符号”相结合是化学学科独有的思维方式。下列化学用语书写错误的是( )A、3个氧原子—O3 B、2个氢分子—2H2 C、5个钠离子—5Na+ D、氧化铜—CuO12. 劳动创造美好生活。下列劳动项目所涉及的化学知识正确的是( )选项
劳动项目
化学知识
A
用活性炭自制简易净水器
活性炭具有还原性
B
用锅盖盖灭着火的油锅
降低油的着火点
C
用管道天然气炒菜、做饭
天然气具有可燃性
D
清理家中鱼缸并通入空气
空气中的氧气极易溶于水
A、A B、B C、C D、D13. 下列实验设计,能达到实验目的的是( )选项
A
B
C
D
实验设计

实验目的
证明CO2能
与水反应
验证质量守恒定律
探究燃烧条件之一:
需要有氧气
测定空气中
氧气含量
A、A B、B C、C D、D二、非选择题:本大题共6小题,第16小题7分,第17小题8分,第18~21小题各10分,共55分。
-
14. 化学为航空、航天领域的发展提供了强有力的支撑。(1)、长征七号运载火箭采用液氧加煤油作为推进剂,保持液氧化学性质的微粒是。(2)、发动机点火后煤油燃烧,从燃烧条件的角度分析,点火的作用是。(3)、石油属于(填“可再生"或“不可再生”)能源;从石油中分离出航天煤油类似于实验操作中的。(4)、飞船太阳能帆板工作过程中,将太阳能转化为。(5)、利用铁酸镍作催化剂可高效将航天员呼出的CO2转化为O2 , 反应前后铁酸镍的和都没有发生改变。15. 我国科研团队研发了一种纳米“蓄水"膜反应器(如下图所示),内部封装了特定催化剂,该催化剂能够实现在温和条件下(3MPa,240℃)氢气和二氧化碳转化为乙醇(C2H5OH),二氧化碳近100%高效稳定的转化。纳米“蓄水”膜反应器的壳层具有高选择性,反应后,能保证生成的水集中到内部而乙醇溢出。

二氧化碳不仅能制造乙醇,还能制造淀粉、蛋白质、甲醇、尿素、纯碱、灭火剂等,我国化学工作者正在围绕绿色、低碳、环保、高效的主题,继续推进碳捕捉、碳中和,以实现二氧化碳资源的高价值利用。
(1)、图中“ ”表示的物质属于(填“化合物”或“单质");其分子中碳、氢原子个数比。 (2)、壳层的优点是。(3)、纳米“蓄水"膜反应器内发生反应的化学方程式为。(4)、下列做法不能实现“碳减排”的是____。A、加高烟囱排放工业废气 B、推进新能源汽车使用 C、养成节约用水用电习惯(5)、“碳捕捉与封存”技术有多种途径。
”表示的物质属于(填“化合物”或“单质");其分子中碳、氢原子个数比。 (2)、壳层的优点是。(3)、纳米“蓄水"膜反应器内发生反应的化学方程式为。(4)、下列做法不能实现“碳减排”的是____。A、加高烟囱排放工业废气 B、推进新能源汽车使用 C、养成节约用水用电习惯(5)、“碳捕捉与封存”技术有多种途径。①利用NaOH溶液喷洒成雾状“捕捉”二氧化碳。喷洒成雾状的目的是。
②利用高压将二氧化碳压入地下封存,如图所示。请从微观的角度回答此封存技术可行的依据是。
 16. 下图是实验用的部分装置及曲线,请回答下列问题:
16. 下图是实验用的部分装置及曲线,请回答下列问题: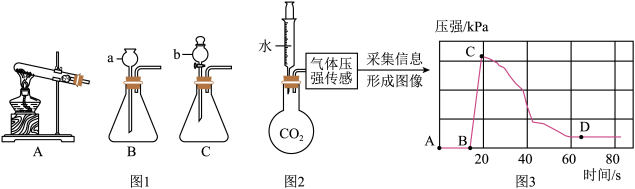 (1)、写出仪器a的名称。(2)、实验室用高锰酸钾加热制取氧气时,发生装置应选 , 该反应的化学方程式为。(3)、收集一瓶O2并进行性质检验。
(1)、写出仪器a的名称。(2)、实验室用高锰酸钾加热制取氧气时,发生装置应选 , 该反应的化学方程式为。(3)、收集一瓶O2并进行性质检验。操作
现象
结论
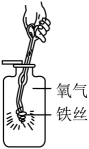
铁丝在氧气中剧烈燃烧,
生成黑色固体。
写出铁在氧气中燃烧的
化学方程式:
实验时集气瓶瓶底炸裂,可能的原因是
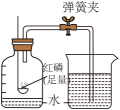
(4)、实验室常用块状碳化钙(CaC2)与水反应制乙炔(C2H2),该反应非常剧烈。从图1中选择实验室制乙炔所用的最佳发生装置是。(5)、为了解二氧化碳溶于水的情况,设计了图2所示实验装置。用烧瓶收集一瓶二氧化碳气体,连接压强传感器和一支装有20mL蒸馏水的注射器,迅速将注射器里的蒸馏水全部压入烧瓶中,压强变化曲线如图3所示,CD段压强减小的原因是。17. 胆矾、硫酸铜溶液是实验中常见的化学试剂,兴趣小组的同学开展了有关硫酸铜项目研究。(1)、项目一:硫酸铜的性质胆矾是一种蓝色晶体,描述的是胆矾的(填“物理”或“化学")性质。
(2)、固体硫酸铜粉末呈白色,遇水会变蓝色,实验室常用固体硫酸铜粉末来检验。(3)、项目二:硫酸铜的用途西汉时期的《淮南万毕术》记载了湿法炼铜工艺:“曾青(硫酸铜溶液)得铁则化为铜”,其反应也可以用来验证质量守恒定律,该反应的化学方程式为。
(4)、项目三:硫酸铜的制备【查阅资料】
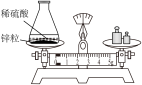
制备硫酸铜的一种方案Cu+H2O2+H2SO4=CuSO4+2X,X的化学式为。制备过程中H2O2发生反应生成了O2 , 该反应属于(填“反应基本类型”)。
(5)、项目四:实验异常现象探究制备硫酸铜过程中开始时有少量气泡,后来反应剧烈产生大量气泡,放出热量。
【提出问题】什么因素加快了H2O2分解?
【猜想与假设】猜想一:生成的CuSO4; 猜想二:温度升高;猜想三:。
(6)、【实验探究】实验
实验一
实验二
实验三
实验四




现象
产生气泡
无明显现象
产生气泡
快速产生气泡
【实验分析】
对比实验一和实验二可以得出的结论是 , 为了验证温度升高能加快H2O2的分解,甲同学的方案是实验二和实验三对比;乙同学的方案是实验一和实验四对比。你认为同学的方案更严谨,理由是。
【实验结论】猜想三正确。
18. 第19届亚洲运动会首次使用“零碳甲醇”作为主火炬塔燃料。科研团队利用催化列MoS2实现低温、高效、长寿命催化CO2加氢制备该“零碳甲醇(CH3OH)”,其工艺流程如图所示: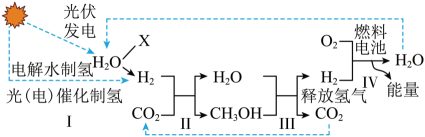 (1)、实验室检验二氧化碳常用 , 该反应方程式为。(2)、物质X的名称是。(3)、工艺流程中,反应Ⅳ燃料电池发生反应的方程式为。(4)、甲醇作为主火炬塔燃料说明甲醇具有的性质是。(5)、工艺流程中可以循环利用的物质是。(6)、电解水制氢与光催化制氢相比,光催化制氢的优点有(写一条)。19. 化学储氢材料研发是当下科技研究的热点之一。(1)、下列化学储氢材料中含氢量(氢的质量分数)最高的是____。A、NH3 B、N2H4 C、CH4(2)、我国科学家发明了一种将甲烷中的氢转化为氢气的工艺(原理如图所示)。
(1)、实验室检验二氧化碳常用 , 该反应方程式为。(2)、物质X的名称是。(3)、工艺流程中,反应Ⅳ燃料电池发生反应的方程式为。(4)、甲醇作为主火炬塔燃料说明甲醇具有的性质是。(5)、工艺流程中可以循环利用的物质是。(6)、电解水制氢与光催化制氢相比,光催化制氢的优点有(写一条)。19. 化学储氢材料研发是当下科技研究的热点之一。(1)、下列化学储氢材料中含氢量(氢的质量分数)最高的是____。A、NH3 B、N2H4 C、CH4(2)、我国科学家发明了一种将甲烷中的氢转化为氢气的工艺(原理如图所示)。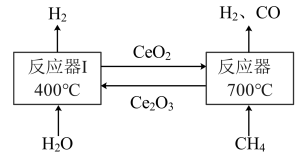
总反应的化学反应方程式为CH4+H2O=CO+3H2
①反应器I中的化学反应方程式为。
②计算:理论上0.8t甲烷与足量水蒸气反应生成氢气的总质量是多少?