广西柳州市柳北区鱼峰区2023-2024学年九年级上学期第一次期末联考化学试题
试卷更新日期:2024-03-05 类型:期末考试
一、选择题(本大题有20小题,每小题2分,共40分.每小题有四个选项,其中只有一个选项符合题意,请用2B铅笔在答题卡上将选定的选项标号涂黑)
-
1. 生活中充满着变化,下列变化属于化学变化的是( )A、葡萄酿酒 B、玻璃破碎 C、酒精挥发 D、蜡烛熔化2. 空气中含量较多且常用作保护气的是( )A、氧气 B、氮气 C、稀有气体 D、二氧化碳3. 人体每日需要摄入适量的钙,这里的“钙”指的是( )A、元素 B、单质 C、分子 D、原子4. 下列化学用语既能表示一种元素,又能表示一个原子,还能表示一种物质的是( )A、O B、Zn C、N2 D、CO5. 下列物质中属于纯净物的是( )A、洁净的空气 B、合金 C、石灰石 D、液氧6. 下列实验操作中,正确的是( )A、熄灭酒精灯
 B、加热液体
B、加热液体 C、取用固体
C、取用固体 D、振荡试管
D、振荡试管 7. 下列物质在空气或氧气中燃烧现象的描述,正确的是( )A、红磷在空气中燃烧,放出热量,产生大量白色烟雾 B、铁丝在氧气中剧烈燃烧,火星四射,放出热量,生成四氧化三铁 C、硫在氧气中燃烧,发出微弱的淡蓝色火焰,放出热量,产生没有气味的气体 D、木炭在氧气中燃烧,发出白光,放出热量,产生能使澄清石灰水变浑浊的气体8. 下列物质的性质与用途对应不正确的是( )A、木炭有可燃性——作燃料 B、金刚石硬度大——裁玻璃 C、石墨有滑腻感——制作电极 D、活性炭有吸附性——除去冰箱中的异味9. 水是人类不可缺少的宝贵资源。我国的“节水标志”是()A、
7. 下列物质在空气或氧气中燃烧现象的描述,正确的是( )A、红磷在空气中燃烧,放出热量,产生大量白色烟雾 B、铁丝在氧气中剧烈燃烧,火星四射,放出热量,生成四氧化三铁 C、硫在氧气中燃烧,发出微弱的淡蓝色火焰,放出热量,产生没有气味的气体 D、木炭在氧气中燃烧,发出白光,放出热量,产生能使澄清石灰水变浑浊的气体8. 下列物质的性质与用途对应不正确的是( )A、木炭有可燃性——作燃料 B、金刚石硬度大——裁玻璃 C、石墨有滑腻感——制作电极 D、活性炭有吸附性——除去冰箱中的异味9. 水是人类不可缺少的宝贵资源。我国的“节水标志”是()A、 B、
B、 C、
C、 D、
D、 10. 医疗上,用C-14呼气试验取代胃镜,可以无痛、快速检测幽门螺旋杆菌.已知C-14原子中质子数为6,中子数为8,则该原子核外电子数为( )A、14 B、6 C、8 D、1211. 碳酸氢钠是生活中常用的一种发酵粉,在发酵过程中会发生如下化学反应: . 下列相关说法中,错误的是( )A、该反应为分解反应 B、X的化学式为 C、生成物都是氧化物 D、碳元素的化合价未发生改变12. 螺蛳粉是柳州最具地方特色的名小吃,具有一股特殊的酸辣味,让人闻香止步.从分子角度解释,这是因为( )A、分子间有间隔 B、分子可以再分 C、分子大小发生改变 D、分子在不断运动13. 2023年“世界水日”“中国水周”活动主题为“强化依法治水,携手共护母亲河”.下列有关水的说法正确的是( )A、地球上可利用的淡水资源取之不尽,用之不竭 B、生活污水可以任意排放 C、生活中常用煮沸的方法将硬水转化成软水 D、为防止水体污染,应禁止使用农药和化肥14. 如图是碳元素“价类二维图”.图中d点对应的物质是( )
10. 医疗上,用C-14呼气试验取代胃镜,可以无痛、快速检测幽门螺旋杆菌.已知C-14原子中质子数为6,中子数为8,则该原子核外电子数为( )A、14 B、6 C、8 D、1211. 碳酸氢钠是生活中常用的一种发酵粉,在发酵过程中会发生如下化学反应: . 下列相关说法中,错误的是( )A、该反应为分解反应 B、X的化学式为 C、生成物都是氧化物 D、碳元素的化合价未发生改变12. 螺蛳粉是柳州最具地方特色的名小吃,具有一股特殊的酸辣味,让人闻香止步.从分子角度解释,这是因为( )A、分子间有间隔 B、分子可以再分 C、分子大小发生改变 D、分子在不断运动13. 2023年“世界水日”“中国水周”活动主题为“强化依法治水,携手共护母亲河”.下列有关水的说法正确的是( )A、地球上可利用的淡水资源取之不尽,用之不竭 B、生活污水可以任意排放 C、生活中常用煮沸的方法将硬水转化成软水 D、为防止水体污染,应禁止使用农药和化肥14. 如图是碳元素“价类二维图”.图中d点对应的物质是( ) A、C B、 C、 D、15. 在发生火灾时,自动灭火陶瓷砖会裂开,喷出氮气和二氧化碳,从而扑灭火焰.此陶瓷砖的灭火原理是( )A、清除可燃物 B、降低可燃物的着火点 C、使温度降到可燃物的着火点以下 D、使可燃物与氧气隔绝16. 建立模型是学习化学的重要方法,下列化学模型中表示不正确的是( )A、
A、C B、 C、 D、15. 在发生火灾时,自动灭火陶瓷砖会裂开,喷出氮气和二氧化碳,从而扑灭火焰.此陶瓷砖的灭火原理是( )A、清除可燃物 B、降低可燃物的着火点 C、使温度降到可燃物的着火点以下 D、使可燃物与氧气隔绝16. 建立模型是学习化学的重要方法,下列化学模型中表示不正确的是( )A、 B、
B、 C、
C、 D、
D、 17. “千金藤素”是我国科学家近期发现的新冠治疗新药,具有抗肿瘤、抗疟疾、抑菌、调节免疫功能等作用.它的化学式为 , 下列有关千金藤素的叙述正确的是( )A、千金藤素含有83个原子 B、千金藤素由碳原子、氢原子、氮原子和氧原子构成 C、千金藤素中碳、氢、氮、氧三种元素的质量比为 D、千金藤素碳元素所占的质量分数最大18. 2023年3月《中国科学院刊》报道了我国生物乙醇重整制氢技术的重大进展.制氢过程中某步反应的原理如图所示.下列说法正确的是( )
17. “千金藤素”是我国科学家近期发现的新冠治疗新药,具有抗肿瘤、抗疟疾、抑菌、调节免疫功能等作用.它的化学式为 , 下列有关千金藤素的叙述正确的是( )A、千金藤素含有83个原子 B、千金藤素由碳原子、氢原子、氮原子和氧原子构成 C、千金藤素中碳、氢、氮、氧三种元素的质量比为 D、千金藤素碳元素所占的质量分数最大18. 2023年3月《中国科学院刊》报道了我国生物乙醇重整制氢技术的重大进展.制氢过程中某步反应的原理如图所示.下列说法正确的是( )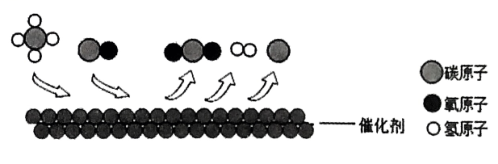 A、从反应关系看:该反应后催化剂质量减少 B、从质量关系看:该反应遵循质量守恒定律 C、从元素价态看:该反应前后氢元素的化合价不变 D、从微观构成看:甲烷是由1个碳原子和4个氢原子构成19. 下列图像能正确反映其对应关系的是( )
A、从反应关系看:该反应后催化剂质量减少 B、从质量关系看:该反应遵循质量守恒定律 C、从元素价态看:该反应前后氢元素的化合价不变 D、从微观构成看:甲烷是由1个碳原子和4个氢原子构成19. 下列图像能正确反映其对应关系的是( ) A、将水通电一段时间 B、向质量分数相同的稀盐酸中分别放入足量的粉末,充分反应 C、等质量的镁和氧气在点燃条件下充分反应 D、过氧化氢溶液与二氧化锰混合20. 密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表.关于此反应的认识正确的是( )
A、将水通电一段时间 B、向质量分数相同的稀盐酸中分别放入足量的粉末,充分反应 C、等质量的镁和氧气在点燃条件下充分反应 D、过氧化氢溶液与二氧化锰混合20. 密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表.关于此反应的认识正确的是( )物质
甲
乙
丙
丁
反应前质量(g)
9
3
22
1
反应后质量(g)
X
3
4
17
A、x的值为12 B、乙在反应中作催化剂 C、反应中丙和丁的质量比为 D、丙可能是化合物二、填空题(本大题有5小题,每个化学方程式2分,其余每空1分,共26分)
-
21. 用化学符号或用语填空:(1)、氢原子;(2)、三个硫酸根离子;(3)、氧化镁中镁元素的化合价;(4)、;(5)、 .22. 化学与生活联系密切,请回答以下问题:(1)、发现元素周期表的科学家是 .(2)、金刚石、石墨物理性质存在明显差异的原因是 .(3)、生铁和钢是两种不同的铁合金,原因是 .(4)、石油、煤和天然气都属于化石燃料,它们都属于(填“可再生”或“不可再生”)能源.(5)、香烟产生的烟气中含有一种能与人体血液中血红蛋白结合的有毒气体是 .23. 图①、②分别是钠元素、氯元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图.
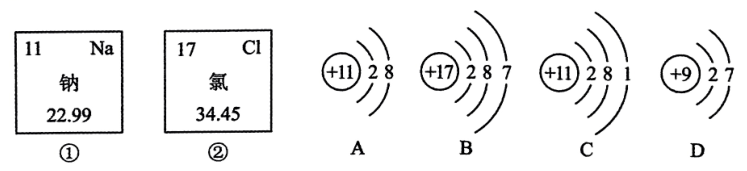
回答下列问题:
(1)、钠元素的相对原子质量为;(2)、A、B、C、D中属于同种元素的粒子是;(选填序号,下同)(3)、具有相似的化学性质的粒子是 , 原因是 .(4)、C与D形成的物质的化学式是 .24. 高速铁路,简称高铁,是指设计标准等级高、可供列车安全高速行驶的铁路系统.中国高铁列车的设计与制造技术不断突破,创造了世界最快的商业列车速度,运行里程位居世界第一.(1)、高铁列车的车体建设需要消耗大量的铝合金.铝具有很强的抗腐蚀性,其原因是 .(2)、高铁的建成,缩短出行时间,有利于减少化石燃料的使用,含硫化石燃料燃烧时排放出 , 其在空气中发生反应后生成物溶于雨水,会形成 .(3)、高铁酸钠是高铁上常用的一种“绿色环保”的消毒剂,高铁酸钠中铁元素的化合价为 .(4)、高铁全程都是无缝铁轨.当铁跟空气中的等接触容易发生化学反应而生锈.25. 已知甲、乙、丙、X、Y、Z均为初中化学常见物质,甲、乙、丙为氧化物,X、Y、Z为单质,Z为紫红色金属,其转化关系如下图所示,其中乙→Y在工业上用于冶炼生铁,部分反应物、反应条件和生成物已略去.
回答下列问题:
(1)、X的一种用途是 .(2)、Y→Z的化学方程式为 , 其基本反应类型为 .(3)、丙为有磁性的黑色固体,则X→丙的化学方程式为 .三、简答题(本大题有2小题,每个化学方程式2分,其余每空1分,共12分)
-
26. 莫高窟,俗称千佛洞,坐落在河西走廊西端的敦煌,被誉为20世纪最有价值的文化发现、“东方卢浮宫”.其以精美的壁画和塑像闻名于世.敦煌壁画就如同一座丰富的颜料标本博物馆,为我们保存了古代千百年间十余个朝代的大量彩绘艺术的颜料样品,是研究我国古代颜料发展史的重要资料.
颜色
黑色
红色
黄色
绿色
蓝色
矿物颜料
炭黑
铁红
雄黄
绿铜矿
蓝铜矿
主要成分
C
 (1)、壁画丰富绚丽的色彩可取自不同的矿物颜料.上表的矿物颜料中,属于氧化物的是 .(2)、壁画中黑色的人物轮廓历久弥新,说明常温下碳的化学性质 .(3)、中铜元素的化合价为 , 则 .(4)、雄黄是一种含砷的矿物颜料,其相对分子质量为 .(5)、不稳定,受热易发生反应生成黑色的氧化铜,请写出该反应的化学方程式 .27. 我国在全国两会上承诺,二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和,“碳捕捉技术”的流程如下,请结合图文信息,分析思考,回答下列问题:
(1)、壁画丰富绚丽的色彩可取自不同的矿物颜料.上表的矿物颜料中,属于氧化物的是 .(2)、壁画中黑色的人物轮廓历久弥新,说明常温下碳的化学性质 .(3)、中铜元素的化合价为 , 则 .(4)、雄黄是一种含砷的矿物颜料,其相对分子质量为 .(5)、不稳定,受热易发生反应生成黑色的氧化铜,请写出该反应的化学方程式 .27. 我国在全国两会上承诺,二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和,“碳捕捉技术”的流程如下,请结合图文信息,分析思考,回答下列问题: (1)、吸收器中发生的反应为 , 其中X的化学式是 .(2)、分离器的作用相当于实验室中的操作.(3)、高温反应器中发生反应的化学方程式为 , 属于基本反应类型中的 .(4)、上述过程中可循环使用的物质是(写1种).
(1)、吸收器中发生的反应为 , 其中X的化学式是 .(2)、分离器的作用相当于实验室中的操作.(3)、高温反应器中发生反应的化学方程式为 , 属于基本反应类型中的 .(4)、上述过程中可循环使用的物质是(写1种).四、实验探究题(本大题有2小题,每个化学方程式2分,其余每空1分,共16分)
-
28. 如图是实验室中常见的气体发生和收集装置.请回答下列问题:
 (1)、仪器①的名称是 .(2)、实验室用高锰酸钾制取并收集一瓶较纯净的氧气,反应的化学方程式为 , 应选用的装置组合是(填字母,下同).若收集完成后,测得氧气纯度明显偏低,原因可能是(填编号).
(1)、仪器①的名称是 .(2)、实验室用高锰酸钾制取并收集一瓶较纯净的氧气,反应的化学方程式为 , 应选用的装置组合是(填字母,下同).若收集完成后,测得氧气纯度明显偏低,原因可能是(填编号).①加热前没有进行预热 ②收集前,集气瓶中未注满水
③未见气泡连续均匀地冒出时就开始收集 ④收集后,集气瓶中仍有少量水
(3)、实验室制取二氧化碳气体时,可以选用的发生装置为;F装置可用来测量生成的气体的体积,其中在水面上放一层植物油的目的是 , 植物油上方原有的空气对实验的结果(选填“有”或“没有”)明显影响.29. 某校化学兴趣小组的同学设计以下实验对质量守恒定律进行探究,请你参与探究并填写下列空格.【提出问题】化学反应前后各物质的质量总和是否相等?
【猜想与假设】猜想1:化学反应前后各物质的质量总和相等;猜想2:化学反应前后各物质的质量总和不相等.
(1)、【实验探究】甲、乙两组同学用托盘天平分别称量反应前、后物质的质量.请回答下列问题.
甲组
乙组
实验方案


实验现象
红磷燃烧,放出热量,产生大量白烟,冷却后称量,天平指针没有偏转.
有气泡产生,天平指针向偏转(填“左”或“右”)
结论
猜想1正确
猜想2正确
(2)、【反思评价】通过讨论,同学们发现造成乙组天平不平衡的原因是 . 为了解决以上装置的问题,同学们对乙组装置进行了如下图三种改进,你认为最佳装置是(填序号).A.
 B.
B. C.
C. (3)、【得出结论】同学们利用改进后的最佳装置再次进行探究,均得出猜想1正确,即化学反应前后各物质的质量总和相等.
(3)、【得出结论】同学们利用改进后的最佳装置再次进行探究,均得出猜想1正确,即化学反应前后各物质的质量总和相等.【启示】在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在中进行.
(4)、【拓展实验】两组同学利用燃烧法来探究某种含碳元素的物质的元素组成,装置如下图.先往A中加入某种试剂a后产生氧气,往整个装置中通入一段时间氧气后再用电炉加热玻璃管使该物质样品充分燃烧,根据产物的质量确定该物质的组成.已知:B、D中的浓硫酸用于吸收水分,C中的氧化铜是确保该物质样品中的碳元素完全转化为二氧化碳,E中的氢氧化钠溶液可以吸收二氧化碳.回答下列问题:
装置a中盛放的物质是 .
(5)、F的作用是 .(6)、若准确称取样品(样品只含C、H、O三种元素中的两种或三种).经充分燃烧后,D装置增重 , E装置增重 , 则该物质样品中所含的元素为(填元素符号),质量分数最高的元素与质量分数最低的元素的原子个数比为(化成最简比).五、计算题(6分)
-
30. 为测定某电子元件材料的黄铜合金(假设合金中仅含铜、锌)中铜的质量分数,兴趣小组同学称取黄铜粉末于烧杯中,将稀盐酸平均分四次加入,充分反应,测得实验数据如下表:
项目
第一次
第二次
第三次
第四次
加入稀盐酸的质量/g
10
10
10
10
烧杯中剩余物的质量/g
19.96
29.92
39.89
m
(1)、m的值为g.(2)、求该黄铜中铜的质量分数(写出计算过程).