广西柳州市2023-2024学年九年级上学期期末质量监测化学卷
试卷更新日期:2024-03-05 类型:期末考试
一、单项选择题(本大题共20小题,每小题2分,共40分。在每小题列出的四个备选项中,只有一项符合题目要求,错选、多选或未选均不得分)
-
1. 中华文明历史悠久。《天工开物》记载的下列工艺过程中,主要发生了化学变化的是( )A、甘蔗榨汁 B、棉纱织布 C、白土烧瓷 D、楠木造船2. 下列气体排放会造成空气污染的是( )A、二氧化硫 B、水蒸气 C、氧气 D、氮气3. 各种元素在地壳的含量(质量分数)如下图,其中占48.60%的是( )
 A、铁元素 B、铝元素 C、氧元素 D、硅元素4. 下列行为不符合“低碳”理念的是( )A、按需取餐,响应“光盘行动” B、节约用电,人走关灯 C、方便省事,尽量使用一次性餐具 D、出门购物,自备购物布袋5. 下列图标中,属于“塑料包装制品回收”标志的是( )A、
A、铁元素 B、铝元素 C、氧元素 D、硅元素4. 下列行为不符合“低碳”理念的是( )A、按需取餐,响应“光盘行动” B、节约用电,人走关灯 C、方便省事,尽量使用一次性餐具 D、出门购物,自备购物布袋5. 下列图标中,属于“塑料包装制品回收”标志的是( )A、 B、
B、 C、
C、 D、
D、 6. 化学是一门以实验为基础的学科。下列实验操作中,正确的是( )A、
6. 化学是一门以实验为基础的学科。下列实验操作中,正确的是( )A、 倾倒液体
B、
倾倒液体
B、 点燃酒精灯
C、
点燃酒精灯
C、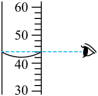 读取液体的体积
D、
读取液体的体积
D、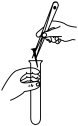 向试管中加入铁钉
7. 分类是一种重要的化学观念。下列物质属于氧化物的是( )A、 B、MgO C、NaOH D、8. 下列做法或操作不正确的是( )A、实验时碰倒了燃着的酒精灯,酒精在桌面上燃烧,立即用湿抹布盖灭 B、用试管刷刷洗试管时,须将试管刷在试管内轻轻转动或上下移动来刷洗 C、炒菜时锅中的油着火,立即用锅盖盖灭 D、电线老化短路起火,立即用水浇灭9. 催化剂在化学反应中起催化作用。下列有关催化剂的说法错误的是( )A、可以加快反应速率 B、反应前后化学性质不变 C、反应前后质量不变 D、所有反应都有催化作用10. 漂白粉的有效成分是。中Ca为+2价、O为-2价,则的化合价是( )A、-2 B、-1 C、+2 D、+111. 张青莲院士主持测定的锑、铈等元素的相对原子质量新值,被采用为国际新标准。锑元素在周期表中的信息如下图,其中“51”是( )
向试管中加入铁钉
7. 分类是一种重要的化学观念。下列物质属于氧化物的是( )A、 B、MgO C、NaOH D、8. 下列做法或操作不正确的是( )A、实验时碰倒了燃着的酒精灯,酒精在桌面上燃烧,立即用湿抹布盖灭 B、用试管刷刷洗试管时,须将试管刷在试管内轻轻转动或上下移动来刷洗 C、炒菜时锅中的油着火,立即用锅盖盖灭 D、电线老化短路起火,立即用水浇灭9. 催化剂在化学反应中起催化作用。下列有关催化剂的说法错误的是( )A、可以加快反应速率 B、反应前后化学性质不变 C、反应前后质量不变 D、所有反应都有催化作用10. 漂白粉的有效成分是。中Ca为+2价、O为-2价,则的化合价是( )A、-2 B、-1 C、+2 D、+111. 张青莲院士主持测定的锑、铈等元素的相对原子质量新值,被采用为国际新标准。锑元素在周期表中的信息如下图,其中“51”是( )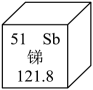 A、质子数 B、中子数 C、相对原子质量 D、质子数与中子数之和12. 下列实验现象的描述不正确的是( )A、硫在空气中燃烧,发出淡蓝色火焰 B、铁丝在氧气中燃烧,火星四射,生成红色固体 C、向呈有一定量生石灰的烧杯中加水,手触碰烧杯外壁感觉很热 D、镁在空气中燃烧,发出耀眼白光,生成一种白色固体13. 下列物质对应的化学式不正确的是( )A、干冰— B、生石灰—CaO C、臭氧— D、甲烷—14. 下列各选项中,后者是对前者的解释,解释正确的是( )A、压瘪的乒乓球受热膨胀——温度升高,分子体积变大 B、野外烧烤结束,用水将火浇灭——水降低了燃料的着火点 C、用酒精灯加热时,利用外焰给物品加热——外焰温度高 D、“真金不怕火炼”——金的熔点高,加热温度高也不会熔化15. 处理汽车尾气的某反应微观示意图如下,对该反应的下列说法不正确的是( )
A、质子数 B、中子数 C、相对原子质量 D、质子数与中子数之和12. 下列实验现象的描述不正确的是( )A、硫在空气中燃烧,发出淡蓝色火焰 B、铁丝在氧气中燃烧,火星四射,生成红色固体 C、向呈有一定量生石灰的烧杯中加水,手触碰烧杯外壁感觉很热 D、镁在空气中燃烧,发出耀眼白光,生成一种白色固体13. 下列物质对应的化学式不正确的是( )A、干冰— B、生石灰—CaO C、臭氧— D、甲烷—14. 下列各选项中,后者是对前者的解释,解释正确的是( )A、压瘪的乒乓球受热膨胀——温度升高,分子体积变大 B、野外烧烤结束,用水将火浇灭——水降低了燃料的着火点 C、用酒精灯加热时,利用外焰给物品加热——外焰温度高 D、“真金不怕火炼”——金的熔点高,加热温度高也不会熔化15. 处理汽车尾气的某反应微观示意图如下,对该反应的下列说法不正确的是( )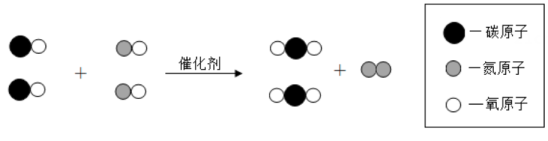 A、可以减少有毒气体的排放 B、可以减少温室气体的排放 C、该反应方程式: D、该反应遵循质量守恒定律16. 用下图装置进行实验。通入前,白磷均不燃烧;通入后,甲中白磷不燃烧,乙中白磷燃烧。下列说法不正确的是( )
A、可以减少有毒气体的排放 B、可以减少温室气体的排放 C、该反应方程式: D、该反应遵循质量守恒定律16. 用下图装置进行实验。通入前,白磷均不燃烧;通入后,甲中白磷不燃烧,乙中白磷燃烧。下列说法不正确的是( )
已知:白磷的着火点为;红磷的着火点为。
A、该实验能验证可燃物燃烧需要与接触 B、该实验能验证可燃物燃烧需要温度达到着火点 C、若将甲中的白磷换成红磷,能验证可燃物燃烧需要温度达到着火点 D、若将乙中的白磷换成红磷,能验证可燃物燃烧需要与接触17. 下列方案能够验证金属活动性:铁比铜活泼的是( )A、比较同样大小、厚度相同的铁片、铜片的硬度 B、比较同样大小、厚度相同的铁片、铜片的密度 C、将同样大小的铁片、铜片分别加入稀盐酸中,观察现象 D、将氧化铁和氧化铜分别加入稀硫酸溶液中,观察现象18. 下列实验方案能达到实验目的的是( )选项
实验目的
实验方案
A
除去铜粉中少量碳粉
在空气中充分灼烧
B
除去氧气中少量氢气
将混合气体点燃
C
探究某可燃性气体是否含有氧元素
点燃可燃性气体,在火焰上方罩一个冷而干燥的烧杯,观察是否有水雾
D
检验碳酸钙高温分解是否完全
取少量固体加入足量稀盐酸,观察是否有气泡产生
A、A B、B C、C D、D19. 乙醇()俗称酒精,可以做酒精灯、内燃机等的燃料。下列有关乙醇的说法正确的是( )A、乙醇由9个原子组成 B、乙醇的相对分子质量为46g C、乙醇中碳、氢、氧元素质量比为12:3:8 D、乙醇中碳元素的质量分数约为22.2%20. 下列图像与实验设计对应正确的有( )图像
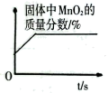
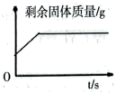

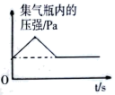
实验设计
将一定量的氯酸钾和二氧化锰混合固体加热
向一定量锌粉和铜粉的混合固体中加入足量硫酸铜溶液
向一定量的生石灰中,加入200mL水
足量红磷在密闭实验的集气瓶中燃烧
A、1项 B、2项 C、3项 D、4项二、填空题(本大题共5小题,每个化学方程式2分,其余每空1分,共26分)
-
21. 用化学用语填空。(1)、碳元素;(2)、2个氯原子;(3)、3个钠离子;(4)、三氧化硫分子;(5)、氢氧化钙。22. 化学与生活息息相关。请用下列物质的序号填空。
①肥皂水②氮气③干冰④金刚石⑤活性炭
(1)、可用于作保护气的是;(2)、可用来区分硬水与软水的是;(3)、可用于冰箱除异味的是;(4)、可用于人工降雨的是;(5)、可用来裁玻璃的是。23. 2023年5月30号“神舟十六号”太空飞船成功发射,标志着我国载人航天进入新的阶段。航天材料以及航天员的生活、工作与化学紧密相连。(1)、太阳能电池板需要使用铝合金箔片,铝合金的硬度(填“大于”或“小于”)金属铝的硬度,铝合金能够加工成箔片是利用了金属的性。(2)、太空舱的氧气主要来自于水的电解,电解时接电源(填“正极”或“负极”)的电极上产生氧气,产生氧气与氢气的体积比为。(3)、太空舱使用锂电池。Li可以通过Al与Li2O在高温下发生置换反应得到,该反应的化学方程式为。24. 能源是当今社会发展的三大支柱之一,氢能是理想的绿色能源。氢气的制取和储存是科学研究的重要方向。氢气的制取:由化石燃料制得的中含有CO,利用液氮的低温可将CO液化而分离,从而获得纯净的。
氢气的储存:物理储氢包括加压储氢和吸附储氢;化学储氢是将H2与N2在催化剂的条件下合成氨气()。
(1)、化石燃料包括煤、石油和。(2)、阅读以上知识可得,CO的沸点比的沸点。(填“高”或“低”)(3)、物理储氢将氢气压缩进储气瓶中,发生改变的是(从微观角度解释)。(4)、写出上述化学储氢的化学方程式:。25. 铝和铁是两种常见的活泼金属。(1)、铝的原子结构示意图: , 最外层电子数为 , 铝在化学反应中容易(填“得到”或“失去”)电子,但生活中铝制品不易被腐蚀,原因是。 (2)、生活中的铁制品容易被锈蚀,锈蚀过程是铁与空气中的氧气和等发生化学反应,请你给出一条保护金属资源的有效途径:。
, 最外层电子数为 , 铝在化学反应中容易(填“得到”或“失去”)电子,但生活中铝制品不易被腐蚀,原因是。 (2)、生活中的铁制品容易被锈蚀,锈蚀过程是铁与空气中的氧气和等发生化学反应,请你给出一条保护金属资源的有效途径:。三、简答题(本大题共2小题,每个化学方程式2分,其余每空1分,共12分)
-
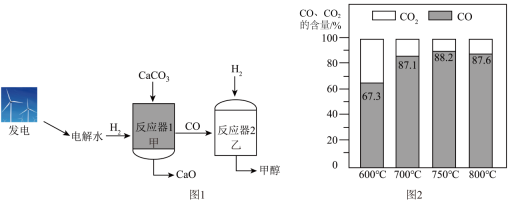
26. 工业制备氧化钙有了新的方法:电解水制氢联合碳酸钙分解制备氧化钙,能减少碳排放,助力碳中和。该新方法流程如图1所示。
 (1)、传统方法:在高温下分解产生氧化钙和(填化学式)。(2)、新方法:
(1)、传统方法:在高温下分解产生氧化钙和(填化学式)。(2)、新方法:①反应器甲:一定条件下可与反应生成CaO、CO和H2O,写出反应的化学方程式。在反应器甲中,同时有分解的副反应发生,反应器甲中CO、CO2的含量随反应温度的变化如上图2所示,为了减少的产生,最好将温度控制在℃。
②反应器乙:一定条件下,CO与发生化合反应生成甲醇(),参加反应的CO与分子个数比为。
(3)、与传统方法相比,新方法的优点有(写一条)。27. 工厂废水必须经过处理,达标才能排放。某工厂的废水含有硫酸亚铁、硫酸铜和少量硫酸,工厂将对该废水进行处理,并从中制得四氧化三铁和回收某种金属。其工艺设计流程如图: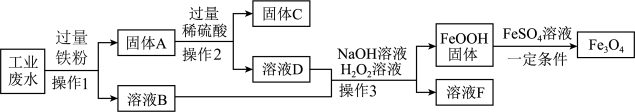
按要求回答下列问题:
(1)、操作2的名称是 , 在实验室进行该操作需要的玻璃仪器有烧杯、漏斗和。(2)、固体C是回收的金属,其成分是 , “溶液F”中主要溶质的化学式是。(3)、写出向固体A中加入过量稀硫酸反应的化学方程式:。四、实验探究题(本大题共2小题,每个化学方程式2分,其余每空1分,共16分)
-
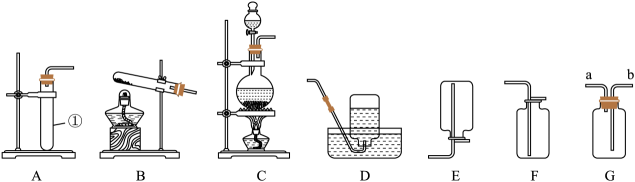
28. 根据下列装置回答问题:
 (1)、仪器①名称是。(2)、实验室用石灰石和稀盐酸制取二氧化碳选用的发生装置是(填装置字母序号),常用于收集二氧化碳的装置是(从D、E、F中选)。(3)、实验室用装置B制取氧气,反应的化学方程式是。可以用装置D收集氧气的原因是 , 当观察到时,表示氧气已收集满。(4)、氯气是一种黄绿色、密度大于空气、能溶于水的有毒气体,常用装置G收集氯气,气体应该从(填字母序号)端通入。29. 化学兴趣小组在实验室依照课本的实验方案,用木炭粉和氧化铜粉末在加热条件下反应制取单质铜。他们联想到碳在氧气中燃烧可能生成二氧化碳也可能生成一氧化碳,提出对木炭与氧化铜反应生成的气体成分进行探究。(1)、[提出猜想]
(1)、仪器①名称是。(2)、实验室用石灰石和稀盐酸制取二氧化碳选用的发生装置是(填装置字母序号),常用于收集二氧化碳的装置是(从D、E、F中选)。(3)、实验室用装置B制取氧气,反应的化学方程式是。可以用装置D收集氧气的原因是 , 当观察到时,表示氧气已收集满。(4)、氯气是一种黄绿色、密度大于空气、能溶于水的有毒气体,常用装置G收集氯气,气体应该从(填字母序号)端通入。29. 化学兴趣小组在实验室依照课本的实验方案,用木炭粉和氧化铜粉末在加热条件下反应制取单质铜。他们联想到碳在氧气中燃烧可能生成二氧化碳也可能生成一氧化碳,提出对木炭与氧化铜反应生成的气体成分进行探究。(1)、[提出猜想]木炭与氧化铜反应生成的气体成分可能有三种情况:
猜想1:只有CO
猜想2:
猜想3:CO和
(2)、[查阅资料]浸有磷钼酸溶液的氯化钯试纸遇到不变色,但遇微量CO立即变为蓝色,所发生反应的化学方程式:
[实验设计] 实验装置如图(夹持仪器没有画)
[实验步骤]①打开弹簧夹,先通一会儿干燥纯净的氮气;②关闭弹簧夹,点燃酒精灯,加热固体混合物;③加热数分钟后,观察到装置A直管中黑色固体变红……④实验结束。
[结论及讨论]步骤①的目的是。(3)、观察到的现象是:装置B中和装置C中 , 得出结论猜想3正确。(4)、B、C装置能否交换位置,其原因是。(5)、甲同学提出:上述实验设计从环保角度考虑,还存在不足之处,请提出一种解决方案。(6)、同学们进一步实验,测定产生的CO与质量比为14:11,写出装置A中的总化学方程式。五、计算题(6分)
-
30. 某实验小组测定一份部分被氧化的镁粉中镁的百分含量:将100g稀盐酸加入装有8.0g部分被氧化的镁粉中,充分反应,固体完全溶解,实验及数据如下图所示。
 (1)、生成氢气的质量为g;(2)、计算镁的质量分数(写出计算过程)。
(1)、生成氢气的质量为g;(2)、计算镁的质量分数(写出计算过程)。