【备考2024年】高考化学广东卷真题变式分层精准练(第19题)
试卷更新日期:2024-02-26 类型:二轮复习
一、真题重现
-
1. 配合物广泛存在于自然界,且在生产和生活中都发挥着重要作用。(1)、某有机物能与形成橙红色的配离子 , 该配离子可被氧化成淡蓝色的配离子。
①基态的电子轨道表示式为。
②完成反应的离子方程式:
(2)、某研究小组对(1)中②的反应进行了研究。用浓度分别为的溶液进行了三组实验,得到随时间t的变化曲线如图。
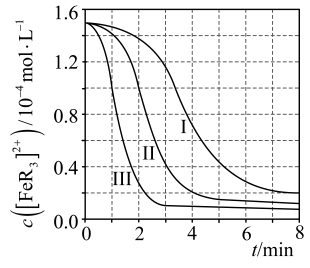
①时,在内,的平均消耗速率=。
②下列有关说法中,正确的有。
A.平衡后加水稀释,增大
B.平衡转化率:
C.三组实验中,反应速率都随反应进程一直减小
D.体系由橙红色转变为淡蓝色所需时间:
(3)、R的衍生物L可用于分离稀土。溶液中某稀土离子(用M表示)与L存在平衡:研究组配制了L起始浓度与L起始浓度比不同的系列溶液,反应平衡后测定其核磁共振氢谱。配体L上的某个特征H在三个物种中的化学位移不同,该特征H对应吸收峰的相对峰面积S(体系中所有特征H的总峰面积计为1)如下表。
0
1.00
0
0
a
x
0.64
b
0.40
0.60
【注】核磁共振氢谱中相对峰面积S之比等于吸收峰对应H的原子数目之比;“”表示未检测到。
①时, 。
②时,平衡浓度比。
(4)、研究组用吸收光谱法研究了(3)中M与L反应体系。当时,测得平衡时各物种随的变化曲线如图。时,计算M的平衡转化率(写出计算过程,结果保留两位有效数字)。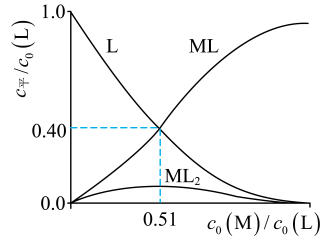
二、能力提升
-
2. 通过电化学、热化学等方法,将CO2转化为HCOOH等化学品,是实现“双碳”目标的途径之一。
请回答:
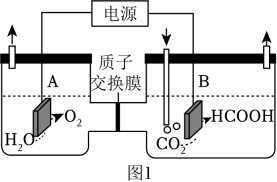
(1)、某研究小组采用电化学方法将CO2转化为HCOOH,装置如图1。电极B上的电极反应式是 。(2)、该研究小组改用热化学方法,相关热化学方程式如下:Ⅰ:C(s)+O2(g)═CO2(g)
ΔH1=﹣393.5kJ•mol﹣1
Ⅱ:C(s)+H2(g)+O2(g)═HCOOH(g)
ΔH2=﹣378.7kJ•mol﹣1
Ⅲ:CO2(g)+H2(g)⇌HCOOH(g)
ΔH3
①ΔH3=kJ•mol﹣1。
②反应Ⅲ在恒温、恒容的密闭容器中进行,CO2和H2的投料浓度均为1.0mol•L﹣1 , 平衡常数K=2.4×10﹣8 , 则CO2的平衡转化率为 。
③用氨水吸收HCOOH,得到1.00mol•L﹣1氨水和0.18mol•L﹣1甲酸铵的混合溶液,298K时该混合溶液的pH=。[已知:298K时,电离常数Kb(NH3•H2O)=1.8×10﹣5、Ka(HCOOH)=1.8×10﹣4]
(3)、为提高效率,该研究小组参考文献优化热化学方法,在如图密闭装置中充分搅拌催化剂M的DMSO(有机溶剂)溶液,CO2和H2在溶液中反应制备HCOOH,反应过程中保持CO2(g)和H2(g)的压强不变,总反应CO2+H2⇌HCOOH的反应速率为v,反应机理如下列三个基元反应,各反应的活化能E2<E1<<E3(不考虑催化剂活性降低或丧失)。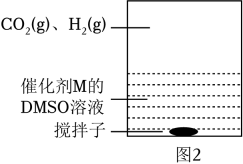
Ⅳ:M+CO2⇌Q
E1
Ⅴ:Q+H2⇌L
E2
Ⅴ:L⇌M+HCOOH
E3
①催化剂M足量条件下,下列说法正确的是 ____。
A、v与CO2(g)的压强无关 B、v与溶液中溶解H2的浓度无关 C、温度升高,v不一定增大 D、在溶液中加入N(CH2CH3)3 , 可提高CO2转化率(4)、②实验测得:298K,p(CO2)=p(H2)=2MPa下,v随催化剂M浓度c变化如图3。c⩽c0时,v随c增大而增大:c>c0时,v不再显著增大。请解释原因。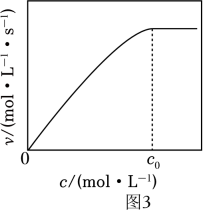 3. 研究化学反应中的能量和速率变化对生产、生活有着重要意义。(1)、I.某些常见化学键的键能(将气体分子AB断裂为中性气态原子A和B所需的能量或A和B合成1molAB气体所放出的能量)数据如下表:
3. 研究化学反应中的能量和速率变化对生产、生活有着重要意义。(1)、I.某些常见化学键的键能(将气体分子AB断裂为中性气态原子A和B所需的能量或A和B合成1molAB气体所放出的能量)数据如下表:
完全燃烧生成和气态水放出的能量为kJ。该反应中反应物的总能量(填“>”、“<”或“=”)生成物的总能量。化学键
键能/()
414
803
463
498
(2)、II.实验室模拟热气循环法合成尿素,与在一定条件下发生反应:。为了验证反应温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
实验编号
初始浓度/()
初始浓度/()
催化剂的比表面积/()
①
280
82
②
③
350
a
82
控制变量是科学研究的重要方法,因此表中数据: , 。
(3)、对比实验①③,目的是验证(填“反应温度”或“催化剂的比表面积”)对化学反应速率的影响规律。(4)、一定温度下,向1L密闭容器中充入和发生反应: , 若起始压强为 , 反应2min后该反应达到化学平衡状态,平衡时的压强是起始时的0.8倍,则0~2min内, , 的平衡转化率为%。(5)、下列情况中,一定能说明上述反应达到平衡的是____(填标号)。A、的体积分数保持不变 B、反应体系中气体的密度保持不变 C、反应消耗 , 同时生成 D、的质量保持不变(6)、“碳呼吸电池”是一种新型化学电源,其工作原理如图。当得到时,电路中转移的电子的物质的量为mol。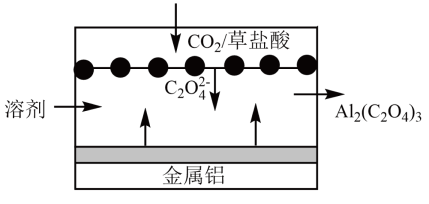
三、模拟演练
-
4. 2023年杭州亚运会开幕式首次使用“零碳甲醇”作为主火炬塔燃料。(1)、分子中O的杂化轨道类型为。(2)、以为原料加氢可以合成甲醇 , 该反应能量变化如右图。
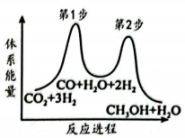
①第步(填“1”或“2”)是上述反应的决速步。
②恒容时,下列措施中能使该平衡体系中增大且加快化学反应速率的是(填字母)。
A.充入He(g),使体系压强增大 B.升高温度
C.将从体系中分离出去 D.再充入
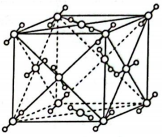
③干冰()的晶胞结构如图所示,若该晶胞边长为apm,则干冰晶体的密度为。(已知:;表示阿伏加德罗常数的值)
 (3)、在体积为1L的恒容密闭容器中,充入和 , 一定条件下发生反应: , 测得浓度随时间的变化:
(3)、在体积为1L的恒容密闭容器中,充入和 , 一定条件下发生反应: , 测得浓度随时间的变化:时间/min
0
3
5
10
15
浓度
0
0.3
0.45
0.5
0.5
测得该条件下平衡时体系的压强为P,求该反应的(物质的分压=总压×物质的量分数)。
(4)、可催化的氢化,体系中产生和CO。现将一定比例的、以一定流速通过催化剂,某温度下,得到的转化率、或CO的选择性[]与催化剂中NiO质量分数的关系图:
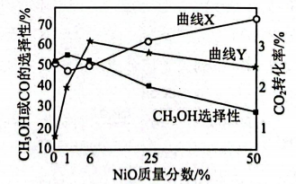
①曲线(填“X”或“Y”)表示的转化率随催化剂中NiO的质量分数的变化。
②有利于提高选择性的反应条件是(填标号)。
A.减小压强 B.使用更合适的催化剂 C.原料气中掺入适量的CO
5. 我国加氢制甲醇技术取得了大突破,对解决能源紧缺和环境问题具有重要意义。(1)、铜基催化剂制甲醇其主要反应如下:Ⅰ.合成甲醇:;;
Ⅱ.逆水煤气反应:;;
Ⅲ.成气合成甲醇:;;
回答下列问题:
①基态的3d电子轨道表示式为。
② , (用 , 表示)。
(2)、若时将6mol 和8mol 充入容积为2L的密闭容器中只发生反应Ⅰ: , 的物质的量变化如上表所示。物质的量/mol
/℃
/℃
0
5min
10min
15min
20min
25min
30min
8.0
3.5
2.0
2.0
1.7
1.5
1.5
①在℃条件下5-10min内,以表示的该反应速率 , 该条件下的平衡常数K=。
②下列说法正确的是。
A.
B.混合气体的密度保持不变时,说明反应Ⅰ已达到平衡
C.平衡时向容器中充入惰性气体,反应Ⅰ的平衡正向移动
D.加入适当催化剂,可加快反应速率
(3)、某研究小组对催化剂材料进行了研究。下列四组实验,控制和初始投料比均为1∶2.2,经过相同反应时间( min)温度(K)
催化剂
转化率(%)
甲醇选择性(%)
综合选项
543
Cu/ZnO纳米棒材料
12.3
42.3
A
543
Cu/ZnO纳米片材料
11.9
72.7
B
553
Cu/ZnO纳米棒材料
15.3
39.1
C
553
Cu/ZnO纳米片材料
12.0
71.6
D
由表格中的数据可知,相同温度下不同的催化剂对的转化为的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为(填字母符号)。
(4)、在p=4.00MPa、原料气、合适催化剂的条件下发生反应,温度对转化率、产率、选择性的影响如图所示。已知:的选择性。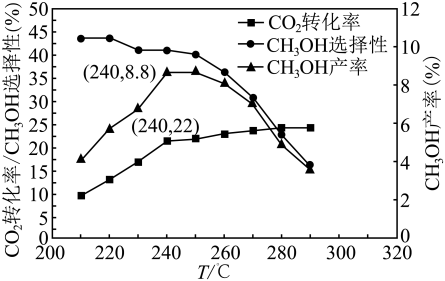
①转化率随温度升高而增大的原因可能是。
②选择性随温度升高而减小的原因可能是。
6. 丙烷价格低廉且产量大,而丙烯及其衍生物具有较高的经济附加值,因此丙烷脱氢制丙烯具有重要的价值。回答下列问题:(1)、已知下列反应的热化学方程式:①直接脱氢:
②
计算氧化丙烷脱氢反应③的。
(2)、已知下列键能数据,结合反应①数据,计算的键能是。化学键
键能
347.7
413.4
436.0
(3)、一定条件下,反应①中丙烷平衡转化率与平衡常数的关系可表示为: , 式中为系统总压。分别为和时,丙烷平衡转化率与温度的关系如图所示,其中表示下的关系曲线是(填“Ⅰ”或“Ⅱ”)。时,(保留2位有效数字)。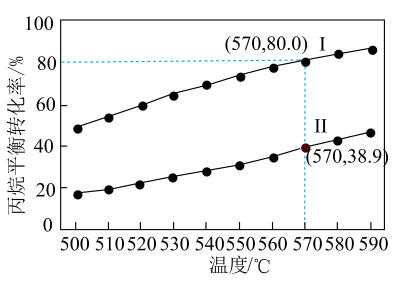 (4)、研究人员利用作催化剂,对反应③的机理开展研究。以和为原料,初期产物中没有检测到;以含有的和为原料,反应过程中没有检测到。下列推断合理的是____(填标号)。A、先吸附氧气,吸附的氧气直接与吸附的丙烷反应 B、直接氧化吸附的丙烷,吸附的氧气补充中反应掉的氧 C、催化丙烷脱氢过程中,碳氢键的断裂是可逆的(5)、研究人员尝试利用氧化丙烷脱氢制丙烯,与氧化丙烷脱氢制丙烯相比,使用的优点有(写出两点即可)。(6)、一种基于的锌基催化剂,可高效催化丙烷转化为丙烯。立方的晶胞如图,晶胞参数为与间的最小距离为 , 晶体密度为(列出计算式,阿伏加德罗常数的值为)。
(4)、研究人员利用作催化剂,对反应③的机理开展研究。以和为原料,初期产物中没有检测到;以含有的和为原料,反应过程中没有检测到。下列推断合理的是____(填标号)。A、先吸附氧气,吸附的氧气直接与吸附的丙烷反应 B、直接氧化吸附的丙烷,吸附的氧气补充中反应掉的氧 C、催化丙烷脱氢过程中,碳氢键的断裂是可逆的(5)、研究人员尝试利用氧化丙烷脱氢制丙烯,与氧化丙烷脱氢制丙烯相比,使用的优点有(写出两点即可)。(6)、一种基于的锌基催化剂,可高效催化丙烷转化为丙烯。立方的晶胞如图,晶胞参数为与间的最小距离为 , 晶体密度为(列出计算式,阿伏加德罗常数的值为)。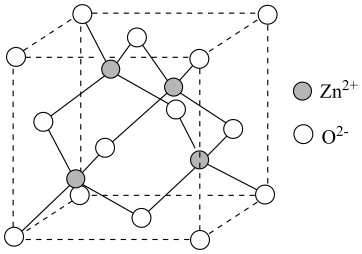
-