【备考2024年】高考化学广东卷真题变式分层精准练(第18题)
试卷更新日期:2024-02-26 类型:二轮复习
一、真题重现
-
1. 均是重要的战略性金属。从处理后的矿石硝酸浸取液(含)中,利用氨浸工艺可提取 , 并获得高附加值化工产品。工艺流程如下:
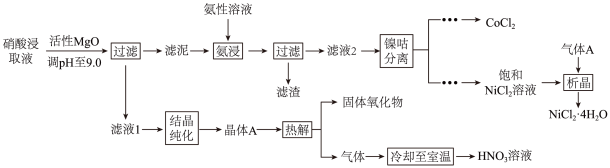
已知:氨性溶液由、和配制。常温下,与形成可溶于水的配离子:;易被空气氧化为;部分氢氧化物的如下表。
氢氧化物
回答下列问题:
(1)、活性可与水反应,化学方程式为。(2)、常温下,的氨性溶液中, (填“>”“<”或“=”)。(3)、“氨浸”时,由转化为的离子方程式为。(4)、会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了的明锐衍射峰。①属于(填“晶体”或“非晶体”)。
②提高了的浸取速率,其原因是。
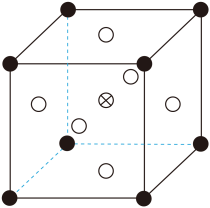
(5)、①“析晶”过程中通入的酸性气体A为。②由可制备晶体,其立方晶胞如图。与O最小间距大于与O最小间距,x、y为整数,则在晶胞中的位置为;晶体中一个周围与其最近的O的个数为。
 (6)、①“结晶纯化”过程中,没有引入新物质。晶体A含6个结晶水,则所得溶液中与的比值,理论上最高为。
(6)、①“结晶纯化”过程中,没有引入新物质。晶体A含6个结晶水,则所得溶液中与的比值,理论上最高为。②“热解”对于从矿石提取工艺的意义,在于可重复利用和(填化学式)。
二、基础巩固
-
2. 实验室合成高铁酸钾()的过程如下图所示。下列说法错误的是( )
 A、气体a的主要成分为 B、沉淀b的主要成分为 C、中的化合价为 D、反应2为3. 实验小组用过量溶液处理覆铜板得到浸出液,并对其中的物质进行回收,流程如下。下列有关说法正确的是( )
A、气体a的主要成分为 B、沉淀b的主要成分为 C、中的化合价为 D、反应2为3. 实验小组用过量溶液处理覆铜板得到浸出液,并对其中的物质进行回收,流程如下。下列有关说法正确的是( )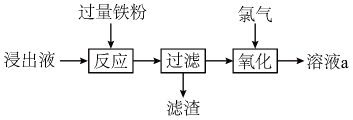 A、浸出液呈中性 B、滤渣只有铜粉 C、用KSCN溶液检验是否“氧化”完全 D、溶液a回收后可用于处理覆铜板4. 某化工厂制备净水剂硫酸铁铵晶体【NH4Fe(SO4)2·6H2O】的一种方案如下:
A、浸出液呈中性 B、滤渣只有铜粉 C、用KSCN溶液检验是否“氧化”完全 D、溶液a回收后可用于处理覆铜板4. 某化工厂制备净水剂硫酸铁铵晶体【NH4Fe(SO4)2·6H2O】的一种方案如下:
下列说法不正确的是( )
A、滤渣A的主要成分是CaSO4 B、“合成”反应要控制温度,温度过高,产率会降低 C、“系列操作”包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等 D、相同条件下,NH4Fe(SO4)2·6H2O净水能力比FeCl3强三、能力提升
-
5. 钴属于稀缺性金属。利用“微波辅助低共熔溶剂”浸取某废旧锂离子电池中钴酸锂粗品制备产品,实现资源的循环利用。主要工艺流程如下:

已知:①氯化胆碱是一种铵盐;
②在溶液中常以(蓝色)和(粉红色)形式存在;
③时,。
回答下列问题:
(1)、中的化合价为。(2)、下图为“微波共熔”中氯化胆碱-草酸和粗品以不同的液固比在下微波处理后锂和钴的浸取率图,则最佳液固比为。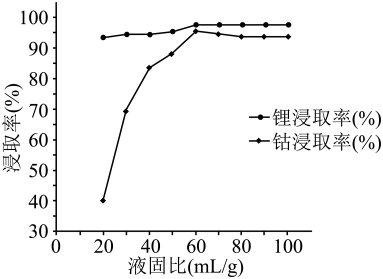 (3)、“水浸”过程中溶液由蓝色变为粉红色,该变化的离子方程式为。(4)、时,“沉钴”反应完成后,溶液 , 此时。(5)、“滤饼2”在高温烧结前需要洗涤、干燥,检验“滤饼2”是否洗涤干净的操作及现象是。(6)、“高温烧结”中需要通入空气,其作用是。(7)、锂离子电池正极材料在多次充放电后由于可循环锂的损失,结构发生改变生成 , 导致电化学性能下降。
(3)、“水浸”过程中溶液由蓝色变为粉红色,该变化的离子方程式为。(4)、时,“沉钴”反应完成后,溶液 , 此时。(5)、“滤饼2”在高温烧结前需要洗涤、干燥,检验“滤饼2”是否洗涤干净的操作及现象是。(6)、“高温烧结”中需要通入空气,其作用是。(7)、锂离子电池正极材料在多次充放电后由于可循环锂的损失,结构发生改变生成 , 导致电化学性能下降。①晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为(用离子符号表示)。
②使用和溶液可以实现的修复,则修复过程中的化学反应方程式为。
 6. 废旧太阳能电池ClGS具有较高的回收利用价值,其主要组成为Culn0.5Ca0.5Se2。某探究小组回收处理流程如图:
6. 废旧太阳能电池ClGS具有较高的回收利用价值,其主要组成为Culn0.5Ca0.5Se2。某探究小组回收处理流程如图: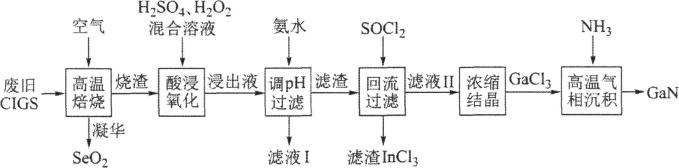
回答下列问题:
(1)、硒(Se)与硫为同族元素,Se的最外层电子数为;在化合物Culn0.5Ca0.5Se2中镓(Ga)和铟(In)均为+3价,则Cu的化合价为。(2)、“酸浸氧化”得蓝色溶液,则该过程发生的主要氧化还原反应的化学方程式为。(3)、氢氧化铜沉淀可溶于氨水,则滤液I中的阴离子主要有和两种。(4)、滤渣加入SOCl2混合前需要洗涤、干燥,并用试剂和来检验滤渣中的是否洗净。(5)、滤渣加入SOCl2可反生反应:2In(OH)3+3SOCl2=2InCl3+3X;对物质X的性质有如下判断,你认为不正确的是____。
A、有弱酸性 B、可使溴水褪色 C、与CaCl2溶液反应得白色沉淀 D、与烧碱溶液反应可生成两种盐(6)、“高温气相沉积”过程中发生的化学反应方程式为。7. 金属铼广泛用于航空航天等领域.工业上用富铼渣(铼元素主要以形式存在,砷主要以形式存在)制取铼粉.工艺流程如下:
已知:常温下;为第四周期第ⅤA族元素;高铼酸铵微溶于冷水,易溶于热水.
回答下列问题:
(1)、的简化电子排布式为 .(2)、“氧化”时铼转化为强酸高铼酸 . “滤渣1”的主要成分是硫单质.写出“氧化”时发生反应的离子方程式: .(3)、综合考虑,富铼渣“氧化”中浸出温度选择为宜,原因是 .(4)、常温下,“反萃取”得到高铼酸铵溶液的 , 则溶液中(填“>”“<”或“=”).(5)、“析晶”得到的主要产品是 . 提纯粗高铼酸铵固体的方法是 , 图1是的X射线衍射图谱,则属于(填“晶体”或“非晶体”).
图1:高铼酸铵谱 图2
(6)、“热解”产生可再生循环利用的物质是 .(7)、已知的立方晶胞如图2,则在晶胞中的位置为;晶体中一个周围与其最近的O的个数为 .四、模拟演练
-
8. 以软锰矿与黄铁矿为主要原料制备高品质的工艺流程:

已知:①软锰矿与黄铁矿的主要成分分别为、 , 还均含少量Fe、Ca、Mg、Al、Si等元素的氧化物;
②该工艺条件下,相关金属离子形成氢氧化物沉淀的pH:
金属离子
开始沉淀的pH
6.9
1.9
6.6
9.1
3.4
沉淀完全()的pH
8.3
3.2
10.1
10.9
4.7
回答下列问题:
(1)、基态的价层电子排布图为。(2)、“酸浸”过程中,为提高反应速率可以采取的措施有(写一条)。(3)、“酸浸”加入后,主要反应的离子方程式:滤渣1的主要成分为S、 , 加入后迅速产生大量气泡,可减少滤渣1在矿粉表面的附着,有利于酸浸。分析迅速产生气泡的原因:。
(4)、“调pH”操作中需调节溶液pH范围为4.7~6.0,此时滤渣2的主要成分为(填化学式)。(5)、“沉锰”步骤发生主要反应的离子方程式为。(6)、利用惰性电极电解体系获得的机理如左图所示,硫酸浓度与电流效率η的关系如右图所示。硫酸浓度超过时,电流效率η降低的原因是。() 9. 五氧化二钒()广泛用作合金添加剂及有机化工催化剂。从废钒催化剂(含有、及少量、等杂质)回收的部分工艺流程如下:
9. 五氧化二钒()广泛用作合金添加剂及有机化工催化剂。从废钒催化剂(含有、及少量、等杂质)回收的部分工艺流程如下: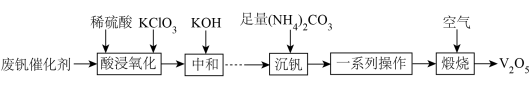
已知:
①可溶于热水,不溶于乙醇;
②常温下,部分含钒物质在水中的溶解性见下表;
物质
溶解性
难溶
可溶
易溶
难溶
③+5价钒在溶液中的主要存在形式与溶液pH的关系见下表;
pH
<6
6~8
8~10
10~12
主要离子
回答下列问题:
(1)、“一系列操作”包括过滤、洗涤、干燥等,洗涤时最好选用的试剂为____(填字母)。A、冷水 B、热水 C、乙醇 D、NaOH溶液(2)、“中和”时调节pH为7的目的,一是将转化为;二是。(3)、“沉钒”前需将溶液先进行“离子交换”和“洗脱”,再加入生成“离子交换”和“洗脱”两步操作可简单表示为:(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈(填“酸性”或“碱性”),理由是。(4)、“沉钒”析出的晶体需要洗涤,证明已洗涤干净的实验操作及现象为。(5)、写出“煅烧”中发生反应的化学方程式。(6)、钒(V)的某种氧化物的晶胞结构如图所示。该晶体的化学式为。 10. 某钴土矿主要含有镍、钴、铁、铝、钙、硅等元素的氧化物,一种综合回收利用钴土矿的部分流程如下:
10. 某钴土矿主要含有镍、钴、铁、铝、钙、硅等元素的氧化物,一种综合回收利用钴土矿的部分流程如下:
已知:①25℃时,相关金属离子形成氢氧化物沉淀的范围如下:
金属离子
开始沉淀的
6.3
1.8
3.4
6.9
7.1
沉淀完全的
8.3
3.2
4.7
8.9
9.1
②氧化前后,溶液中、元素的化合价均为+2价。
(1)、“酸浸”时,滤渣的主要成分为(填化学式)。(2)、“除铁、铝”时,应控制溶液范围为 , 使用溶液可将滤渣2中铁、铝元素分离,涉及化学方程式为。(3)、“沉钴”时,滤渣3的成分为亚硝酸钴钾 , 同时有无色气体(遇空气变为红棕色)生成,写出“沉钴”步骤的离子方程式。(4)、亚硝酸钴钾的中心离子的配位数为 , 配体中配位原子的杂化方式为。(5)、的一种氧化物是重要的化工原料。晶体为尖晶石结构,其晶胞结构如下图所示。已知晶胞边长为 , 设为阿伏加德罗常数的值,则该晶体中与的个数比为 , 晶体的密度为(列出计算式)。 11. 钢渣是钢铁行业的固体废弃物,含有和等物质。一种以钢渣粉为原料固定并制备的工艺流程如图所示。
11. 钢渣是钢铁行业的固体废弃物,含有和等物质。一种以钢渣粉为原料固定并制备的工艺流程如图所示。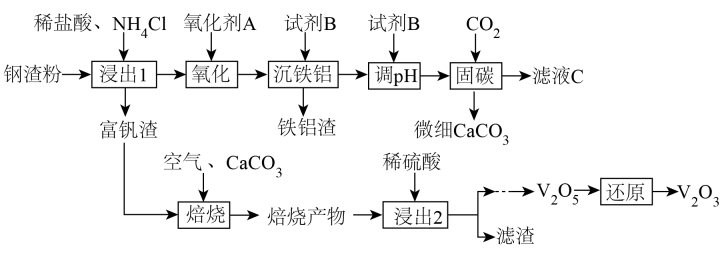
已知钢渣中元素质量分数为在稀盐酸和混合溶液中不易被浸出。该工艺条件下,有关金属离子开始沉淀和沉淀完全的如下表所示:
金属离子
开始沉淀的
1.9
7.2
3.5
12.4
沉淀完全的
2.9
8.2
5.1
13.8
回答下列问题:
(1)、浸出1过程生成的“包裹”在钢渣表面形成固体膜,阻碍反应物向钢渣扩散。提高浸出率的措施有(除粉碎外,举1例)。该浸出过程不使用稀硫酸代替稀盐酸的原因是。(2)、为避免引入杂质离子,氧化剂应为(举1例)。(3)、滤液的溶质可循环利用,试剂应为。(4)、若的浸出率为 , 理论上1吨钢渣在“固碳”中可固定。(5)、富钒渣焙烧可生成钒钙盐,不同钒钙盐的溶解率随变化如图所示。已知浸出2的pH约为2.5,则应控制焙烧条件使该钒钙盐为。该培烧反应的化学方程式是。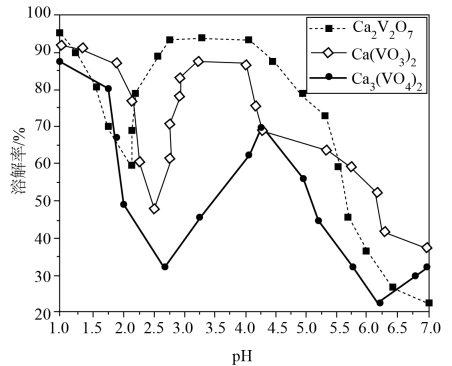 (6)、微细碳酸钙广泛应用于医药、食品等领域,某种碳酸钙晶胞如图所示。已知 , 该晶体密度为(列出计算式,阿伏加德罗常数的值为)。
(6)、微细碳酸钙广泛应用于医药、食品等领域,某种碳酸钙晶胞如图所示。已知 , 该晶体密度为(列出计算式,阿伏加德罗常数的值为)。
-