【备考2024年】高考化学广东卷真题变式分层精准练(第15题)
试卷更新日期:2024-02-26 类型:二轮复习
一、真题重现
-
1. 催化剂Ⅰ和Ⅱ均能催化反应。反应历程(下图)中,M为中间产物。其它条件相同时,下列说法不正确的是( )
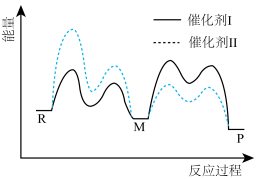 A、使用Ⅰ和Ⅱ,反应历程都分4步进行 B、反应达平衡时,升高温度,R的浓度增大 C、使用Ⅱ时,反应体系更快达到平衡 D、使用Ⅰ时,反应过程中M所能达到的最高浓度更大
A、使用Ⅰ和Ⅱ,反应历程都分4步进行 B、反应达平衡时,升高温度,R的浓度增大 C、使用Ⅱ时,反应体系更快达到平衡 D、使用Ⅰ时,反应过程中M所能达到的最高浓度更大二、基础巩固
-
2. 化学“暖手袋”是充满过饱和醋酸钠溶液的密封塑胶袋,袋内置有一个合金片,当合金片轻微震动使溶质结晶,该过程放热,下列说法正确的是( )A、醋酸钠溶液属于强电解质 B、可以利用醋酸与NaHCO3溶液反应制备醋酸钠溶液 C、化学“暖手袋”工作过程中发生了化学变化 D、所有物质溶解过程均吸热,结晶过程均放热3. 肼()是一种含氢量高的燃料。向恒容密闭容器内加入 , 一定条件下体系中存在以下平衡:I.Ⅱ.不同温度下达到平衡时,均几乎完全分解,分解产物的物质的量如图。下列说法正确的是( )
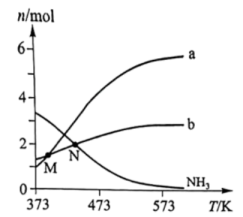 A、曲线a对应的物质是 B、低于M点对应温度时,以反应Ⅰ为主 C、体系中还存在 D、N点时,体系内为3:44. 某化学反应X+Y→Z分两步进行:①X→M;②M+Y→Z。其能量变化如图所示。下列说法正确的是( )
A、曲线a对应的物质是 B、低于M点对应温度时,以反应Ⅰ为主 C、体系中还存在 D、N点时,体系内为3:44. 某化学反应X+Y→Z分两步进行:①X→M;②M+Y→Z。其能量变化如图所示。下列说法正确的是( )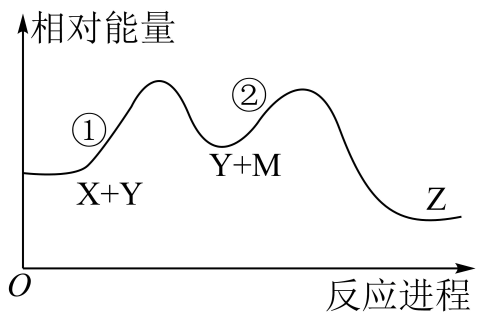 A、M是总反应的催化剂 B、总反应是理想的绿色化学反应 C、反应①②和总反应都是放热反应 D、反应物(X和Y)的总能量低于产物(Z)的总能量
A、M是总反应的催化剂 B、总反应是理想的绿色化学反应 C、反应①②和总反应都是放热反应 D、反应物(X和Y)的总能量低于产物(Z)的总能量三、能力提升
-
5. 氢气与氮气在固体催化剂表面合成氨的过程如下图所示。

① ② ③ ④ ⑤
下列说法错误的是( )
A、②→③释放能量 B、为了提高氨的脱附速率,应适时地将氨从反应后的混合气体中分离出来 C、该过程中包含旧化学键的断裂和新化学键的生成 D、该催化剂可提高单位时间生成物的产率6. 我国科学家团队打通了温和条件下草酸二甲酯催化加氢制乙二醇的技术难关,反应为.如图所示,在恒容密闭容器中,反应温度为时,和随时间的变化分别为曲线Ⅰ和Ⅱ,反应温度为时,随时间的变化为曲线Ⅲ.下列判断正确的是( )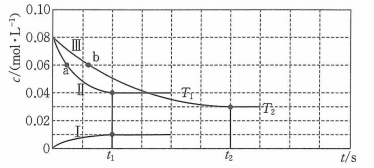 A、 B、a、b两时刻生成乙二醇的速率: C、在温度下,反应在内的平均速率为 D、其他条件相同,在温度下,起始时向该容器中充入一定量的氮气,则反应达到平衡的时间小于7. 汽车尾气中NO产生的反应为 。一定条件下,等物质的量和在恒容密闭容器中反应,曲线a表示该反应在温度T下随时间(t)的变化,曲线b表示该反应在某一起始条件改变时随时间(t)的变化。下列叙述不正确的是( )
A、 B、a、b两时刻生成乙二醇的速率: C、在温度下,反应在内的平均速率为 D、其他条件相同,在温度下,起始时向该容器中充入一定量的氮气,则反应达到平衡的时间小于7. 汽车尾气中NO产生的反应为 。一定条件下,等物质的量和在恒容密闭容器中反应,曲线a表示该反应在温度T下随时间(t)的变化,曲线b表示该反应在某一起始条件改变时随时间(t)的变化。下列叙述不正确的是( )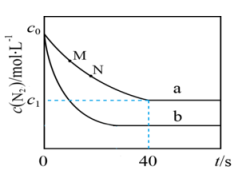 A、温度T下、0-40s内 B、曲线b对应的条件改变可能是充入氧气 C、M点小于N点 D、若曲线b对应的条件改变是升高温度,则8. 有氧条件下,在Fe基催化剂表面,NH3还原NO的反应机理如图所示。该反应能够有效脱除烟气中的NO。下列说法正确的是( )
A、温度T下、0-40s内 B、曲线b对应的条件改变可能是充入氧气 C、M点小于N点 D、若曲线b对应的条件改变是升高温度,则8. 有氧条件下,在Fe基催化剂表面,NH3还原NO的反应机理如图所示。该反应能够有效脱除烟气中的NO。下列说法正确的是( ) A、在酸性配位点上,NH3与H+通过离子键形成NH4+ B、增大压强有利于NO与O2吸附在Fe3+配位点上形成NO2 C、反应物NH3和生成物H2O的杂化类型分别为sp3、sp2 D、催化剂表面发生的总反应为4NH3+6NO=5N2+6H2O9. 生物质X(
A、在酸性配位点上,NH3与H+通过离子键形成NH4+ B、增大压强有利于NO与O2吸附在Fe3+配位点上形成NO2 C、反应物NH3和生成物H2O的杂化类型分别为sp3、sp2 D、催化剂表面发生的总反应为4NH3+6NO=5N2+6H2O9. 生物质X( )与Y(
)与Y( )同时反应如下:
)同时反应如下:反应Ⅰ:(
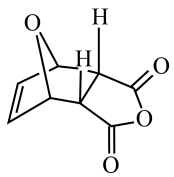 )
) 反应Ⅱ:(
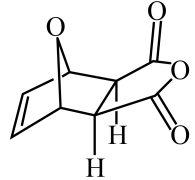 ) , 反应历程如图,下列说法不正确的是( )
) , 反应历程如图,下列说法不正确的是( ) A、 B、相同条件下,反应Ⅰ更快达到平衡 C、降低温度,的平衡物质的量分数增大 D、升高温度,反应Ⅰ、Ⅱ的反应速率都增大
A、 B、相同条件下,反应Ⅰ更快达到平衡 C、降低温度,的平衡物质的量分数增大 D、升高温度,反应Ⅰ、Ⅱ的反应速率都增大四、模拟演练
-
10. 的排放来自汽车尾气,研究利用反应 , 用活性炭可对其进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示。(已知:气体分压=气体总压×物质的量分数),下列有关说法错误的是( )
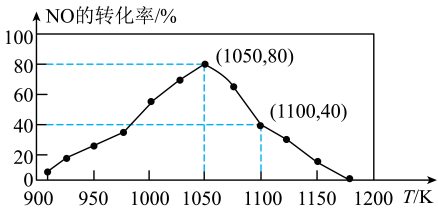 A、若能测得反应产生22g , 则反应放出的热量为17.0kJ B、达到平衡后增大活性炭的用量,平衡不移动 C、在950K~1000K之间,化学反应速率: D、1050K时,反应的化学平衡常数11. 在Fe2O3的催化作用下,向200℃的恒温恒容密闭容器中充入1molCH4和2molNO2 , 发生反应CH4(g)+2NO2(g) ⇌CO2(g)+N2(g)+2H2O(g),反应过程及能量变化示意图如图所示。下列说法正确的是( )
A、若能测得反应产生22g , 则反应放出的热量为17.0kJ B、达到平衡后增大活性炭的用量,平衡不移动 C、在950K~1000K之间,化学反应速率: D、1050K时,反应的化学平衡常数11. 在Fe2O3的催化作用下,向200℃的恒温恒容密闭容器中充入1molCH4和2molNO2 , 发生反应CH4(g)+2NO2(g) ⇌CO2(g)+N2(g)+2H2O(g),反应过程及能量变化示意图如图所示。下列说法正确的是( ) A、容器内气体的平均相对分子质量不再发生变化时,该反应达到平衡状态 B、反应一段时间后(未达平衡),Fe3O4会远远多于Fe2O3 C、起始条件相同,其他条件不变,仅改为绝热密闭容器,CH4和NO2的转化率增大 D、使用更高效的催化剂能提高该反应平衡时的转化率12. 向一恒容密闭容器中加入和一定量的 , 发生反应:。的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法错误的是
A、容器内气体的平均相对分子质量不再发生变化时,该反应达到平衡状态 B、反应一段时间后(未达平衡),Fe3O4会远远多于Fe2O3 C、起始条件相同,其他条件不变,仅改为绝热密闭容器,CH4和NO2的转化率增大 D、使用更高效的催化剂能提高该反应平衡时的转化率12. 向一恒容密闭容器中加入和一定量的 , 发生反应:。的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法错误的是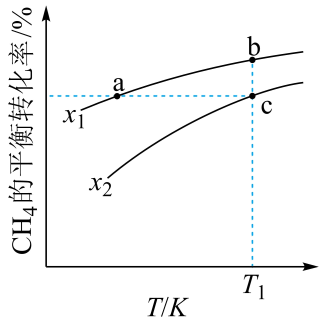 A、 B、反应速率: C、点a、b、c对应的平衡常数: D、反应温度为 , 当容器内压强不变时,反应达到平衡状态13. 萘(
A、 B、反应速率: C、点a、b、c对应的平衡常数: D、反应温度为 , 当容器内压强不变时,反应达到平衡状态13. 萘( )与浓硫酸发生取代反应可以生成 2 种取代产物,反应进程中能量变化如图所
)与浓硫酸发生取代反应可以生成 2 种取代产物,反应进程中能量变化如图所示。其中相同投料,经历相同时间, 不同反应温度时产物的比例不同, 在 40℃和 160℃时,
得到 1-取代产物与 2-取代产物的比例分别为 96:4 和 15:85,下列说法正确的是( )
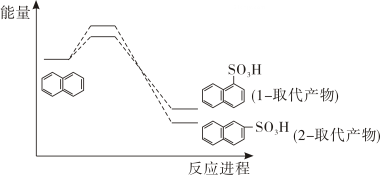 A、1-取代产物比 2-取代产物更稳定 B、与 40℃相比,160℃时萘的平衡转化率更大 C、选择合适的催化剂同样可以提高 2-取代产物比率 D、延长反应时间, 最终以 1-取代产物为主14. 叔丁基溴可与硝酸银在醇溶液中反应:
A、1-取代产物比 2-取代产物更稳定 B、与 40℃相比,160℃时萘的平衡转化率更大 C、选择合适的催化剂同样可以提高 2-取代产物比率 D、延长反应时间, 最终以 1-取代产物为主14. 叔丁基溴可与硝酸银在醇溶液中反应:反应分步进行:
①
②
下图是该反应能量变化图。下列说法正确的是( )
 A、选用催化剂可改变反应的大小 B、图中对应的物质是 C、其他条件不变时,的浓度越高,总反应速率越快 D、其他条件不变时,的浓度是总反应速率的决定因素15. 科研人员利用高压气流将水微滴喷射到涂覆催化剂的石墨网上,研究常温制氨,其反应历程中微粒转化关系如图1,相对能量变化关系如图2,图中*表示催化剂表面吸附位。下列说法正确的是( )
A、选用催化剂可改变反应的大小 B、图中对应的物质是 C、其他条件不变时,的浓度越高,总反应速率越快 D、其他条件不变时,的浓度是总反应速率的决定因素15. 科研人员利用高压气流将水微滴喷射到涂覆催化剂的石墨网上,研究常温制氨,其反应历程中微粒转化关系如图1,相对能量变化关系如图2,图中*表示催化剂表面吸附位。下列说法正确的是( ) A、过程中发生非极性键的断裂与形成 B、Ⅰ转化为和的过程中会生成 C、Ⅱ表示的微粒符号是 D、反应历程中放热最多的反应是
A、过程中发生非极性键的断裂与形成 B、Ⅰ转化为和的过程中会生成 C、Ⅱ表示的微粒符号是 D、反应历程中放热最多的反应是
-

 的速率决定
的速率决定