【备考2024年】高考化学广东卷真题变式分层精准练(第11题)
试卷更新日期:2024-02-24 类型:二轮复习
一、真题重现
-
1. 设为阿伏加德罗常数的值。侯氏制碱法涉及和等物质。下列叙述正确的是( )A、含有的共价键数目为 B、完全分解,得到的分子数目为 C、体积为的溶液中,数目为 D、和的混合物中含 , 则混合物中质子数为
二、基础巩固
-
2. 三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关该反应的说法错误的是( )A、NF3既表现了氧化性又表现了还原性 B、HF是还原产物 C、还原剂和氧化剂的物质的量之比是1∶2 D、3 mol NF3参加反应转移电子2 mol3. 设为阿伏加德罗常数的值,下列叙述正确的是( )A、0.4mol白磷( , 正四面体结构)含共价键的数目为1.2 B、0.1mol 与0.1mol 反应,生成的分子数为0.1 C、常温下,将2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3 D、常温常压下,2.2g由和组成的混合气体中含有的原子总数为0.154. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、24g Mg与稀硫酸完全反应,转移的电子数目为NA B、1mol 含有Si-Cl键的数目为 C、1L 1.0 溶液含有阴离子的总数为2 D、11.2L NO与11.2L O2混合后分子的数目为NA5. 设NA为阿伏加德罗常数的值。下列说法不正确的是( )A、2.8 g N2与CO混合气体中含有原子数目为0.2 NA B、0.1 mol氯气分别与足量铁和铜完全反应时转移的电子数均为0.2 NA C、16.9 g过氧化钡(BaO2)固体中阴、阳离子总数为0.3 NA D、1 L pH=1的H2SO4溶液中含有H+的数目为0.1 NA6. 为阿伏加德罗常数的值,下列叙述正确的是( )A、常温常压下,金刚石含有4NA个共价键 B、的乙酸和盐酸混合溶液含0.1NA个 C、标准状态下,含有的质子数为10NA D、电解水生成氢气,外电路通过1NA个电子
三、能力提升
-
7. 电解重水()是制取氘气()的一种方法。设为阿伏加德罗常数的值。下列说法错误的是( )A、分子间存在氢键 B、的熔、沸点比高 C、含中子数目为 D、制取转移的电子数目为8. 设NA为阿伏加德罗常数的数值。下列叙述正确的是( )A、0.1mol C2H5OH分子中含C-H键数为0.6NA B、由O与O组成的2.0g物质所含中子数为NA C、25℃,1L pH=13的Ba(OH)2溶液中OH-数为0.2 NA D、密闭容器中,2 mol SO2和1mol O2催化反应后分子总数为2 NA9. 2021年,我国科学家利用为原料人工合成淀粉,在未来具有极高的经济价值。已知合成淀粉过程中发生反应: , 设为阿伏加德罗常数,下列有关说法正确的是。( )A、17 g H2O2中含有过氧键数目为0.5 NA B、标况下,22.4 L CH3OH中含有的羟基数为NA C、18 g D2O中含有氧原子的数目为1 NA D、1 mol O2参与反应转移电子数为4 NA10. 芬顿法常用于废水的处理,反应为:NH4OCN+3H2O2=N2↑+CO2↑+5H2O,设NA为阿伏加德罗常数,下列有关说法不正确的是( )A、H2O2存在极性共价键和非极性共价键 B、标准状况下,22.4LCO2中含有σ键数目为2NA C、18gH2O中含有中子数目为8NA D、1molNH4OCN参与反应时转移电子数为3NA11. 火箭表面耐高温涂层的制备反应为。阿伏加德罗常数的值为 , 下列说法正确的是( )A、中共价键的数目为 B、中含有的中子数为 C、固体含有的数目为 D、消耗时,该反应中转移的电子数为12. 海洋碳循环是影响全球气候变化的关键控制环节,下图为海洋中碳循环的原理图.设为阿伏加德罗常数的值.下列说法正确的是( )
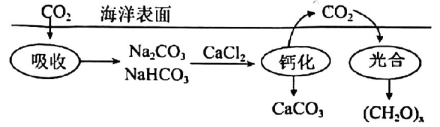 A、的溶液中,数目为 B、“钙化”时,消耗 , 生成 C、“光合”时,每生成转移电子数为 D、中含有共用电子对数为
A、的溶液中,数目为 B、“钙化”时,消耗 , 生成 C、“光合”时,每生成转移电子数为 D、中含有共用电子对数为四、模拟演练
-
13. 汽车尾气中的NO和CO在催化剂作用下发生反应:2NO+2CO2CO2+N2 , 列说法不正确的是( )(NA为阿伏加德罗常数的值)A、生成1molCO2转移电子的数目为2NA B、催化剂降低NO与CO反应的活化能 C、NO是氧化剂,CO是还原剂 D、N2既是氧化产物又是还原产物14. 三氯化氮可用于漂白,发生反应:。设为阿伏加德罗常数,下列说法错误的是( )A、中所有原子均满足8电子稳定状态 B、生成28g 时,反应转移的电子数目为6 C、标准状况下,33.6L HCl气体中含有H+数目为1.5 D、1L 1mol/L HClO溶液中含有的数目小于15. 我国科学家以、及等物质为原料通过电催化法制备尿素(
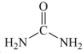 ),设为阿伏加德罗常数的值。下列说法正确的是( ) A、标准状况下,与混合气体的体积为 B、含有的电子数目为 C、尿素中所含有的键的数目为 D、体积为的的溶液中,数目为16. 每年的10月23日上午6:02到下午6:02被誉为“摩尔日”。设为阿伏加德罗常数的值,下列说法正确的是( )A、1mol含有的电子数目为 B、28g与44g含有的键数目相同 C、1L的溶液中,数目为 D、标准状况下,2.24L溶于足量水中转移的电子数目为17. 反应常被用于除去水中残余氯。为阿伏加德罗常数的值,下列说法正确的是( )A、溶液中含有的键数目为 B、25℃、101kPa时,中氯原子的数目为 C、含有质子的数目为 D、通过上述反应除去 , 电子转移的数目为18. 高铁酸钠()是一种绿色消毒剂,可用于饮用水处理。制备高铁酸钠的离子方程式为 , 则下列说法不正确的是( )A、在反应中被还原,发生氧化反应 B、氧化剂与还原剂的物质的量之比为3:2 C、上述反应生成1mol高铁酸根离子,转移3mol电子 D、高铁酸根离子具有强氧化性,溶于水能生成氢氧化铁胶体和氧气19. 用NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、4.6 g Na与含0.1 mol HCl的稀盐酸充分反应,转移电子数目为0.1NA B、25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA C、常温下,14克C2H4和C3H6混合气体所含的原子数为3NA D、等质量的1H218O与D216O,所含中子数前者大20. H2O2在纸张漂白和废水处理等领域有重要应用。一定条件下用H2和O2合成H2O2的反应过程如图所示。设NA为阿伏加德罗常数的值,下列说法正确的是( )
),设为阿伏加德罗常数的值。下列说法正确的是( ) A、标准状况下,与混合气体的体积为 B、含有的电子数目为 C、尿素中所含有的键的数目为 D、体积为的的溶液中,数目为16. 每年的10月23日上午6:02到下午6:02被誉为“摩尔日”。设为阿伏加德罗常数的值,下列说法正确的是( )A、1mol含有的电子数目为 B、28g与44g含有的键数目相同 C、1L的溶液中,数目为 D、标准状况下,2.24L溶于足量水中转移的电子数目为17. 反应常被用于除去水中残余氯。为阿伏加德罗常数的值,下列说法正确的是( )A、溶液中含有的键数目为 B、25℃、101kPa时,中氯原子的数目为 C、含有质子的数目为 D、通过上述反应除去 , 电子转移的数目为18. 高铁酸钠()是一种绿色消毒剂,可用于饮用水处理。制备高铁酸钠的离子方程式为 , 则下列说法不正确的是( )A、在反应中被还原,发生氧化反应 B、氧化剂与还原剂的物质的量之比为3:2 C、上述反应生成1mol高铁酸根离子,转移3mol电子 D、高铁酸根离子具有强氧化性,溶于水能生成氢氧化铁胶体和氧气19. 用NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、4.6 g Na与含0.1 mol HCl的稀盐酸充分反应,转移电子数目为0.1NA B、25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA C、常温下,14克C2H4和C3H6混合气体所含的原子数为3NA D、等质量的1H218O与D216O,所含中子数前者大20. H2O2在纸张漂白和废水处理等领域有重要应用。一定条件下用H2和O2合成H2O2的反应过程如图所示。设NA为阿伏加德罗常数的值,下列说法正确的是( ) A、1molH2O2中含2NAσ键,不含π键 B、合成1molH2O2 , 电子转移数为4NA C、1mol的H2O2含18NA电子 D、标准状况下,4.48LH2O2中含有0.2NAH2O2分子
A、1molH2O2中含2NAσ键,不含π键 B、合成1molH2O2 , 电子转移数为4NA C、1mol的H2O2含18NA电子 D、标准状况下,4.48LH2O2中含有0.2NAH2O2分子
-