【备考2024年】从巩固到提高 高考化学二轮微专题34 晶体结构
试卷更新日期:2024-02-23 类型:二轮复习
一、选择题
-
1. 镍酸镧电催化剂立方晶胞如图所示,晶胞参数为a,具有催化活性的是 , 图①和图②是晶胞的不同切面。下列说法错误的是( )
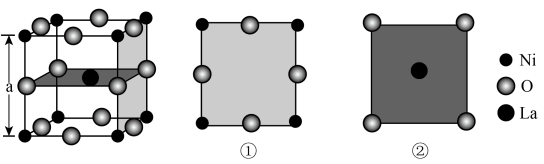 A、催化活性:①>② B、镍酸镧晶体的化学式为 C、周围紧邻的O有4个 D、和的最短距离为2. 朱砂(硫化汞)在众多先秦考古遗址中均有发现,其立方晶系型晶胞如下图所示,晶胞参数为anm,A原子的分数坐标为 , 阿伏加德罗常数的值为 , 下列说法正确的是( )
A、催化活性:①>② B、镍酸镧晶体的化学式为 C、周围紧邻的O有4个 D、和的最短距离为2. 朱砂(硫化汞)在众多先秦考古遗址中均有发现,其立方晶系型晶胞如下图所示,晶胞参数为anm,A原子的分数坐标为 , 阿伏加德罗常数的值为 , 下列说法正确的是( ) A、S的配位数是6 B、晶胞中B原子分数坐标为 C、该晶体的密度是 D、相邻两个Hg的最短距离为3. 某镁镍合金储氢后所得晶体的立方晶胞如图1(为便于观察,省略了2个图2的结构),晶胞边长为apm。下列说法正确的是( )
A、S的配位数是6 B、晶胞中B原子分数坐标为 C、该晶体的密度是 D、相邻两个Hg的最短距离为3. 某镁镍合金储氢后所得晶体的立方晶胞如图1(为便于观察,省略了2个图2的结构),晶胞边长为apm。下列说法正确的是( )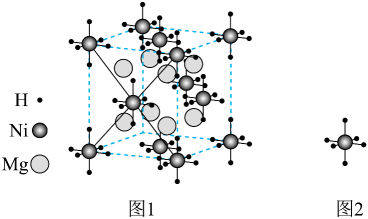 A、晶体的化学式为 B、晶胞中与1个Mg配位的Ni有6个 C、晶胞中2个Ni之间的最近距离为apm D、镁镍合金中Mg、Ni通过离子键结合4. 硒(Se)是一种有抗癌、抗氧化作用的元素,可形成多种化合物。某化合物是潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
A、晶体的化学式为 B、晶胞中与1个Mg配位的Ni有6个 C、晶胞中2个Ni之间的最近距离为apm D、镁镍合金中Mg、Ni通过离子键结合4. 硒(Se)是一种有抗癌、抗氧化作用的元素,可形成多种化合物。某化合物是潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
下列说法不正确的是( )
A、Se的基态原子价电子排布式为 B、该化合物的晶体类型是离子晶体 C、该化合物的化学式为 D、距离K最近的八面体有4个5. 与形成的合金具有抗高温氧化、耐腐蚀等优点,微观结构如图a所示;用金属铼()掺杂后,形成的化合物 , 微观结构如图所示: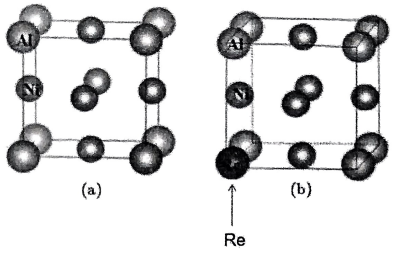
已知:与同族。下列说法正确的是( )
A、与均为区元素 B、图b为化合物的晶胞结构 C、 D、图的晶胞参数为 , 则晶体密度为6. 钛酸钡是太阳能电池材料.经X射线衍射分析测定,钛酸钡的晶胞结构如图所示(、均与接触),已知晶胞边长为 , 的半径为 , 为阿伏加德罗常数的值.下列叙述错误的是( )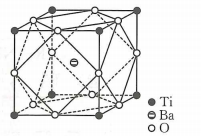 A、与等距离且最近的有8个 B、的半径为 C、钛酸钡的化学式为 D、钛酸钡的密度7. 为维护国家安全和利益,经国务院批准,决定对镓、锗相关物项实施出口管制。镓的某种化合物的晶胞结构如下图所示(晶胞参数为a pm,1 pm=10-10cm,NA表示阿伏加德罗常数)。下列说法正确的是( )
A、与等距离且最近的有8个 B、的半径为 C、钛酸钡的化学式为 D、钛酸钡的密度7. 为维护国家安全和利益,经国务院批准,决定对镓、锗相关物项实施出口管制。镓的某种化合物的晶胞结构如下图所示(晶胞参数为a pm,1 pm=10-10cm,NA表示阿伏加德罗常数)。下列说法正确的是( ) A、Ga元素位于元素周期表的ds区 B、晶体结构中N的配位数为6 C、该物质的化学式为Ga4N4 D、该晶体的密度为8. 已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的( )
A、Ga元素位于元素周期表的ds区 B、晶体结构中N的配位数为6 C、该物质的化学式为Ga4N4 D、该晶体的密度为8. 已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的( ) A、ZX4Y8 B、ZX2Y6 C、ZXY3 D、ZX8Y129. 已知冰晶石(Na3AlF6)熔融时的电离方程式为Na3AlF6 = 3Na++ AlF。现有冰晶石的结构单元如图所示,
A、ZX4Y8 B、ZX2Y6 C、ZXY3 D、ZX8Y129. 已知冰晶石(Na3AlF6)熔融时的电离方程式为Na3AlF6 = 3Na++ AlF。现有冰晶石的结构单元如图所示, 位于大立方体顶点和面心,
位于大立方体顶点和面心, 位于大立方体的12条棱的中点和8个小立方体的体心,
位于大立方体的12条棱的中点和8个小立方体的体心, 是图中
是图中 、
、 中的一种。下列说法正确的是( )
中的一种。下列说法正确的是( ) A、冰晶石是共价晶体 B、大立方体的体心处
A、冰晶石是共价晶体 B、大立方体的体心处 代表Al3+
C、与Na+距离相等且最近的Na+有6个
D、冰晶石晶体的密度约为g•cm-3
10. FeS2具有良好的半导体性能,如图给出了立方FeS2晶胞中的Fe2+和位于晶胞体心的(晶胞中的其他已省略)。下列叙述正确的是( )
代表Al3+
C、与Na+距离相等且最近的Na+有6个
D、冰晶石晶体的密度约为g•cm-3
10. FeS2具有良好的半导体性能,如图给出了立方FeS2晶胞中的Fe2+和位于晶胞体心的(晶胞中的其他已省略)。下列叙述正确的是( ) A、Fe2+的最高能层的电子排布式为3d6 B、基态Fe2+共有24种不同空间运动状态的电子 C、FeS2晶胞中距离每个最近的S有8个 D、晶胞中Fe2+位于所形成的正八面体的体心11. 一种超导材料(仅由三种元素组成)的长方体晶胞结构如图所示(已知 , 用表示阿伏加德罗常数的值):
A、Fe2+的最高能层的电子排布式为3d6 B、基态Fe2+共有24种不同空间运动状态的电子 C、FeS2晶胞中距离每个最近的S有8个 D、晶胞中Fe2+位于所形成的正八面体的体心11. 一种超导材料(仅由三种元素组成)的长方体晶胞结构如图所示(已知 , 用表示阿伏加德罗常数的值):
下列说法正确的是( )
A、基态失去能级上的一个电子转化为 B、若点原子分数坐标为 , 则点原子分数坐标为 C、M、N之间的距离为 D、晶体的密度为12. 某种新型储氢材料的立方晶胞如图所示,该晶体由和形成,晶胞参数为a pm。
下列说法中不正确的是( )
A、中 B、晶胞中和的配位数分别为8和4 C、晶胞中距离最近的2个之间的距离为pm D、中心原子的杂化方式为杂化13. 下列有关晶体结构和性质的判断错误的是( )A
B
C
D




金刚石晶体中,每个碳原子被12个六元环共用
晶体中,每个晶胞平均含有4个
干冰熔化或升华时,分子内的共价键被破坏
晶体中,距最近且等距的有6个
A、A B、B C、C D、D14. 几种晶体的晶胞结构如图所示,下列说法错误的是( )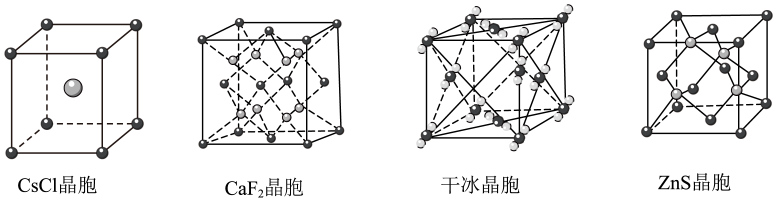 A、CsCl晶体中,每个Cs+周围紧邻8个Cl- B、CaF2晶体中,每个Ca2+周围紧邻8个F- C、干冰晶体中,每个CO2周围紧邻12个CO2 D、ZnS晶体中,每个S2-周围紧邻8个S2-15. 向溶液中滴加黄血盐可制得普鲁士蓝,向溶液中滴加赤血盐可制得滕氏蓝。经科学家研究发现,两者具有相同的结构。其晶胞由8个如图所示的小立方体构成(未标出),晶胞参数为。下列关于普鲁士蓝和滕氏蓝说法错误的是( )
A、CsCl晶体中,每个Cs+周围紧邻8个Cl- B、CaF2晶体中,每个Ca2+周围紧邻8个F- C、干冰晶体中,每个CO2周围紧邻12个CO2 D、ZnS晶体中,每个S2-周围紧邻8个S2-15. 向溶液中滴加黄血盐可制得普鲁士蓝,向溶液中滴加赤血盐可制得滕氏蓝。经科学家研究发现,两者具有相同的结构。其晶胞由8个如图所示的小立方体构成(未标出),晶胞参数为。下列关于普鲁士蓝和滕氏蓝说法错误的是( ) A、滕氏蓝和普鲁士蓝均为离子晶体 B、由图及滕氏蓝的化学式可知,应位于晶胞体心 C、测定晶体的结构常采用X射线衍射法 D、设滕氏蓝的式量为 , 则滕氏蓝晶体的密度为16. 是离子晶体,其晶胞如下图1所示(已知氟化钙晶胞参数为a pm,表示阿伏加德罗常数的值),难溶于水、可溶于酸。常温下,用盐酸调节浊液的pH,测得在不同pH条件下,体系中与(X为或)的关系如图2所示。下列说法错误的是。( )
A、滕氏蓝和普鲁士蓝均为离子晶体 B、由图及滕氏蓝的化学式可知,应位于晶胞体心 C、测定晶体的结构常采用X射线衍射法 D、设滕氏蓝的式量为 , 则滕氏蓝晶体的密度为16. 是离子晶体,其晶胞如下图1所示(已知氟化钙晶胞参数为a pm,表示阿伏加德罗常数的值),难溶于水、可溶于酸。常温下,用盐酸调节浊液的pH,测得在不同pH条件下,体系中与(X为或)的关系如图2所示。下列说法错误的是。( ) A、每个氟化钙晶胞中含有的数目为4个 B、氟化钙的晶体密度为 C、表示与的变化曲线 D、的数量级为17. 是钙钛矿型太阳能电池的重要吸光材料,其晶胞结构如图所示。已知:B代表 , A的原子分数坐标为(0,0,0),摩尔质量为M g/mol,晶胞边长为a pm,为阿佛伽德罗常数的值。下列说法正确的是( )
A、每个氟化钙晶胞中含有的数目为4个 B、氟化钙的晶体密度为 C、表示与的变化曲线 D、的数量级为17. 是钙钛矿型太阳能电池的重要吸光材料,其晶胞结构如图所示。已知:B代表 , A的原子分数坐标为(0,0,0),摩尔质量为M g/mol,晶胞边长为a pm,为阿佛伽德罗常数的值。下列说法正确的是( )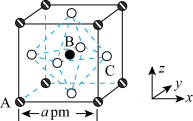 A、该晶体为共价晶体 B、的配位数为8 C、C的原子分数坐标为( , 1,) D、该晶体的密度为18. 有关晶体的结构如下图所示,下列说法中正确的是( )
A、该晶体为共价晶体 B、的配位数为8 C、C的原子分数坐标为( , 1,) D、该晶体的密度为18. 有关晶体的结构如下图所示,下列说法中正确的是( ) A、在NaCl晶体中,阳离子的配位数为8,阴离子的配位数为6 B、该气态团簇分子的分子式为EF或FE,其晶体不导电 C、在金刚石晶体中,每个碳原子被6个六元环共同占有,每个六元环最多有4个碳原子共面 D、在CaF2晶体中,每个晶胞平均占有4个Ca2+ , F-的配位数是419. 下图为几种晶体或晶胞的结构示意图。下列说法错误的是( )
A、在NaCl晶体中,阳离子的配位数为8,阴离子的配位数为6 B、该气态团簇分子的分子式为EF或FE,其晶体不导电 C、在金刚石晶体中,每个碳原子被6个六元环共同占有,每个六元环最多有4个碳原子共面 D、在CaF2晶体中,每个晶胞平均占有4个Ca2+ , F-的配位数是419. 下图为几种晶体或晶胞的结构示意图。下列说法错误的是( ) A、1mol冰晶体中含有氢键数目为2NA B、四种晶体的熔点高低为:金刚石>MgO>冰>碘单质 C、碘晶体属于分子晶体,每个碘晶胞中实际占有8个碘原子 D、金刚石属于共价晶体,每个碳原子周围距离最近的碳原子数为420. 钙钛矿( , 晶胞如图a所示)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。一种立方钙钛矿结构的金属卤化物光电材料的组成为和有机碱离子 , 其晶胞如图所示:
A、1mol冰晶体中含有氢键数目为2NA B、四种晶体的熔点高低为:金刚石>MgO>冰>碘单质 C、碘晶体属于分子晶体,每个碘晶胞中实际占有8个碘原子 D、金刚石属于共价晶体,每个碳原子周围距离最近的碳原子数为420. 钙钛矿( , 晶胞如图a所示)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。一种立方钙钛矿结构的金属卤化物光电材料的组成为和有机碱离子 , 其晶胞如图所示:
下列说法中不正确的是( )
A、晶体所含化学作用力为离子键和共价键 B、有机碱中原子的杂化轨道类型是 C、晶体的配位数为12 D、与图中的空间位置相同21. 某立方晶系的锑钾(Sb—K) 合金可作为钾离子电池的电极材料,其晶胞如图1所示(图2为晶胞中的一部分),已知NA为阿伏加德罗常数。下列说法正确的是( )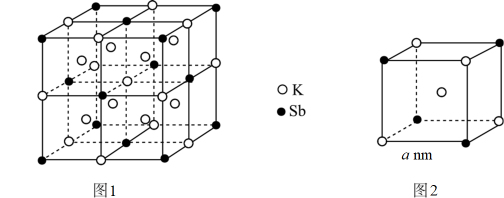 A、该合金的组成可表示为 K2Sb B、该晶体是离子晶体 C、两个 Sb 之间最近的距离为2anm D、该晶体的密度为22. 下列有关物质结构的说法不正确的是( )
A、该合金的组成可表示为 K2Sb B、该晶体是离子晶体 C、两个 Sb 之间最近的距离为2anm D、该晶体的密度为22. 下列有关物质结构的说法不正确的是( ) A、C-C 键比 Si-C 键键长短,故金刚石比金刚砂熔点更高、硬度更大 B、氯化钠晶体与氯化铯晶体中,Cl-的配位数均为 6 C、干冰晶体采用分子密堆积,每个 CO2周围紧邻 12 个 CO2 D、O3是极性分子,但由于极性微弱,它在 CCl4中的溶解度高于在水中的溶解度23. 某Ba-Ti-O晶体具有良好的电学性能,其晶胞为立方晶胞(如图),晶胞边长为a pm。设阿伏加德罗常数的值为 , 下列说法错误的是
A、C-C 键比 Si-C 键键长短,故金刚石比金刚砂熔点更高、硬度更大 B、氯化钠晶体与氯化铯晶体中,Cl-的配位数均为 6 C、干冰晶体采用分子密堆积,每个 CO2周围紧邻 12 个 CO2 D、O3是极性分子,但由于极性微弱,它在 CCl4中的溶解度高于在水中的溶解度23. 某Ba-Ti-O晶体具有良好的电学性能,其晶胞为立方晶胞(如图),晶胞边长为a pm。设阿伏加德罗常数的值为 , 下列说法错误的是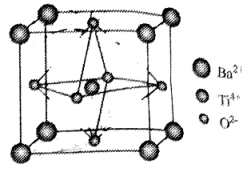 A、化学式为 B、和间的最短距离为 C、该晶胞中与等距离且最近的有4个 D、晶体的密度为24. 在无机氟化物制备中有广泛的应用,其晶体属于四方晶系,晶胞参数如图所示,其中O点原子和①号原子的分数坐标依次为、。已知:Xe—F键长为下列说法正确的是( )
A、化学式为 B、和间的最短距离为 C、该晶胞中与等距离且最近的有4个 D、晶体的密度为24. 在无机氟化物制备中有广泛的应用,其晶体属于四方晶系,晶胞参数如图所示,其中O点原子和①号原子的分数坐标依次为、。已知:Xe—F键长为下列说法正确的是( )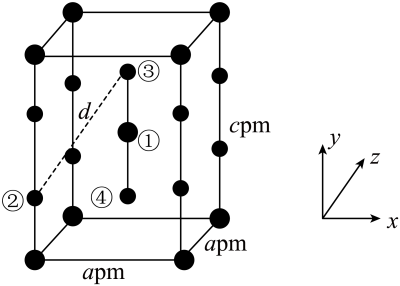 A、中心原子上的孤电子对数为2 B、④号原子的分数坐标为 C、沿x、y、z任意一个方向投影,位于面中心的都只有原子 D、晶胞中②③号原子间的距离
A、中心原子上的孤电子对数为2 B、④号原子的分数坐标为 C、沿x、y、z任意一个方向投影,位于面中心的都只有原子 D、晶胞中②③号原子间的距离二、多选题
-
25. 请仔细观察下列几种物质的结构示意图,下列说法错误的是( )
 A、最近发现一种由钛原子和碳原子构成的气态团簇分子,如图1所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为TiC B、锂的某种氧化物的晶胞如图2所示,则该氧化物的化学式为Li2O C、某晶体的一部分如图3所示,则这种晶体中A、B、C三种粒子数目之比是1:4:2 D、Mn和Bi形成的某种晶体的结构如图4所示(白球均在六棱柱内),则该晶体物质的化学式为Mn2Bi
A、最近发现一种由钛原子和碳原子构成的气态团簇分子,如图1所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为TiC B、锂的某种氧化物的晶胞如图2所示,则该氧化物的化学式为Li2O C、某晶体的一部分如图3所示,则这种晶体中A、B、C三种粒子数目之比是1:4:2 D、Mn和Bi形成的某种晶体的结构如图4所示(白球均在六棱柱内),则该晶体物质的化学式为Mn2Bi三、非选择题
-
26. 新型储氢合金的晶胞如图所示,该晶胞为立方体,晶胞棱长为a nm。
 (1)、基态Fe原子共有种空间运动状态的电子;基态的价层电子排布式为。(2)、下列说法正确的是____。A、该晶胞与金刚石晶胞结构相似 B、铁原子之间最短距离为 C、该合金储氢过程是化学吸附 D、储氢后材料中存在离子键、共价键和分子间作用力(3)、该晶体化学式为;设阿伏加德罗常数的值为 , 则该晶胞密度为。(只需列出计算的表达式)(4)、每个Fe周围与它最近且等距的Mg有个。27. Li、B、C、Ga等元素的单质或化合物在很多领域有广泛的应用。请回答:(1)、基态原子的价电子排布式为。(2)、一种含B化合物可用作吸附材料,其化学式为 , 部分晶体结构如图1所示,其中为平面结构。
(1)、基态Fe原子共有种空间运动状态的电子;基态的价层电子排布式为。(2)、下列说法正确的是____。A、该晶胞与金刚石晶胞结构相似 B、铁原子之间最短距离为 C、该合金储氢过程是化学吸附 D、储氢后材料中存在离子键、共价键和分子间作用力(3)、该晶体化学式为;设阿伏加德罗常数的值为 , 则该晶胞密度为。(只需列出计算的表达式)(4)、每个Fe周围与它最近且等距的Mg有个。27. Li、B、C、Ga等元素的单质或化合物在很多领域有广泛的应用。请回答:(1)、基态原子的价电子排布式为。(2)、一种含B化合物可用作吸附材料,其化学式为 , 部分晶体结构如图1所示,其中为平面结构。
下列说法不正确的是____。
A、基态原子的第一电离能: B、基态原子未成对电子数: C、该晶体中存在的化学键有离子键、共价键、配位键、氢键 D、晶体中B、C、N和O原子轨道的杂化类型分别为(3)、比较键角大小:(填“>”“=”或“<”),并说明理由。(4)、一种锂离子电池负极材料为两层石墨层中嵌入 , 形成如图2所示的晶胞结构。该物质的化学式可以表示为 , 的配位数为。 28. 含碘的物质广泛应用于生活中。如(CH3NH3)PbI3作为典型的有机金属卤化物,一直是太阳能电池研究的宠儿;AgI可用于显影剂和人工增雨。(1)、基态碘原子的价电子排布式为。(2)、CH3NH中所含元素电负性从大到小的顺序为。(3)、I的VSEPR模型如下图,中心I原子的杂化方式是(填“sp3”、“sp”、“sp3d”或“sp3d2”)。I的空间构型为。
28. 含碘的物质广泛应用于生活中。如(CH3NH3)PbI3作为典型的有机金属卤化物,一直是太阳能电池研究的宠儿;AgI可用于显影剂和人工增雨。(1)、基态碘原子的价电子排布式为。(2)、CH3NH中所含元素电负性从大到小的顺序为。(3)、I的VSEPR模型如下图,中心I原子的杂化方式是(填“sp3”、“sp”、“sp3d”或“sp3d2”)。I的空间构型为。 (4)、Ti的四卤化物熔点如下表所示。由此可推知,TiF4中的化学键类型是TiCl4至TiI4熔点依次升高,原因是。
(4)、Ti的四卤化物熔点如下表所示。由此可推知,TiF4中的化学键类型是TiCl4至TiI4熔点依次升高,原因是。化合物
TiF4
TiCl4
TiBr4
TiI4
熔点/℃
377
-24.12
38.3
155
(5)、(CH3NH3)PbI3晶体属于钙钛矿型结构(如图所示)。Pb2+周围距离最近且相等的I-数目有个;晶胞中A、B之间的距离为apm,(CH3NH3)PbI3式量为M,该物质的密度ρ=g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。 (6)、在离子晶体中,当0.414<r(阳离子)∶r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知r(Ag+)∶r(I-)=0.573,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。造成AgI晶体结构不同于NaCl晶体结构的原因不可能是(填标号)。
(6)、在离子晶体中,当0.414<r(阳离子)∶r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知r(Ag+)∶r(I-)=0.573,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。造成AgI晶体结构不同于NaCl晶体结构的原因不可能是(填标号)。
a.几何因素 b.电荷因素 c.键性因素
29. 我国科学家研发的全球首套“液态阳光”项目使双碳目标更近一步。该项目通过太阳能发电电解水制氢,再将CO2加氢合成CH2OH。(1)、太阳能电池板的主要材料为单晶硅。①单晶硅属于晶体。
②熔点比较:单晶硅金刚石。(选填>、<、=)
(2)、在催化剂作用下,CO2与H2反应得到CH3OH。①CO2分子的空间结构为 , 在干冰晶体中每个CO2周围等距且紧邻的CO2有个。
②CH3OH和CO2分子中σ键数目之比为。
③CH3OH比CO2在水中的溶解度大,这是因为。
(3)、ZrO2催化剂可实现CO2高选择性加氢合成CH3OH,ZrO2晶胞结构如图所示。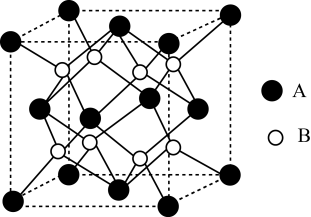
①B代表(填“”或“”)。
②ZrO2晶胞的棱长分别为anm、anm、cnm,其晶体密度为(列算式用表示阿伏加德罗常数的值)。
30. 普鲁士蓝的化学式为 , 其结构如图1(可能位于中心的未标出)或图2(、未标出)所示。
请回答:
(1)、基态Fe价电子轨道表示式为。(2)、已知铁的电离能数据如下:电离能/()
……
Fe
759
1561
2597
5290
……
则,铁的第四电离能()大于第三电离能()的可能原因是:。
(3)、关于晶体下列说法不正确的是____(填序号)。A、存在的化学键有σ键、π键、配位键、离子键等 B、Fe、N、C的电负性由大到小的顺序: C、晶体中的键能>KCN中的键能 D、晶胞中、原子均参与形成配位键,其配位数之比为6:6(4)、可溶性氰化物(如KCN)有剧毒,但普鲁士蓝却无毒,请从结构角度解释普鲁士蓝无毒的原因是。(5)、图2晶胞中的个数为 , 设普鲁士蓝的最简式的式量为Mr,晶体密度为 , 则相邻之间的最短距离为nm。(列出计算式,为阿伏加德罗常数的值) 31. 氮化硼是一种性能优异的新型材料,主要有六方氮化硼和立方氮化硼两种异构体,前者的结构类似石墨,后者的结构类似金刚石。
31. 氮化硼是一种性能优异的新型材料,主要有六方氮化硼和立方氮化硼两种异构体,前者的结构类似石墨,后者的结构类似金刚石。 (1)、基态硼原子的价电子排布式为 , 硼、碳、氮、氧的第一电离能由小到大的顺序为(以元素符号作答)。(2)、某工厂需要一批氮化硼作为耐磨刀具原料,应选择(填“六方”或“立方”)氮化硼,原因是。(3)、六方氮化硼中硼原子的杂化方式为杂化。立方氮化硼中距离N原子最近的B原子个数为。在高温高压下六方氮化硼转化为立方氮化硼属于(填“物理”或“化学”)变化。(4)、已知立方氮化硼晶胞边长为361.5pm,则立方氮化硼的密度是(列算式,设阿伏加德罗常数的数值为)。32. Ⅰ.过渡区金属元素原子或离子易形成配合物,广泛用作催化剂。回答下列问题:(1)、硫酸铜溶液中滴入氨水可形成配离子。还可与其他微粒形成配离子,如与乙二胺形成
(1)、基态硼原子的价电子排布式为 , 硼、碳、氮、氧的第一电离能由小到大的顺序为(以元素符号作答)。(2)、某工厂需要一批氮化硼作为耐磨刀具原料,应选择(填“六方”或“立方”)氮化硼,原因是。(3)、六方氮化硼中硼原子的杂化方式为杂化。立方氮化硼中距离N原子最近的B原子个数为。在高温高压下六方氮化硼转化为立方氮化硼属于(填“物理”或“化学”)变化。(4)、已知立方氮化硼晶胞边长为361.5pm,则立方氮化硼的密度是(列算式,设阿伏加德罗常数的数值为)。32. Ⅰ.过渡区金属元素原子或离子易形成配合物,广泛用作催化剂。回答下列问题:(1)、硫酸铜溶液中滴入氨水可形成配离子。还可与其他微粒形成配离子,如与乙二胺形成 ,此配离子内部不含有的化学键类型是____。 A、离子键 B、非极性键 C、配位键 D、氢键(2)、在的水溶液中,一定条件下存在组成为(n为正整数)的配离子,提供孤电子对的是____ (填序号)。A、 B、H C、O D、Cr(3)、Ⅱ.晶体世界丰富多彩,复杂多样,各类晶体具有不同的结构特点,决定着他具有不同的性质和用途,回答下列问题:
,此配离子内部不含有的化学键类型是____。 A、离子键 B、非极性键 C、配位键 D、氢键(2)、在的水溶液中,一定条件下存在组成为(n为正整数)的配离子,提供孤电子对的是____ (填序号)。A、 B、H C、O D、Cr(3)、Ⅱ.晶体世界丰富多彩,复杂多样,各类晶体具有不同的结构特点,决定着他具有不同的性质和用途,回答下列问题:由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体的晶胞如图所示,X晶体的化学式为:
 (4)、NiO的晶胞结构如图乙所示,其中离子坐标参数A为(0,0,0),B为(1,1,1),则C的离子坐标参数为。配位数是 , 若晶胞边长为apm,则NiO晶体的密度为(用含a、的代数式表示,表示阿伏加德罗常数)。
(4)、NiO的晶胞结构如图乙所示,其中离子坐标参数A为(0,0,0),B为(1,1,1),则C的离子坐标参数为。配位数是 , 若晶胞边长为apm,则NiO晶体的密度为(用含a、的代数式表示,表示阿伏加德罗常数)。 (5)、已知的立方晶胞结构如图所示,若晶体的密度为 , 阿伏加德罗常数的值为 , 则Cu与O之间最短距离为cm(用含a、的代数式表示)。
(5)、已知的立方晶胞结构如图所示,若晶体的密度为 , 阿伏加德罗常数的值为 , 则Cu与O之间最短距离为cm(用含a、的代数式表示)。
-