【备考2024年】从巩固到提高 高考化学二轮微专题32 配合物
试卷更新日期:2024-02-23 类型:二轮复习
一、选择题
-
1. (赤血盐)、(黄血盐)是常用于、的实验室检验试剂。一定条件下,可发生如下两个反应:
① , 固态混合,释放;
② , 溶液混合,消耗。
下列有关说法不正确的是( )
A、检验:(蓝色) B、含有离子键、极性键、配位键 C、氧化性强于 D、两个反应方向不一致,原因可能是溶液中与的配位能力强于2. 已知NO能被FeSO4溶液吸收生成配合物。下列说法不正确的是( )A、该配合物中阴离子空间构型为正四面体形 B、配离子为 , 配位数为5 C、Fe2+被氧化为Fe3+ , 失去的电子位于3d轨道 D、向配合物溶液中加入足量的BaCl2溶液,所有 SO42-均被完全沉淀3. 配合物可用于检验。下列说法正确的是( )A、铁原子的2p和3p轨道的形状、能量均相同 B、基态的未成对电子数为5 C、中提供孤电子对的是 D、1mol配合物中所含的π键数目为4. EDTA(乙二胺四乙酸)是良好的配合剂,Ca2+与EDTA形成的螯合物结构如图所示。下列关于该螯合物的说法错误的是( )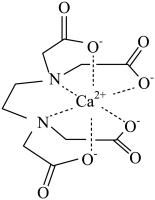 A、碳原子的杂化方式均为sp3 B、配体的配位原子为O、N C、Ca2+的配位数为6 D、组成元素中第一电离能最大的是N5. 青霉胺可以用于医学上误食铜盐的解毒,解毒原理:Cu2+形成环状配合物,其结构如图所示。该配合物无毒、易溶于水,可经尿液排出。下列说法错误的是( )
A、碳原子的杂化方式均为sp3 B、配体的配位原子为O、N C、Ca2+的配位数为6 D、组成元素中第一电离能最大的是N5. 青霉胺可以用于医学上误食铜盐的解毒,解毒原理:Cu2+形成环状配合物,其结构如图所示。该配合物无毒、易溶于水,可经尿液排出。下列说法错误的是( )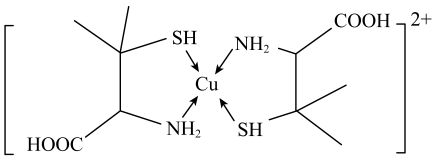 A、共价键键角的大小关系为H2O<NH3 B、电负性大小关系为O>N>H>Cu C、该配合物易溶于水的主要原因是其与水可形成分子间氢键 D、与铜离子形成配位键强弱的大小关系为H2S>NH36. 氮及其化合物在生产生活中具有广泛应用。氮气经过一系列的变化可以合成氨、氮的氧化物、硝酸等重要的化工原料;NO能被溶液吸收生成配合物 , 减少环境污染。下列说法正确的是( )A、该配合物中所含非金属元素均位于元素周期表的p区 B、提供孤电子对用于形成配位键 C、该配合物中阴离子空间结构为正四面体形 D、配离子为 , 中心离子的配位数为57. 在碱性溶液中,双缩脲能与作用形成紫红色配合物,配离子结构如图所示。下列说法错误的是( )
A、共价键键角的大小关系为H2O<NH3 B、电负性大小关系为O>N>H>Cu C、该配合物易溶于水的主要原因是其与水可形成分子间氢键 D、与铜离子形成配位键强弱的大小关系为H2S>NH36. 氮及其化合物在生产生活中具有广泛应用。氮气经过一系列的变化可以合成氨、氮的氧化物、硝酸等重要的化工原料;NO能被溶液吸收生成配合物 , 减少环境污染。下列说法正确的是( )A、该配合物中所含非金属元素均位于元素周期表的p区 B、提供孤电子对用于形成配位键 C、该配合物中阴离子空间结构为正四面体形 D、配离子为 , 中心离子的配位数为57. 在碱性溶液中,双缩脲能与作用形成紫红色配合物,配离子结构如图所示。下列说法错误的是( )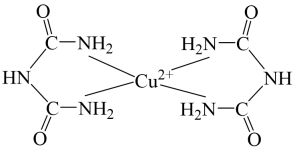 A、双缩脲分子中键与键个数比为 B、该配离子与水形成氢键的原子只有 C、该配离子中提供空轨道的微粒是 D、基态原子电子占据最高能级的电子云轮廓图为球形8. 配离子球棍模型如下图所示。下列关于该配离子的说法中不正确的是( )
A、双缩脲分子中键与键个数比为 B、该配离子与水形成氢键的原子只有 C、该配离子中提供空轨道的微粒是 D、基态原子电子占据最高能级的电子云轮廓图为球形8. 配离子球棍模型如下图所示。下列关于该配离子的说法中不正确的是( )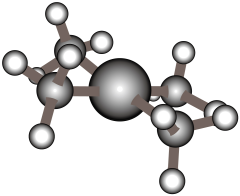 A、配位数为4 B、中的采用杂化 C、配体是 , 的空间构型为三角锥形 D、若用代替与形成配位键,则配位键的强度将减弱9. 在硫酸铜溶液中加入浓氨水,可形成配离子[Cu(NH3)4(H2O)2]2+。下列有关说法中正确的是( )A、中心离子的配位数为4 B、电负性由大到小为N>O>Cu C、基态原子的第一电离能:N>O>S D、键角:H2O>NH310. 氮及其化合物在生产生活中具有广泛应用.氮气经过一系列的变化可以合成氮、氮的氧化物、硝酸等重要的化工原料:能被溶液吸收生成配合物 , 减少环境污染.下列说法不正确的是( )A、提供空轨道用于形成配位键 B、该配合物中阴离子空间结构为正四面体 C、配离子为 , 中心离子的配位数为6 D、的价层电子排布式为11. 下列关于配合物和超分子的说法正确的是( )A、在中,给出孤对电子,提供空轨道 B、向溶液中加入硝酸银溶液不能生成沉淀 C、利用超分子的自组装特征可以分离和 D、中存在的化学键有氢键12. 胆矾()是一种重要的盐,在电镀、印染、颜料、农药等领域都有着广泛的应用,可写作 , 其结构如图1,胆矾溶于水可得溶液,如图2所示,向溶液中逐滴加入浓氨水至过量,得到透明的深蓝色溶液,其溶质为 , 再向其中加入乙醇,可析出深蓝色的晶体,其组成为 , 下列有关说法不正确的是( )
A、配位数为4 B、中的采用杂化 C、配体是 , 的空间构型为三角锥形 D、若用代替与形成配位键,则配位键的强度将减弱9. 在硫酸铜溶液中加入浓氨水,可形成配离子[Cu(NH3)4(H2O)2]2+。下列有关说法中正确的是( )A、中心离子的配位数为4 B、电负性由大到小为N>O>Cu C、基态原子的第一电离能:N>O>S D、键角:H2O>NH310. 氮及其化合物在生产生活中具有广泛应用.氮气经过一系列的变化可以合成氮、氮的氧化物、硝酸等重要的化工原料:能被溶液吸收生成配合物 , 减少环境污染.下列说法不正确的是( )A、提供空轨道用于形成配位键 B、该配合物中阴离子空间结构为正四面体 C、配离子为 , 中心离子的配位数为6 D、的价层电子排布式为11. 下列关于配合物和超分子的说法正确的是( )A、在中,给出孤对电子,提供空轨道 B、向溶液中加入硝酸银溶液不能生成沉淀 C、利用超分子的自组装特征可以分离和 D、中存在的化学键有氢键12. 胆矾()是一种重要的盐,在电镀、印染、颜料、农药等领域都有着广泛的应用,可写作 , 其结构如图1,胆矾溶于水可得溶液,如图2所示,向溶液中逐滴加入浓氨水至过量,得到透明的深蓝色溶液,其溶质为 , 再向其中加入乙醇,可析出深蓝色的晶体,其组成为 , 下列有关说法不正确的是( ) A、由图1知胆矾中的水在不同温度下会分步失去 B、胆矾晶体中存在离子键、共价键、氢键及范德华力 C、该实验证明配离子比稳定 D、加入乙醇能使在水中的溶解度减小13. 某配合物W的化学式为 , 下列说法正确的是( )A、中心离子提供空轨道 B、的W溶液中 C、基态钛原子的价层电子数为2 D、配体中氢原子提供孤电子对14. 氯化铜是共价化合物,通常用作有机和无机反应催化剂、媒染剂等。溶液与乙二胺()可形成配离子(En是乙二胺的简写),如图所示,下列说法中错误的是( )
A、由图1知胆矾中的水在不同温度下会分步失去 B、胆矾晶体中存在离子键、共价键、氢键及范德华力 C、该实验证明配离子比稳定 D、加入乙醇能使在水中的溶解度减小13. 某配合物W的化学式为 , 下列说法正确的是( )A、中心离子提供空轨道 B、的W溶液中 C、基态钛原子的价层电子数为2 D、配体中氢原子提供孤电子对14. 氯化铜是共价化合物,通常用作有机和无机反应催化剂、媒染剂等。溶液与乙二胺()可形成配离子(En是乙二胺的简写),如图所示,下列说法中错误的是( ) A、基态的未成对电子数为1 B、配离子中N原子提供孤对电子 C、乙二胺和三甲胺均属于胺,沸点更高的是三甲胺 D、配离子中涉及的元素的电负性由大到小的顺序为N>C>H>Cu15. 铜是重要过渡元素,能形成多种配合物,如Cu+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。下列说法不正确的是( )
A、基态的未成对电子数为1 B、配离子中N原子提供孤对电子 C、乙二胺和三甲胺均属于胺,沸点更高的是三甲胺 D、配离子中涉及的元素的电负性由大到小的顺序为N>C>H>Cu15. 铜是重要过渡元素,能形成多种配合物,如Cu+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。下列说法不正确的是( ) A、1mol 乙二胺分子中含有11NA个σ键 B、乙二胺分子中氮原子轨道的杂化类型为 sp3 C、Cu+与乙二胺形成的配离子内部含有极性键、非极性键、配位键和离子键 D、乙二胺和三甲胺[分子式为 N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因乙二胺分子间可形成氢键,三甲胺分子间不能形成氢键16. 沸点为316℃,常用于蚀刻电路板。硫酸亚铁铵[]常用于治疗缺铁性贫血,向硫酸亚铁铵溶液中加入几滴双氧水,振荡后再向其中滴加几滴KSCN溶液,溶液呈红色,该红色物质为下列说法错误的是( )A、中三种非金属元素的氢化物沸点大小一定符合 B、为分子晶体 C、与具有相似的空间构型 D、中心离子的配位数为617. 的配位化合物较稳定且用途广泛。可与、、等配体形成溶液呈浅紫色的、红色的、无色的配离子。某同学按如下步骤完成实验:
A、1mol 乙二胺分子中含有11NA个σ键 B、乙二胺分子中氮原子轨道的杂化类型为 sp3 C、Cu+与乙二胺形成的配离子内部含有极性键、非极性键、配位键和离子键 D、乙二胺和三甲胺[分子式为 N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因乙二胺分子间可形成氢键,三甲胺分子间不能形成氢键16. 沸点为316℃,常用于蚀刻电路板。硫酸亚铁铵[]常用于治疗缺铁性贫血,向硫酸亚铁铵溶液中加入几滴双氧水,振荡后再向其中滴加几滴KSCN溶液,溶液呈红色,该红色物质为下列说法错误的是( )A、中三种非金属元素的氢化物沸点大小一定符合 B、为分子晶体 C、与具有相似的空间构型 D、中心离子的配位数为617. 的配位化合物较稳定且用途广泛。可与、、等配体形成溶液呈浅紫色的、红色的、无色的配离子。某同学按如下步骤完成实验:
已知:向的溶液中加入KSCN溶液生成蓝色的的配离子;不能与形成配位离子。下列说法正确的是( )
A、和最外层电子数相同 B、向溶液Ⅰ中滴加少量NaOH溶液,溶液逐渐变为浅紫色 C、配离子中的键角与分子中的键角相等 D、可用NaF和KSCN溶液检验溶液中是否含有18. 向盛有硫酸铜溶液的试管里加入氨水,首先形成难溶物;继续滴加氨水,难溶物溶解得到深蓝色的透明溶液;再加入适量乙醇,并用玻璃棒摩擦试管壁,析出深蓝色的晶体.与上述实验相关的说法中正确的是( )A、沉淀溶解后,生成深蓝色的配离子 B、析出的深蓝色晶体是 C、中含有共价键 D、中,提供空轨道,的原子给出孤电子对19. 配合物种类繁多,在分析化学、工业生产以及生物学中有广泛应用。已知某配合物的化学式为[TiCl(H2O)5]Cl2∙H2O,下列有关说法正确的是( )A、该配合物中存在离子键、配位键和极性键 B、中心离子是Ti4+ , 配离子是[TiCl(H2O)5]2+ C、配体是Cl-和H2O,配位数是9 D、加入足量AgNO3溶液,所有Cl-均以沉淀形式存在20. 铁及其化合物在工业生产中具有重要的用途。已知NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4。下列有关说法正确的是( ) A、该配合物中阴离子空间构型为平面四边形 B、配离子为[Fe(NO)(H2O)5]2+ , 配位数为5 C、如图所示γ-Fe 的晶胞中,铁原子的配位数为4 D、基态Fe2+中,未成对电子数目为421. 已知两种颜色不同的晶体,分子式均为 , 配位数都是6。分别取0.01mol两种晶体在水溶液中用过量处理,绿色晶体得到的白色沉淀质量为紫色晶体得到沉淀质量的 , 则下列有关说法不正确的是( )A、该绿色晶体配体是氯离子和水,它们物质的量之比为1:5 B、紫色晶体配合物的化学式为 C、1mol紫色晶体中包含的σ键个数为 D、0.01mol紫色晶体在水溶液中与过量作用最多可得到4.305g沉淀22. Rh的配合物
A、该配合物中阴离子空间构型为平面四边形 B、配离子为[Fe(NO)(H2O)5]2+ , 配位数为5 C、如图所示γ-Fe 的晶胞中,铁原子的配位数为4 D、基态Fe2+中,未成对电子数目为421. 已知两种颜色不同的晶体,分子式均为 , 配位数都是6。分别取0.01mol两种晶体在水溶液中用过量处理,绿色晶体得到的白色沉淀质量为紫色晶体得到沉淀质量的 , 则下列有关说法不正确的是( )A、该绿色晶体配体是氯离子和水,它们物质的量之比为1:5 B、紫色晶体配合物的化学式为 C、1mol紫色晶体中包含的σ键个数为 D、0.01mol紫色晶体在水溶液中与过量作用最多可得到4.305g沉淀22. Rh的配合物 (是膦配体,S是溶剂分子)在乙烯加氢反应过程中的催化机理如下:
(是膦配体,S是溶剂分子)在乙烯加氢反应过程中的催化机理如下:
下列说法不正确的是( )
A、催化过程中,既有非极性键的断裂和生成,也有极性键的断裂和生成 B、催化过程中,Rh的配位数发生了改变 C、使用Rh催化剂加快反应速率的原因是提高了该反应的活化分子百分数 D、该反应的总反应是:23. 已知:铜离子的配位数通常4,和均为深蓝色。某化学小组设计如下实验制备铜的配合物。下列说法错误的是( ) A、硫酸铜溶液呈蓝色是因为与结合形成 B、b中得到配合物 , 其配体为 C、由实验可知,的配位能力比弱 D、加热c中溶液有可能得到蓝色浑浊液24. 是一种配合物。下列说法正确的是( )A、和的性质不一样 B、中心离子与之间形成的化学键是离子键 C、在中给出孤电子对,提供空轨道 D、向盛有溶液的试管中,滴入硫氰化钾溶液,溶液变为血红色
A、硫酸铜溶液呈蓝色是因为与结合形成 B、b中得到配合物 , 其配体为 C、由实验可知,的配位能力比弱 D、加热c中溶液有可能得到蓝色浑浊液24. 是一种配合物。下列说法正确的是( )A、和的性质不一样 B、中心离子与之间形成的化学键是离子键 C、在中给出孤电子对,提供空轨道 D、向盛有溶液的试管中,滴入硫氰化钾溶液,溶液变为血红色二、非选择题
-
25. 是一种易溶于热水,难溶于乙醇的紫红色晶体。可通过如下实验步骤制备。
Ⅰ.将适量氯化铵溶于浓氨水中,搅拌下,分批次加入研细的 , 得到沉淀。
Ⅱ.边搅拌边慢慢滴入足量溶液,得到溶液。
Ⅲ.慢慢注入适量浓盐酸,得到沉淀,水浴加热,冷却至室温,得到紫红色晶体,减压过滤。
Ⅳ.依次用不同试剂洗涤晶体,烘干,得到产品。
回答下列问题:
(1)、本实验涉及钴配合物的配体有(填化学式)。(2)、本实验应在通风橱中进行,原因是。(3)、步骤Ⅰ中分批次加入研细的 , 原因是。(4)、步骤Ⅱ发生反应的离子方程式是。(5)、步骤Ⅳ中使用的洗涤试剂有:①冷水 ②乙醇 ③冷的盐酸 ④丙酮。试剂使用的先后顺序是:①④(填序号)。(6)、已知:;。则在水溶液中的稳定性:(填“大于”或“小于”)。(7)、本实验的产率最接近于____(填标号)。A、 B、 C、 D、26. 酸雨的危害非常严重,它会导致生物死亡,古建筑被腐蚀和破坏,现代钢铁建筑很快锈蚀,土壤酸化,作物难以生长,严格控制酸性气体的排放意义重大。(1)、臭氧在催化下能将烟气中的、分别氧化为和、也可在其他条件下被还原为。的空间构型为 , 中心原子轨道的杂化类型为。(2)、基态核外电子排布式为。(3)、能被溶液吸收生成配含物 , 其中心离子的配位数为。(4)、以N原子与形成配位键。请在结构示意图的相应位置补填缺少的配体。 27. 配合物在许多尖端领域如激光材料、超导材料、抗癌药物、催化剂、自组装超分子等方面有广泛的应用。回答下列问题:(1)、Ni与CO形成的配合物Ni(CO)4为无色液体,易溶于CCl4、CS2等有机溶剂。碳原子的核外电子排布式为。CO的结构式为C≡O,则Ni(CO)4分子中σ键与π键个数之比为。(2)、胆矾溶于水后可得蓝色的水合铜离子,其中的配位数是。胆矾晶体的结构如下图所示,其存在的化学键有(填字母)。
27. 配合物在许多尖端领域如激光材料、超导材料、抗癌药物、催化剂、自组装超分子等方面有广泛的应用。回答下列问题:(1)、Ni与CO形成的配合物Ni(CO)4为无色液体,易溶于CCl4、CS2等有机溶剂。碳原子的核外电子排布式为。CO的结构式为C≡O,则Ni(CO)4分子中σ键与π键个数之比为。(2)、胆矾溶于水后可得蓝色的水合铜离子,其中的配位数是。胆矾晶体的结构如下图所示,其存在的化学键有(填字母)。A.离子键 B.极性键 C.范德华力 D.氢键 E.配位键
 (3)、金属Ni可以与Mg、C形成一种新型超导体,它的临界温度为8K,由C、Mg、Ni形成的某物质的晶胞为正六面体,结构如图所示。
(3)、金属Ni可以与Mg、C形成一种新型超导体,它的临界温度为8K,由C、Mg、Ni形成的某物质的晶胞为正六面体,结构如图所示。
①该物质的化学式为。
②每个Mg原子距离最近的Ni原子的个数是。
③若用NA表示阿伏加德罗常数的值,如果晶体的密度为ρg/cm3 , 则该晶胞的体积为nm3(用含ρ、NA的代数式表示)。
28. 按要求回答以下问题:现有的配合物 , 其中配离子是 , 配位数为;在0.2mol该配合物溶液中滴加足量的溶液,产生沉淀的物质的量为。