【备考2024年】从巩固到提高 高考化学二轮微专题28 离子共存
试卷更新日期:2024-02-23 类型:二轮复习
一、选择题
-
1. 在溶液中能大量共存的离子组是( )A、H+、I﹣、Ba2+、 B、Fe3+、K+、CN﹣、Cl﹣ C、Na+、、Br﹣、Ca2+ D、、、CH3COO﹣、2. 室温下,下列离子在指定溶液中能大量共存的是( )A、在澄清的溶液中: B、溶液中: C、在稀氢氧化钠溶液中: D、在稀盐酸中:3. 室温下,经指定操作后,下列各组溶液中的离子还能大量共存的是A、通入足量:、、、 B、通入适量:、、、 C、通入足量HCl:、、、 D、通入足量:、、、4. 有一澄清透明的溶液,可能含有大量的、、、、、 、中的几种,向该溶液中滴入 溶液一定体积后才产生沉淀。下列判断正确的是 ( )A、溶液中可能含有 B、溶液中一定不含 C、溶液中可能含有 D、溶液中一定不含5. 溶液A中含有如下离子中的若干种:Na+、NH、Mg2+、SO、SO、Cl-、OH-。为确定溶液中所含离子,现取该溶液进行有关实验,实验结果如下:
下列说法正确的是 ( )
 A、气体E能使湿润的蓝色石蕊试纸先变红后褪色 B、若向沉淀B中加入足量稀硝酸,最终得到4.66 g沉淀 C、滤液C中大量存在的离子有NH、Ba2+、Cl-、OH- D、溶液A中可能有Na+ , 无Cl-6. 常温下,下列各组离子一定能在指定溶液中大量共存的是A、加入铝产生氢气的溶液: B、澄清透明的溶液: C、能使甲基橙试液显红色的溶液: D、水电离的的溶液:7. 常温下,下列各组离子在指定溶液中能大量共存的是A、澄清透明的溶液中:、、、 B、能使酚酞变红的溶液中:、、、 C、麦芽糖溶液中:、、、 D、含的溶液中:、、、8. 常温下,下列各组离子在指定溶液中能大量共存的是A、pH=1的溶液中:Fe2+、NO、SO、Na+ B、由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Al3+、K+、Cl-、HCO C、=1012的溶液中:NH、Al3+、NO、Cl- D、c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO、SCN-9. 下列各粒子组在溶液中能否大量共存的判断和分析均正确的是
A、气体E能使湿润的蓝色石蕊试纸先变红后褪色 B、若向沉淀B中加入足量稀硝酸,最终得到4.66 g沉淀 C、滤液C中大量存在的离子有NH、Ba2+、Cl-、OH- D、溶液A中可能有Na+ , 无Cl-6. 常温下,下列各组离子一定能在指定溶液中大量共存的是A、加入铝产生氢气的溶液: B、澄清透明的溶液: C、能使甲基橙试液显红色的溶液: D、水电离的的溶液:7. 常温下,下列各组离子在指定溶液中能大量共存的是A、澄清透明的溶液中:、、、 B、能使酚酞变红的溶液中:、、、 C、麦芽糖溶液中:、、、 D、含的溶液中:、、、8. 常温下,下列各组离子在指定溶液中能大量共存的是A、pH=1的溶液中:Fe2+、NO、SO、Na+ B、由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Al3+、K+、Cl-、HCO C、=1012的溶液中:NH、Al3+、NO、Cl- D、c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO、SCN-9. 下列各粒子组在溶液中能否大量共存的判断和分析均正确的是选项
粒子组
判断和分析
A
、、、
不能大量共存,因发生反应:
B
、、、
不能大量共存,因发生水解
C
、、、
不能大量共存,因和发生氧化还原反应
D
、、、
不能大量共存,因发生反应:
A、A B、B C、C D、D10. 有一澄清透明的溶液,只可能含有大量的、、、、、、七种离子中的几种,向该溶液中逐滴滴入溶液一定体积后才产生沉淀。则下列判断正确的是A、溶液中可能含有 B、溶液中可能含有 C、溶液中一定不含 D、溶液中一定含有11. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、c(Al3+)=0.5mol/L的溶液中:K+、、、 B、在c(H+)∶c(OH-)=1∶1012的溶液中:Na+、I-、、 C、含有0.1mol/LFe3+的溶液中:K+、Mg2+、I-、 D、能溶解Al(OH)3的溶液中:、K+、、12. 某溶液含下表中的几种离子,离子浓度均为0.1(不考虑水的电离与离子水解)。向该溶液中加入足量盐酸,有无色气体生成,经分析,反应前后阴离子种类不变。下列关于原溶液的说法错误的是( )阳离子
阴离子
、、、、、
、、、、、
A、有 B、无或 C、可能有 D、可能有13. 下列各组离子在指定环境中一定能大量共存的是( )A、使pH试纸显深红色的溶液中:Fe3+、SO、S2-、Cl- B、与铝粉反应放出氢气的无色溶液中:NO、Al3+、Na+、SO C、使红色石蕊试纸变蓝的溶液中:SO、Na+、CO、K+ D、水电离的OH-浓度为10-12mol·L-1的溶液中:Mg2+、NH、AlO、SO14. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、在澄清透明的溶液中:Fe3+、Mn2+、、Cl- B、能使甲基橙显红色的溶液中:Zn2+、H+、ClO-、I- C、含0.1 mol· L-1NaHSO4 的溶液:K+、Al3+、、 D、=1. 0× 10-12的溶液:、Na+、、15. 某100mL溶液可能含有Na+、NH、Fe3+、CO、SO、Cl-中的若干种,取该溶液进行连续实验,实验过程如图(所加试剂均过量,气体全部逸出)。下列说法错误的是( ) A、原溶液一定存在CO和SO , 一定不存在Fe3+ B、原溶液一定存在Cl- , 可能存在Na+ C、原溶液中c(Cl-)≥0.1mol·L-1 D、若原溶液中不存在Na+ , 则c(Cl-)<0.1mol·L-116. 某溶液中只可能含有K+、、Fe2+、Al3+、Cl-、、、中的若干种离子,离子浓度均为0.1mol·L-1.某同学进行了如下实验,下列说法正确的是( )
A、原溶液一定存在CO和SO , 一定不存在Fe3+ B、原溶液一定存在Cl- , 可能存在Na+ C、原溶液中c(Cl-)≥0.1mol·L-1 D、若原溶液中不存在Na+ , 则c(Cl-)<0.1mol·L-116. 某溶液中只可能含有K+、、Fe2+、Al3+、Cl-、、、中的若干种离子,离子浓度均为0.1mol·L-1.某同学进行了如下实验,下列说法正确的是( )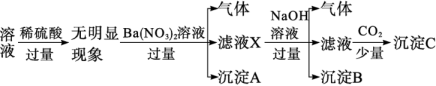 A、原溶液中含有Al3+、不含 B、原溶液中存在、Fe2+、Cl-、 C、沉淀C中含有BaCO3、Al(OH)3 D、滤液X中大量存在的阳离子有、Fe2+和Ba2+17. 某溶液含Na+、NH、SO、Cl-、Fe2+、Fe3+中的几种,且各离子浓度相同。为确定其组成,进行实验:①取少量溶液,加入足量HNO3酸化的Ba(NO3)2(aq),产生白色沉淀,过滤;②向滤液中加入足量的NaOH(aq),产生红褐色沉淀,微热,产生气体。
A、原溶液中含有Al3+、不含 B、原溶液中存在、Fe2+、Cl-、 C、沉淀C中含有BaCO3、Al(OH)3 D、滤液X中大量存在的阳离子有、Fe2+和Ba2+17. 某溶液含Na+、NH、SO、Cl-、Fe2+、Fe3+中的几种,且各离子浓度相同。为确定其组成,进行实验:①取少量溶液,加入足量HNO3酸化的Ba(NO3)2(aq),产生白色沉淀,过滤;②向滤液中加入足量的NaOH(aq),产生红褐色沉淀,微热,产生气体。关于原溶液的说法正确的是( )
A、不能确定是否有Fe3+ B、需通过焰色反应确定Na+是否存在 C、Fe2+、Fe3+都存在 D、存在NH、SO、Cl-、Fe2+18. 对下列粒子组在水溶液中能否大量共存的判断和分析均正确的是( )选项
粒子组
判断和分析
A
Cl2、K+、CO、NO
能大量共存,粒子间不反应
B
SO2、Na+、Ca2+、 Cl-
能大量共存,粒子间不反应
C
H+、K+、S2-、SO
不能大量共存,主要发生反应:3S2-+SO+8H+= 4S↓+ 4H2O
D
NH3·H2O、Na+、Al3+、 Cl-
不能大量共存,主要发生反应:Al3++4NH3·H2O= AlO+4NH+2H2O
A、A B、B C、C D、D19. 下列关于离子反应或离子共存表达正确的是( )A、以下离子在0.1mol·L-1NaOH溶液中能大量共存:Na+、K+、 、 B、以下离子在0.1mol·L-1K2CO3溶液中能大量共存:Na+、Ba2+、Cl-、OH- C、向氯化铝溶液中滴加过量氨水:4NH3·H2O+Al3+= +4 +2H2O D、漂白粉漂白原理:Ca(ClO)2+2CO2+2H2O=Ca(HCO3)2+2HClO20. 常温下,下列各组离子在指定溶液中可能大量共存的是( )A、含的溶液中:、、、 B、由水电离产生c(OH−)=1×10−13mol·L−1的溶液中:、、、 C、在有色透明溶液中:、、、 D、加入甲基橙显黄色的溶液:、、、21. 无色溶液中可能含有Na+、K+、、Ca2+、Cu2+、、、Cl-、Br-、中的若干种,离子的物质的量浓度都为0.1 mol/L。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如图所示实验,则下列关于原溶液的判断正确的是( ) A、无法确定原溶液中是否存在Cl- B、肯定存在的离子是、Br- , 是否存在Na+、K+需要通过焰色反应来确定 C、肯定不存在的离子是Ca2+、Cu2+、、 , 是否含另需实验验证 D、若步骤中Ba(NO3)2和HNO3的混合溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响22. 某溶液中只可能含有 中的几种离子,各离子浓度均为 。某同学进行了如下实验:
A、无法确定原溶液中是否存在Cl- B、肯定存在的离子是、Br- , 是否存在Na+、K+需要通过焰色反应来确定 C、肯定不存在的离子是Ca2+、Cu2+、、 , 是否含另需实验验证 D、若步骤中Ba(NO3)2和HNO3的混合溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响22. 某溶液中只可能含有 中的几种离子,各离子浓度均为 。某同学进行了如下实验:
下列说法正确的是( )
A、无法确定原溶液中是否含有 B、原溶液中肯定存在的离子为 C、沉淀A为 ,沉淀C为 和 D、滤液X中大量存在的阳离子有 和23. 某溶液中可能含浓度均为0.5mol/L的 、 、 、 、 、 中的若干种。向该溶液中逐滴加入稀HCl至过量,无明显现象,得到溶液X,对X进行如下实验:
根据上述实验现象得出的结论,错误的是( )
A、可能含 、 、 B、沉淀N是 C、一定含 、 D、再检验一种离子即可确定原溶液成分24. 某无色透明溶液中可能存在Br-、 、 、Al3+、I-、Na+、Cu2+中的若干种。现进行如下实验,得到如下现象:①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,有白色沉淀生成,加入盐酸后沉淀不溶解;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
已知:5Cl2+I2+6H2O=10HCl+2HIO3
据此可以判断,该溶液中肯定存在的离子组是( )
A、Na+、 、 、Br- B、Al3+、Na+、 、Br- C、Al3+、 、I-、Br- D、Al3+、Br-、 、Cu2+25. 下列离子方程式书写及评价合理的是( )选项
离子方程式
评价
A
溶液中加入足量 溶液
正确, 过量,酸式盐与碱完全反应生成正盐和水:
B
的 溶液与 的 溶液等体积混合
正确, 与H按物质的量1:1反应转化为 ,过量的 再将一半 转化为
C
将少量的 溶解在过量的稀 中
正确, 化学式可改写为 , 与 ,物质的量之比为1:2
D
将 溶液加入到足量的 溶液中
错误, 与 发生氧化还原反应:2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+
A、A B、B C、C D、D26. 某化学实验室产生的废液中的阳离子只可能含有Na+、NH4+、Ba2+、Cu2+、Al3+、Fe2+、Fe3+中的某几种,实验室设计了下述方案对废液进行处理,以回收金属,保护环境。
已知:步骤①中,滴加NaOH溶液过程中产生的沉淀会部分溶解。下列说法中正确的是( )
A、根据步骤①的现象,说明废液中一定含有Al3+ B、由步骤②中红棕色固体可知,废液中一定存在Fe3+ C、沉淀甲中可能含有Al(OH)3 D、该废液中一定含有NH4+、Ba2+、Cu2+、Fe2+和Fe3+至少存在一种二、非选择题
-
27. 在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
阳离子
K+、Ag+、Mg2+、Ba2+
阴离子
NO3-、CO32-、SiO32-、SO42-
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
序号
实验内容
实验结果
Ⅰ
向该溶液中加入足量稀HCl
产生白色沉淀并放出0.56L气体
Ⅱ
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量
固体质量为2.4g
Ⅲ
在Ⅱ的滤液中滴加BaCl2溶液
无明显现象
试回答下列问题:
(1)、实验I能确定一定不存在的阳离子是。(2)、实验I中生成沉淀的离子方程式为。(3)、通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“不能确定”)阴离子
NO3-
CO32-
SiO32-
SO42-
c/mol·L-1
(4)、判断K+是否存在,若存在求其最小浓度(若不存在说明理由)。28.某待测溶液中可能含有SO42﹣、SO32﹣、CO32﹣、HCO3﹣、NO3﹣、Cl﹣、Br﹣中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出).

请回答下列问题:
(1)、根据上述框图信息填写下表(不能确定的不填):肯定存在的离子
肯定没有的离子
化学式或离子符号
(2)、写出沉淀A三种可能的情况: , 若气体D遇空气变红棕色,则生成沉淀D时肯定发生的反应的离子方程式为 .(3)、若Mn+位于第三周期,则要确定它具体是何种离子的方法是 .29. 实验测得pH=1.0的某溶液中还可能大量存在:Na+、Fe2+、Al3+、NH4+、SO42﹣、Cl﹣中的若干种离子,现进行了如下实验:步骤I,取该溶液10.0mL,加入过量1.0mol/L Ba(NO3)2溶液,产生白色沉淀A和无色气体B,B遇空气立即变为红棕色;
步骤Ⅱ.向I所得的溶液中加入过量1.0mol/L NaOH溶液,有红褐色沉淀C和无色刺激性气体D生成.用铂丝蘸取所得溶液,在火焰上灼烧,火焰呈黄色;
步骤Ⅲ.向Ⅱ所得的溶液中通入过量CO2有沉淀E生成.
下列推断错误的是( )
A、步骤I中白色沉淀A的化学式为BaSO4 B、步骤Ⅱ中产生沉淀C的反应:Fe3++3OH﹣=Fe(OH)3↓ C、原溶液一定含有:Na+、Fe2+、Al3+、SO42﹣ D、CO2先后分别与NaOH(aq)、NaAlO2( aq)反应30. 常见的六种盐A、B、C、D、E、F,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+ , 阴离子可能是Cl﹣、NO 、SO 、CO 、SO ,(阴、阳离子可能重复)已知:①六种盐均溶于水,水溶液均为无色.
②A的溶液呈中性,B、C、E的溶液呈酸性,D、F的溶液呈碱性.
③D、F的焰色反应呈黄色,向F溶液加入少量FeCl3溶液,得到浅绿色溶液.
④若在这六种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失.
⑤若在这六种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀.
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀.
请回答下列问题:
(1)、六种盐中,一定没有的阳离子是;(2)、B的化学式是 , C的化学式是;(3)、F中包含的金属元素其单质通常用法冶炼;(4)、向D的溶液中逐滴加入盐酸现象为;(5)、若E作净水剂,用离子方程式表示其原理为;(6)、写出F溶液与FeCl3溶液反应的离子方程式 .31. 已知四种电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH 、Ba2+、Na+、H+、SO 、NO 、OH﹣、CO .将这四种溶液分别标记为A、B、C、D,进行如下实验:①在A或D中滴入C,均有沉淀生成; ②D和B反应生成的气体能被A吸收;③A和D反应生成的气体能被B吸收. 试回答下列问题:
(1)、写出这四种物质的化学式:A , B , C , D(2)、写出实验②中有关反应得化学方程式 .32. 现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).阳离子
H+、Na+、Al3+、Ag+、Ba2+
阴离子
OH﹣、Cl﹣、CO 、NO3、SO
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物
(1)、将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: .(2)、写出E溶液与过量的B溶液反应的离子方程式 .(3)、已知:NaOH(aq)+HNO3(aq)═NaNO3(aq)+H2O(l);△H=﹣akJ•mol﹣1 . 请写出B与C的稀溶液反应的热化学方程式 .(4)、在100mL 0.1 mol•L﹣1E溶液中,逐滴加入35 mL 2 mol•L﹣1NaOH溶液,最终得到沉淀的物质的量为 .33. 现有五种可溶性物质甲、乙、丙、丁、戊,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Al3+、Cu2+、Ba2+、Fe3+和五种阴离子Cl﹣、OH﹣、NO 、CO 、X中的一种.(1)、某同学通过分析比较,认为无需检验就可判断其中必有的两种物质是和 . (填化学式)(2)、物质丙中含有离子X.为了确定X,现将(1)中的两种物质记为甲和乙,当丙与甲的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀硝酸,沉淀部分溶解,剩余白色固体,则物质丙为 . (填化学式)(3)、将19.2g Cu投入装有足量丁溶液的试管中,Cu不溶解,再滴加稀硫酸,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式 , 若要将Cu完全溶解,至少加入硫酸的物质的量是 .(4)、戊溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为 .34.某透明的X溶液中可能含有下列离子中的几种,100mL溶液中的每种阴离子的物质的量均为0.2mol,每种阳离子的物质的量均为0.1mol.取100mL该溶液进行如下连续实验,操作①反应中消耗 NO3﹣为0.1mol.
阴离子
MnO4﹣、SiO32﹣、CO32-、I﹣、ClO﹣、Cl﹣、SO42﹣
阳离子
Fe2+、Fe3+、NH4+、Ag+、Al3+
 (1)、沉淀C、G的化学式分别为 ,(2)、X溶液中肯定含有的离子是(3)、写出操作①中产生气体A的离子方程式:(4)、写出操作②发生的离子方程式:
(1)、沉淀C、G的化学式分别为 ,(2)、X溶液中肯定含有的离子是(3)、写出操作①中产生气体A的离子方程式:(4)、写出操作②发生的离子方程式: