【备考2024年】从巩固到提高 高考化学二轮微专题27 难溶电解质的溶解平衡及沉淀转化
试卷更新日期:2024-02-23 类型:二轮复习
一、选择题
-
1. 室温下,向、均为的混合溶液中持续通入气体,始终保持饱和(的物质的量浓度为),通过调节使、分别沉淀,溶液中与的关系如下图所示。其中,c表示、、和的物质的量浓度的数值,。下列说法错误的是( )
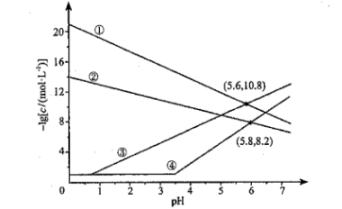 A、①代表与的关系曲线 B、逐渐增大时,溶液中优先析出的沉淀为 C、的 D、的平衡常数2. 向溶液中滴加溶液,发生反应和。与的关系如下图所示(其中代表或)。下列说法错误的是( )
A、①代表与的关系曲线 B、逐渐增大时,溶液中优先析出的沉淀为 C、的 D、的平衡常数2. 向溶液中滴加溶液,发生反应和。与的关系如下图所示(其中代表或)。下列说法错误的是( ) A、时,溶液中 B、时,溶液中 C、的平衡常数的值为 D、用沉淀 , 溶液中浓度过大时,沉淀效果不好3. 一定温度下,将足量的固体溶于水中,充分搅拌,慢慢加入固体,随着增大,溶液中的变化曲线如图所示。下列说法正确的是( )。
A、时,溶液中 B、时,溶液中 C、的平衡常数的值为 D、用沉淀 , 溶液中浓度过大时,沉淀效果不好3. 一定温度下,将足量的固体溶于水中,充分搅拌,慢慢加入固体,随着增大,溶液中的变化曲线如图所示。下列说法正确的是( )。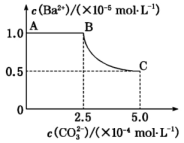 A、该温度下, B、加入固体,立即有固体生成 C、B点表示的溶液中, D、该温度下,在水中的大于在溶液中的4. 某温度下,向10mL0.1mol·L−1Pb(NO3)2溶液中滴加0.1mol·L−1Na2S溶液,溶液中-lgc(Pb2+)与滴加的Na2S溶液体积V的关系如图所示(忽略体积变化)。已知:Ksp(PbS)<Ksp(FeS)。下列判断正确的是( )
A、该温度下, B、加入固体,立即有固体生成 C、B点表示的溶液中, D、该温度下,在水中的大于在溶液中的4. 某温度下,向10mL0.1mol·L−1Pb(NO3)2溶液中滴加0.1mol·L−1Na2S溶液,溶液中-lgc(Pb2+)与滴加的Na2S溶液体积V的关系如图所示(忽略体积变化)。已知:Ksp(PbS)<Ksp(FeS)。下列判断正确的是( ) A、a、b、c三点中Ksp(PbS)从大到小的顺序为:a>b>c B、b点:c(Pb2+)<c(S2−) C、c点:2c(Pb2+)+c(H+)=c(NO3−)+c(OH−) D、其他条件相同时,若将Pb(NO3)2溶液换成同浓度、同体积的Fe(NO3)2溶液,图中-lgc(Pb2+)换成-lgc(Fe2+),则b点会沿虚线向下移动5. 时,用的溶液分别滴定体积均为且浓度均为的及溶液,其滴定曲线如图。
A、a、b、c三点中Ksp(PbS)从大到小的顺序为:a>b>c B、b点:c(Pb2+)<c(S2−) C、c点:2c(Pb2+)+c(H+)=c(NO3−)+c(OH−) D、其他条件相同时,若将Pb(NO3)2溶液换成同浓度、同体积的Fe(NO3)2溶液,图中-lgc(Pb2+)换成-lgc(Fe2+),则b点会沿虚线向下移动5. 时,用的溶液分别滴定体积均为且浓度均为的及溶液,其滴定曲线如图。已知:时,及溶度积常数依次为 , 下列说法正确的是( )
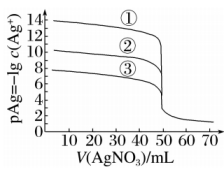 A、 B、滴定曲线①表示的滴定曲线 C、滴定时,可加入少量的作指示剂 D、当溶液滴定至时,溶液中6. 某温度下,向体积均为20.00mL、浓度均为0.1mol•L﹣1的NaCl、Na2CrO4溶液中分别滴加0.1mol•L﹣1的AgNO3溶液,滴定过程中的pX(pX=﹣lgX,X=Cl﹣、CrO42﹣)与滴加AgNO3溶液体积关系如图所示(lg3=0.47)。下列说法错误的是( )
A、 B、滴定曲线①表示的滴定曲线 C、滴定时,可加入少量的作指示剂 D、当溶液滴定至时,溶液中6. 某温度下,向体积均为20.00mL、浓度均为0.1mol•L﹣1的NaCl、Na2CrO4溶液中分别滴加0.1mol•L﹣1的AgNO3溶液,滴定过程中的pX(pX=﹣lgX,X=Cl﹣、CrO42﹣)与滴加AgNO3溶液体积关系如图所示(lg3=0.47)。下列说法错误的是( )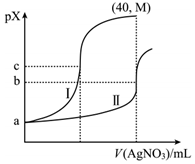 A、a=1 B、曲线I表示NaCl溶液 C、Ksp(Ag2CrO4)=1.0×10﹣2b D、M约为2c﹣1.477. 常温下,AgCl(白色)与(砖红色)的沉淀溶解平衡曲线如图所示, , , 或。下列说法错误的是( )
A、a=1 B、曲线I表示NaCl溶液 C、Ksp(Ag2CrO4)=1.0×10﹣2b D、M约为2c﹣1.477. 常温下,AgCl(白色)与(砖红色)的沉淀溶解平衡曲线如图所示, , , 或。下列说法错误的是( )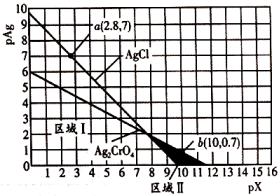 A、 B、区域Ⅰ只存在AgCl沉淀,区域Ⅱ只存在沉淀 C、向、均为0.1mol/L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀 D、反应的平衡常数K为8. 下,三种硫酸盐、、的沉淀溶解平衡曲线如下图所示。已知。下列说法正确的是( )
A、 B、区域Ⅰ只存在AgCl沉淀,区域Ⅱ只存在沉淀 C、向、均为0.1mol/L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀 D、反应的平衡常数K为8. 下,三种硫酸盐、、的沉淀溶解平衡曲线如下图所示。已知。下列说法正确的是( )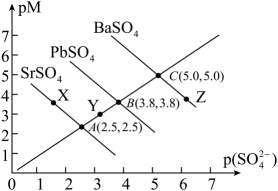 A、溶度积: B、点对是不饱和溶液,能继续溶解 C、点对应的溶液中 , 二者的浓度积等于 D、不可能转化成9. 硫化镉是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示.下列说法中不正确的是( )
A、溶度积: B、点对是不饱和溶液,能继续溶解 C、点对应的溶液中 , 二者的浓度积等于 D、不可能转化成9. 硫化镉是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示.下列说法中不正确的是( ) A、图中各点对应的即的关系为: B、向m点的溶液中加入少量固体,溶液组成由m沿线向p方向移动 C、图中a和b可分别表示温度下在水中的溶解能力 D、温度降低时,q点的饱和溶液的组成由q沿线向p方向移动10. 25℃时,CuS和ZnS悬浊液中对应离子浓度的对数值与的关系如图所示。下列说法不正确的是( )
A、图中各点对应的即的关系为: B、向m点的溶液中加入少量固体,溶液组成由m沿线向p方向移动 C、图中a和b可分别表示温度下在水中的溶解能力 D、温度降低时,q点的饱和溶液的组成由q沿线向p方向移动10. 25℃时,CuS和ZnS悬浊液中对应离子浓度的对数值与的关系如图所示。下列说法不正确的是( )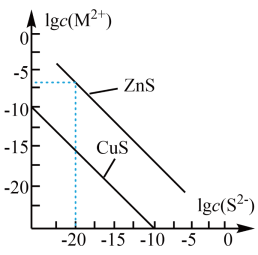 A、25℃时,ZnS的溶解度更大 B、25℃时,约为 C、在ZnS悬浊液中加入 , 可以发生反应 D、已知温度升高,CuS的溶解度增大,则图中对应线段向下平移11. 现进行下列实验。
A、25℃时,ZnS的溶解度更大 B、25℃时,约为 C、在ZnS悬浊液中加入 , 可以发生反应 D、已知温度升高,CuS的溶解度增大,则图中对应线段向下平移11. 现进行下列实验。将2滴0.1 mol/L 溶液滴入2 mL 0.1 mol/L NaCl溶液中,观察到生成白色沉淀。
振荡试管,然后向其中滴加4滴0.1mol/L KI溶液,静置。观察到沉淀变为黄色。
下列关于上述实验的分析错误的是( )
A、步骤(1)中存在沉淀溶解平衡: B、步骤(2)表明AgCl转化为AgI C、步骤(2)所得上层清液中不含 D、该实验可以证明AgI的比AgCl的小12. 硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如下图所示。下列说法错误的是( )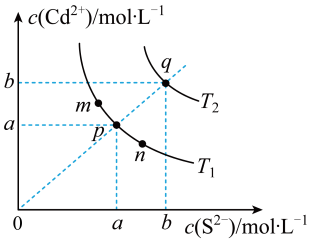 A、图中p和q分别为、温度下CdS达到沉淀溶解平衡 B、图中各点对应的的关系为: C、向m点的溶液中加入少量固体,溶液中浓度降低 D、温度降低时,q点饱和溶液的组成由q沿qp线向p方向移动13. 已知:T℃时,Ksp(CaSO4)=4.0×10-6、Ksp(CaCO3)=4.0×10-9、Ksp(PbCO3)=8.4×10-14 , 三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是( )
A、图中p和q分别为、温度下CdS达到沉淀溶解平衡 B、图中各点对应的的关系为: C、向m点的溶液中加入少量固体,溶液中浓度降低 D、温度降低时,q点饱和溶液的组成由q沿qp线向p方向移动13. 已知:T℃时,Ksp(CaSO4)=4.0×10-6、Ksp(CaCO3)=4.0×10-9、Ksp(PbCO3)=8.4×10-14 , 三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是( ) A、a线是CaSO4沉淀溶解平衡曲线 B、T℃时,向0.001mol CaCO3沉淀中加入Na2SO4溶液(反应后溶液为1L),使CaCO3沉淀会转化为CaSO4沉淀,所需Na2SO4的物质的量至少为1.001mol C、T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中= D、若d点表示CaCO3的饱和溶液加入CaSO4饱和溶液等体积混合则:c()<c(Ca2+)<c(SO)14. 向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应和 , 与的关系如下图所示(其中M代表、、或)。下列说法正确的是( )
A、a线是CaSO4沉淀溶解平衡曲线 B、T℃时,向0.001mol CaCO3沉淀中加入Na2SO4溶液(反应后溶液为1L),使CaCO3沉淀会转化为CaSO4沉淀,所需Na2SO4的物质的量至少为1.001mol C、T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中= D、若d点表示CaCO3的饱和溶液加入CaSO4饱和溶液等体积混合则:c()<c(Ca2+)<c(SO)14. 向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应和 , 与的关系如下图所示(其中M代表、、或)。下列说法正确的是( )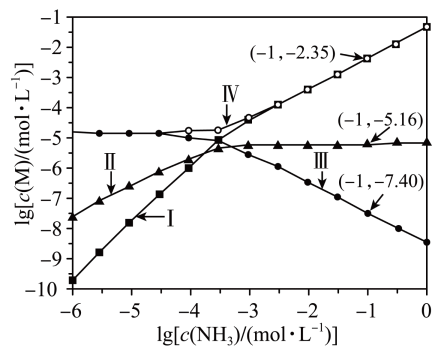 A、时,溶液中 B、曲线IV为随的变化曲线 C、时,溶液中 D、反应的平衡常数K的值为15. 某温度下,向溶液中滴加溶液,滴加过程中溶液中与溶液体积的关系如图所示,已知。下列说法正确的是( )
A、时,溶液中 B、曲线IV为随的变化曲线 C、时,溶液中 D、反应的平衡常数K的值为15. 某温度下,向溶液中滴加溶液,滴加过程中溶液中与溶液体积的关系如图所示,已知。下列说法正确的是( ) A、溶液b点可以通过升高温度到达c点 B、该温度下 C、b点溶液中: D、若把溶液换成等浓度溶液,则曲线变为Ⅱ16. ℃下,三种硫酸盐(M:、、)的沉淀溶解平衡曲线如下图所示.已知 , . 下列说法正确的是( )
A、溶液b点可以通过升高温度到达c点 B、该温度下 C、b点溶液中: D、若把溶液换成等浓度溶液,则曲线变为Ⅱ16. ℃下,三种硫酸盐(M:、、)的沉淀溶解平衡曲线如下图所示.已知 , . 下列说法正确的是( )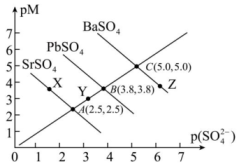 A、Y点对是不饱和溶液,能继续溶解 B、溶度积: C、不可能转化成 D、Z点对应的溶液中 , 二者的浓度积等于17. 常温下, , 常温下在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
A、Y点对是不饱和溶液,能继续溶解 B、溶度积: C、不可能转化成 D、Z点对应的溶液中 , 二者的浓度积等于17. 常温下, , 常温下在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )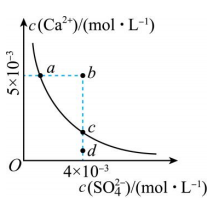 A、加入可使溶液由a点变到b点 B、b点将有沉淀生成,平衡后溶液中一定等于 C、d点溶液通过蒸发可以变到c点 D、a点对应的等于c点对应的18. 一定温度下,金属硫化物的沉淀溶解平衡曲线如图所示。纵坐标表示横坐标表示下列说法不正确的是( )
A、加入可使溶液由a点变到b点 B、b点将有沉淀生成,平衡后溶液中一定等于 C、d点溶液通过蒸发可以变到c点 D、a点对应的等于c点对应的18. 一定温度下,金属硫化物的沉淀溶解平衡曲线如图所示。纵坐标表示横坐标表示下列说法不正确的是( ) A、该温度下,Ag2S的sp-50 B、该温度下,溶解度的大小顺序为NiS>SnS C、SnS和NiS的饱和溶液中 D、向浓度均为0.01mol·L-1的Ag+、Ni2+、Sn2+混合溶液中逐滴加入饱和Na2S溶液,析出沉淀的先后顺序为Ag2S、SnS、NiS19. 常温下,Ag2S与CuS在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
A、该温度下,Ag2S的sp-50 B、该温度下,溶解度的大小顺序为NiS>SnS C、SnS和NiS的饱和溶液中 D、向浓度均为0.01mol·L-1的Ag+、Ni2+、Sn2+混合溶液中逐滴加入饱和Na2S溶液,析出沉淀的先后顺序为Ag2S、SnS、NiS19. 常温下,Ag2S与CuS在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( ) A、Ksp(Ag2S)=10-29.2 B、向含CuS沉淀的悬浊液中加入Na2S饱和溶液,Ksp (CuS)减小 C、若Z点为Ag2S的分散系,ν(沉淀)>ν(溶解) D、CuS(s)+2Ag+(aq)Ag2S(s)+Cu2+(aq)平衡常数很大,反应趋于完全20. 难溶盐可溶于盐酸,常温下,用HCl气体调节:浊液的pH,测得体系中或随的变化如图所示。下列说法正确的是( )
A、Ksp(Ag2S)=10-29.2 B、向含CuS沉淀的悬浊液中加入Na2S饱和溶液,Ksp (CuS)减小 C、若Z点为Ag2S的分散系,ν(沉淀)>ν(溶解) D、CuS(s)+2Ag+(aq)Ag2S(s)+Cu2+(aq)平衡常数很大,反应趋于完全20. 难溶盐可溶于盐酸,常温下,用HCl气体调节:浊液的pH,测得体系中或随的变化如图所示。下列说法正确的是( ) A、曲线N代表随的变化趋势 B、Y点溶液中存在 C、氢氟酸的 D、难溶盐的溶度积21. 常温下,用调节浊液的pH,测得在通入的过程中,体系中(X代表或)与的关系如图所示。下列说法正确的是( )。
A、曲线N代表随的变化趋势 B、Y点溶液中存在 C、氢氟酸的 D、难溶盐的溶度积21. 常温下,用调节浊液的pH,测得在通入的过程中,体系中(X代表或)与的关系如图所示。下列说法正确的是( )。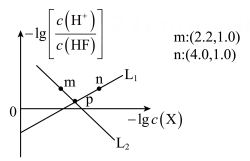
已知:为微溶于水,溶于盐酸,不溶于氢氟酸、乙醇和丙酮的固体。
A、 B、随着的加入,溶解度逐渐减小 C、p点对应的溶液中 D、M、n点时的溶液中均存在22. 常温下两种金属氢氧化物的溶解度(纵坐标以溶解金属质量/表示)与溶液的关系如图所示。下列说法正确的是( ) A、 B、X曲线仅最低点说明达到了溶解平衡 C、时溶度积: D、反应的平衡常数23. 一定温度下,向含一定浓度金属离子M2+(M2+代表、和)的溶液中通H2S气体至饱和c(H2S)为时,相应的金属硫化物在溶液中达到沉淀溶解平衡时的与pH关系如下图。下列说法不正确的是( )
A、 B、X曲线仅最低点说明达到了溶解平衡 C、时溶度积: D、反应的平衡常数23. 一定温度下,向含一定浓度金属离子M2+(M2+代表、和)的溶液中通H2S气体至饱和c(H2S)为时,相应的金属硫化物在溶液中达到沉淀溶解平衡时的与pH关系如下图。下列说法不正确的是( ) A、a点所示溶液中, B、该温度下, C、b点所示溶液中,可发生反应 D、Zn2+、Mn2+浓度均为的混合溶液,通入H2S并调控pH可实现分离24. 25℃时,向10mL0.10mol/LBaCl2溶液中滴加0.10mol/LNa2CO3溶液,滴加过程中溶液中-lgc(Ba2+)与Na2CO3溶液体积(V)的关系如图所示;Ksp=(BaSO4)=10-9.96 , 下列说法不正确的是( )
A、a点所示溶液中, B、该温度下, C、b点所示溶液中,可发生反应 D、Zn2+、Mn2+浓度均为的混合溶液,通入H2S并调控pH可实现分离24. 25℃时,向10mL0.10mol/LBaCl2溶液中滴加0.10mol/LNa2CO3溶液,滴加过程中溶液中-lgc(Ba2+)与Na2CO3溶液体积(V)的关系如图所示;Ksp=(BaSO4)=10-9.96 , 下列说法不正确的是( ) A、Ksp(BaCO3)=10-8.58 B、NH4HA溶液中:c(HA-)>c(NH)>c(H+)>c(OH-) C、若改用0.20mol/LNa2CO3溶液来滴定,则恰好反应点由b移至a D、若把Na2CO3溶液换成等浓度Na2SO4溶液,则曲线变为Ⅰ25. 一定温度下,向足量的AgBr固体中加入100mL水,充分搅拌,慢慢加入NaCl固体,随着增大,溶液中的变化曲线如图所示。下列说法不正确的是( )
A、Ksp(BaCO3)=10-8.58 B、NH4HA溶液中:c(HA-)>c(NH)>c(H+)>c(OH-) C、若改用0.20mol/LNa2CO3溶液来滴定,则恰好反应点由b移至a D、若把Na2CO3溶液换成等浓度Na2SO4溶液,则曲线变为Ⅰ25. 一定温度下,向足量的AgBr固体中加入100mL水,充分搅拌,慢慢加入NaCl固体,随着增大,溶液中的变化曲线如图所示。下列说法不正确的是( ) A、该温度下 B、从Y点到Z点发生的离子反应为 C、AgBr与AgCl在一定条件下可以相互转化 D、P点溶液中26. 下图为常温下、和在水中达沉淀溶解平衡时的关系图,图中;[可认为M离子沉淀完全]。下列叙述正确的是( )
A、该温度下 B、从Y点到Z点发生的离子反应为 C、AgBr与AgCl在一定条件下可以相互转化 D、P点溶液中26. 下图为常温下、和在水中达沉淀溶解平衡时的关系图,图中;[可认为M离子沉淀完全]。下列叙述正确的是( ) A、a点时, B、由b点可求得 C、浓度均为的和可以通过分步沉淀进行分离 D、在水中的沉淀溶解平衡可用离子方程式表示为27. 已知相同温度下, , 当说明沉淀转化比较彻底。某温度下,饱和溶液中、与的关系如图所示。下列说法错误的是( )。
A、a点时, B、由b点可求得 C、浓度均为的和可以通过分步沉淀进行分离 D、在水中的沉淀溶解平衡可用离子方程式表示为27. 已知相同温度下, , 当说明沉淀转化比较彻底。某温度下,饱和溶液中、与的关系如图所示。下列说法错误的是( )。 A、图中各点对应的的关系为 B、向c点的溶液加适量固体,可使溶液变到b点 C、根据曲线数据计算可知的数量级为 D、根据曲线数据计算可知加入能使比较彻底转化为28. 向饱和溶液(有足量固体)中滴加氨水,发生反应和与的关系如图所示{其中代表或}.
A、图中各点对应的的关系为 B、向c点的溶液加适量固体,可使溶液变到b点 C、根据曲线数据计算可知的数量级为 D、根据曲线数据计算可知加入能使比较彻底转化为28. 向饱和溶液(有足量固体)中滴加氨水,发生反应和与的关系如图所示{其中代表或}.
下列说法正确的是( )
A、曲线Ⅲ表示随的变化曲线 B、随增大,先增大后减小 C、反应的平衡常数为 D、完全溶解 , 至少需要含有的氨水29. 时,和的沉淀溶解平衡曲线如图所示。已知: , 或。下列说法正确的是( )
 A、曲线Ⅱ表示沉淀溶解平衡曲线 B、Z点对应的溶液中: C、Y点对应的溶液是过饱和溶液 D、时,在平衡体系中30. 某温度下,将足量的BaSO4固体溶于一定量的水中达到溶解平衡,加入Na2CO3使c()增大过程中,溶液中c(Ba2+)和c()的变化曲线如图所示(忽略溶液体积的变化)。下列说不正确的是( )
A、曲线Ⅱ表示沉淀溶解平衡曲线 B、Z点对应的溶液中: C、Y点对应的溶液是过饱和溶液 D、时,在平衡体系中30. 某温度下,将足量的BaSO4固体溶于一定量的水中达到溶解平衡,加入Na2CO3使c()增大过程中,溶液中c(Ba2+)和c()的变化曲线如图所示(忽略溶液体积的变化)。下列说不正确的是( ) A、当c()大于2.5×10-4mol・L-1时开始有BaCO3沉淀生成 B、“MN”代表沉淀转化过程中c(Ba2+)变化的曲线 C、该温度下,BaCO3比BaSO4更难溶于水 D、该温度下,BaSO4转换为BaCO3的平衡常数K=0.04
A、当c()大于2.5×10-4mol・L-1时开始有BaCO3沉淀生成 B、“MN”代表沉淀转化过程中c(Ba2+)变化的曲线 C、该温度下,BaCO3比BaSO4更难溶于水 D、该温度下,BaSO4转换为BaCO3的平衡常数K=0.04