【备考2024年】从巩固到提高 高考化学二轮微专题22 化学平衡图像分析
试卷更新日期:2024-02-23 类型:二轮复习
一、选择题
-
1. 肼()是一种含氢量高的燃料。向恒容密闭容器内加入 , 一定条件下体系中存在以下平衡:I.Ⅱ.不同温度下达到平衡时,均几乎完全分解,分解产物的物质的量如图。下列说法正确的是( )
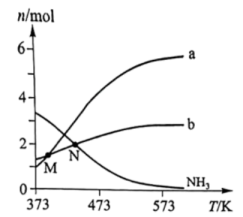 A、曲线a对应的物质是 B、低于M点对应温度时,以反应Ⅰ为主 C、体系中还存在 D、N点时,体系内为3:42. 某温度条件下,在某恒压容器中发生反应 , 部分反应物和生成物的物质的量随时间变化如图所示(曲线、)。下列说法正确的是( )
A、曲线a对应的物质是 B、低于M点对应温度时,以反应Ⅰ为主 C、体系中还存在 D、N点时,体系内为3:42. 某温度条件下,在某恒压容器中发生反应 , 部分反应物和生成物的物质的量随时间变化如图所示(曲线、)。下列说法正确的是( ) A、表示的物质的量随时间的变化 B、时刻反应速率: C、此反应的平衡常数 D、平衡后充入 , 再次达到平衡时物质的物质的量大于3. 臭氧在烟气脱硝中的反应为。向的恒容密闭容器中充入和充分反应,平衡时,的体积分数随温度变化关系如图所示。下列说法正确的( )
A、表示的物质的量随时间的变化 B、时刻反应速率: C、此反应的平衡常数 D、平衡后充入 , 再次达到平衡时物质的物质的量大于3. 臭氧在烟气脱硝中的反应为。向的恒容密闭容器中充入和充分反应,平衡时,的体积分数随温度变化关系如图所示。下列说法正确的( )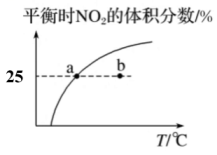 A、该反应的 B、点时,的体积分数为 C、点时, D、正反应速率的大小:点点4. 以、为原料合成涉及的反应如下:
A、该反应的 B、点时,的体积分数为 C、点时, D、正反应速率的大小:点点4. 以、为原料合成涉及的反应如下:反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
在5MPa下,按照投料,平衡时,CO和在含碳产物中物质的量分数及的转化率随温度的变化如图。下列说法正确的是( )
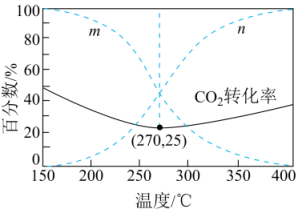 A、反应Ⅲ中反应物的总键能大于生成物的总键能 B、曲线代表CO在含碳产物中物质的量分数 C、该条件下温度越低,越有利于工业生产 D、图示270℃时,平衡体系中的体积分数约为66.6%5. 研究NOx之间的转化对大气污染控制具有重要意义,已知:N2O4(g)2NO2(g) △H>0,如图所示,在恒容密闭容器中,反应温度为T1时,c(N2O4)和c(NO2)随t变化为曲线Ⅰ、Ⅱ,改变温度到T2 , c(NO2)随t变化为曲线Ⅲ。下列判断正确的是( )
A、反应Ⅲ中反应物的总键能大于生成物的总键能 B、曲线代表CO在含碳产物中物质的量分数 C、该条件下温度越低,越有利于工业生产 D、图示270℃时,平衡体系中的体积分数约为66.6%5. 研究NOx之间的转化对大气污染控制具有重要意义,已知:N2O4(g)2NO2(g) △H>0,如图所示,在恒容密闭容器中,反应温度为T1时,c(N2O4)和c(NO2)随t变化为曲线Ⅰ、Ⅱ,改变温度到T2 , c(NO2)随t变化为曲线Ⅲ。下列判断正确的是( ) A、温度T1>T2 B、反应速率v(a)<v(b) C、K(T1)>K(T2) D、在T2温度下,反应在0-t1内的平均速率为v(N2O4)=mol/(L·s)6. 向某密闭容器中加入0.3mol A、0.1mol C和一定量B的混合气体,在一定条件下发生反应,各物质的浓度随时间变化如图甲所示(t0~t1阶段的c(B)变化未画出),图乙为t2时刻改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段各改变一种不同的反应条件。下列说法中正确的是( )
A、温度T1>T2 B、反应速率v(a)<v(b) C、K(T1)>K(T2) D、在T2温度下,反应在0-t1内的平均速率为v(N2O4)=mol/(L·s)6. 向某密闭容器中加入0.3mol A、0.1mol C和一定量B的混合气体,在一定条件下发生反应,各物质的浓度随时间变化如图甲所示(t0~t1阶段的c(B)变化未画出),图乙为t2时刻改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段各改变一种不同的反应条件。下列说法中正确的是( )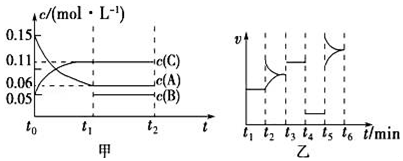 A、若t1=15 s,t0~t1阶段B的平均反应速率为0.004 mol•L﹣1•s﹣1 B、t4~t5阶段改变的条件可能是增大压强 C、该容器的容积为2 L,B的起始物质的量为0.02 mol D、t5~t6阶段,容器内A的物质的量减少了0.06 mol,容器与外界的热交换为a kJ,则该反应的热化学方程式为3A(g)⇌B(g)+2C(g)△H=﹣50a kJ•mol﹣17. 在密闭容器中进行反应:X(g)+3Y(g)═2Z(g),有关下列图像的说法错误的是( )
A、若t1=15 s,t0~t1阶段B的平均反应速率为0.004 mol•L﹣1•s﹣1 B、t4~t5阶段改变的条件可能是增大压强 C、该容器的容积为2 L,B的起始物质的量为0.02 mol D、t5~t6阶段,容器内A的物质的量减少了0.06 mol,容器与外界的热交换为a kJ,则该反应的热化学方程式为3A(g)⇌B(g)+2C(g)△H=﹣50a kJ•mol﹣17. 在密闭容器中进行反应:X(g)+3Y(g)═2Z(g),有关下列图像的说法错误的是( ) A、依据图a可判断正反应为放热反应 B、在图b中,虚线可表示使用了催化剂 C、若正反应的△H>0,图c可表示升高温度正逆化学反应速率变化图 D、由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的ΔH<08. 反应 达平衡状态后,改变某一条件,下列图像与条件变化一致的是( )A、升高温度
A、依据图a可判断正反应为放热反应 B、在图b中,虚线可表示使用了催化剂 C、若正反应的△H>0,图c可表示升高温度正逆化学反应速率变化图 D、由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的ΔH<08. 反应 达平衡状态后,改变某一条件,下列图像与条件变化一致的是( )A、升高温度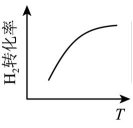 B、增大浓度
B、增大浓度 C、改变压强
C、改变压强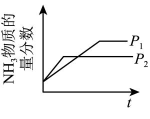 D、加入催化剂
D、加入催化剂 9. 在容积固定为1.00L的密闭容器中,通入一定量的 , 发生反应 , 100℃时体系中各物质的浓度随时间变化如图所示。下列说法正确的是( )
9. 在容积固定为1.00L的密闭容器中,通入一定量的 , 发生反应 , 100℃时体系中各物质的浓度随时间变化如图所示。下列说法正确的是( ) A、时刻反应已经达到平衡状态 B、100℃时,反应的平衡常数K为0.36 C、待容器中混合气体的密度不变时,说明反应达到平衡状态 D、100℃时,在0~60s时段反应的平均反应速率10. 催化重整制的主要反应为:
A、时刻反应已经达到平衡状态 B、100℃时,反应的平衡常数K为0.36 C、待容器中混合气体的密度不变时,说明反应达到平衡状态 D、100℃时,在0~60s时段反应的平均反应速率10. 催化重整制的主要反应为:Ⅰ:
Ⅱ:
将一定比例的、和的混合气体。以一定流速通过装有催化剂的反应管,若仅考虑上述反应,转化率、氢酸比[]与温度的关系如题图所示。下列说法正确的是( )
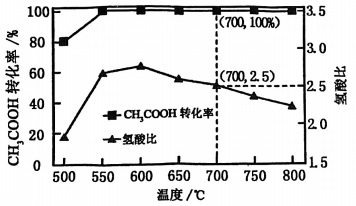 A、用该催化剂催化重整反应的最佳温度范围约为700~800℃ B、700℃时,出口气中 C、600℃后氢酸比下降的主要原因为温度升高反应Ⅰ、Ⅱ正向进行的程度减小 D、该过程深入研究的方向之一是寻找对反应Ⅱ选择性更高的催化剂11. 催化加氢制的反应体系中,发生的主要反应如下:
A、用该催化剂催化重整反应的最佳温度范围约为700~800℃ B、700℃时,出口气中 C、600℃后氢酸比下降的主要原因为温度升高反应Ⅰ、Ⅱ正向进行的程度减小 D、该过程深入研究的方向之一是寻找对反应Ⅱ选择性更高的催化剂11. 催化加氢制的反应体系中,发生的主要反应如下:反应1:
反应2:
恒压下,将起始的混合气体以一定流速通过装有催化剂的反应管,测得出口处的转化率及和的选择性[]随温度的变化如下图所示。下列说法不正确的是( )
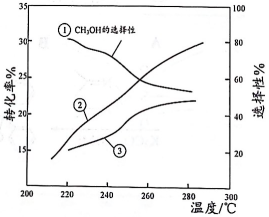 A、 B、曲线③表示CO的选择性 C、280℃时出口处的物质的量分数比220℃时小 D、为提高生产效率,需研发转化率高和选择性高的催化剂12. 在恒容密闭容器中充入和发生如下反应: , 如图所示为该反应正反应的平衡常数和逆反应的平衡常数随温度变化的曲线。下列分析正确的是( )
A、 B、曲线③表示CO的选择性 C、280℃时出口处的物质的量分数比220℃时小 D、为提高生产效率,需研发转化率高和选择性高的催化剂12. 在恒容密闭容器中充入和发生如下反应: , 如图所示为该反应正反应的平衡常数和逆反应的平衡常数随温度变化的曲线。下列分析正确的是( )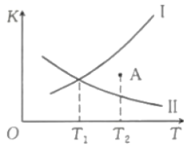 A、曲线I为 , 曲线II为 B、时,A点 C、时,的平衡转化率为40% D、其他条件不变,在原平衡基础上再充入和 , 达新平衡时转化率将减小13. 在恒容密闭容器中,由CO合成甲醇的反应为 , 在其他条件不变的情况下,测得温度对反应的影响结果如图所示。下列有关说法错误的是( )
A、曲线I为 , 曲线II为 B、时,A点 C、时,的平衡转化率为40% D、其他条件不变,在原平衡基础上再充入和 , 达新平衡时转化率将减小13. 在恒容密闭容器中,由CO合成甲醇的反应为 , 在其他条件不变的情况下,测得温度对反应的影响结果如图所示。下列有关说法错误的是( )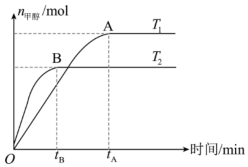 A、平衡时正反应速率: B、平衡常数: C、CO合成反应的 D、处于A点的反应体系从变到 , 达到平衡状态时减小14. 我国科学家团队打通了温和条件下草酸二甲酯催化加氢制乙二醇的技术难关,反应为.如图所示,在恒容密闭容器中,反应温度为时,和随时间的变化分别为曲线Ⅰ和Ⅱ,反应温度为时,随时间的变化为曲线Ⅲ.下列判断正确的是( )
A、平衡时正反应速率: B、平衡常数: C、CO合成反应的 D、处于A点的反应体系从变到 , 达到平衡状态时减小14. 我国科学家团队打通了温和条件下草酸二甲酯催化加氢制乙二醇的技术难关,反应为.如图所示,在恒容密闭容器中,反应温度为时,和随时间的变化分别为曲线Ⅰ和Ⅱ,反应温度为时,随时间的变化为曲线Ⅲ.下列判断正确的是( )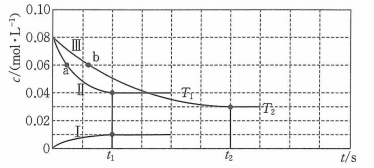 A、 B、a、b两时刻生成乙二醇的速率: C、在温度下,反应在内的平均速率为 D、其他条件相同,在温度下,起始时向该容器中充入一定量的氮气,则反应达到平衡的时间小于15. 物质X能发生如下反应:①X→mY;②X→nZ(m、n均为正整数)。恒容体系中X、Y、Z的浓度c随时间t的变化曲线如图所示,下列说法不正确的是( )
A、 B、a、b两时刻生成乙二醇的速率: C、在温度下,反应在内的平均速率为 D、其他条件相同,在温度下,起始时向该容器中充入一定量的氮气,则反应达到平衡的时间小于15. 物质X能发生如下反应:①X→mY;②X→nZ(m、n均为正整数)。恒容体系中X、Y、Z的浓度c随时间t的变化曲线如图所示,下列说法不正确的是( ) A、m=n=1 B、t1时,c(X)=c(Y) C、反应的活化能:①<② D、t2时,X的消耗速率等于Z的生成速率16. 一定温度下,向三个体积分别为、、的密闭容器中分别加入足量活性炭和2mol , 发生反应: , 在相同时间内测得各容器中的转化率与容器体积的关系如图所示.下列说法正确的是( )
A、m=n=1 B、t1时,c(X)=c(Y) C、反应的活化能:①<② D、t2时,X的消耗速率等于Z的生成速率16. 一定温度下,向三个体积分别为、、的密闭容器中分别加入足量活性炭和2mol , 发生反应: , 在相同时间内测得各容器中的转化率与容器体积的关系如图所示.下列说法正确的是( )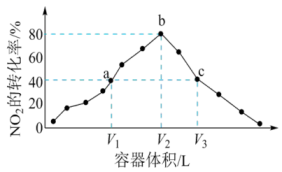 A、bc曲线上反应均达到平衡状态 B、a、c两点时气体的颜色相同 C、容器内的压强: D、向a点平衡体系中充入一定量的 , 达到平衡时,的转化率比原平衡大17. 一定条件下,将(NO)和()按物质的邀之比2∶1充入反应容器,发生反应:。其他条件相间时,分别测得NO的平衡转化率在不同压强(、)下随温度变化的曲线如右图所示。下列说法正确的是( )
A、bc曲线上反应均达到平衡状态 B、a、c两点时气体的颜色相同 C、容器内的压强: D、向a点平衡体系中充入一定量的 , 达到平衡时,的转化率比原平衡大17. 一定条件下,将(NO)和()按物质的邀之比2∶1充入反应容器,发生反应:。其他条件相间时,分别测得NO的平衡转化率在不同压强(、)下随温度变化的曲线如右图所示。下列说法正确的是( )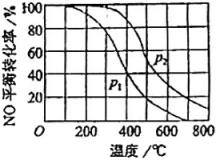 A、 B、该反应的 C、400℃、条件下,的平衡转化率为20% D、400℃时,该反应的化学平衡常数的数值为10/918. 已知反应: 。某温度下,将置于密闭容器中,一定时间后反应达到平衡。则下列说法正确的是( )。
A、 B、该反应的 C、400℃、条件下,的平衡转化率为20% D、400℃时,该反应的化学平衡常数的数值为10/918. 已知反应: 。某温度下,将置于密闭容器中,一定时间后反应达到平衡。则下列说法正确的是( )。 A、图甲中表示A的转化率,、表示温度,则可推断出: B、图乙中c表示A的浓度,则可推断出:、为平衡状态 C、图丙中(%)表示A的平衡转化率,p表示体系总压强,则推断出:M点平衡常数为 D、达平衡后,降低温度,则反应速率变化图象可以用图丁表示19. 根据下列图示所得推论正确的是( )
A、图甲中表示A的转化率,、表示温度,则可推断出: B、图乙中c表示A的浓度,则可推断出:、为平衡状态 C、图丙中(%)表示A的平衡转化率,p表示体系总压强,则推断出:M点平衡常数为 D、达平衡后,降低温度,则反应速率变化图象可以用图丁表示19. 根据下列图示所得推论正确的是( ) A、甲是新制氯水光照过程中氯离子浓度的变化曲线,推断次氯酸分解生成了HCl和O2 B、乙是C4H10(g)C4H8(g)+H2(g)的平衡转化率与温度和压强的关系曲线,推断该反应的∆H>0、x>0.1 C、丙是0.5mol/L CH3COONa溶液及水的pH随温度的变化曲线,说明随温度升高,CH3COONa溶液中c(OH-)减小 D、丁是0.03g镁条分别与2mL 2mol/L盐酸和醋酸反应过程中密闭容器内气体压强随时间的变化曲线,推断①代表盐酸与镁条的反应20. 工业上可通过甲醇(CH3OH)羰基化法制取甲酸甲酯(HCOOCH3):CH3OH(g)+CO(g)HCOOCH3(g) △H<0。在容积固定的密闭容器中,投入等物质的量的CH3OH和CO及催化剂,测得相同时间内CO的转化率随温度变化如图所示。下列说法错误的是( )
A、甲是新制氯水光照过程中氯离子浓度的变化曲线,推断次氯酸分解生成了HCl和O2 B、乙是C4H10(g)C4H8(g)+H2(g)的平衡转化率与温度和压强的关系曲线,推断该反应的∆H>0、x>0.1 C、丙是0.5mol/L CH3COONa溶液及水的pH随温度的变化曲线,说明随温度升高,CH3COONa溶液中c(OH-)减小 D、丁是0.03g镁条分别与2mL 2mol/L盐酸和醋酸反应过程中密闭容器内气体压强随时间的变化曲线,推断①代表盐酸与镁条的反应20. 工业上可通过甲醇(CH3OH)羰基化法制取甲酸甲酯(HCOOCH3):CH3OH(g)+CO(g)HCOOCH3(g) △H<0。在容积固定的密闭容器中,投入等物质的量的CH3OH和CO及催化剂,测得相同时间内CO的转化率随温度变化如图所示。下列说法错误的是( ) A、a、b、c点一定没有达到平衡,不能确定d、e点是否达到平衡 B、反应速率从快到慢依次为:e、d、c、b、a C、e点的转化率低于d点,可能原因是催化剂中毒 D、生产时反应温度控制在80~85℃为宜21. 在起始时向1.0 L恒容密闭容器中加入0.1 mol 、0.2 mol 及0.2 mol , 发生反应: , 测得平衡时气体体积分数与温度的关系如图所示(假设固体物质所占体积忽略不计)。下列说法正确的是( )
A、a、b、c点一定没有达到平衡,不能确定d、e点是否达到平衡 B、反应速率从快到慢依次为:e、d、c、b、a C、e点的转化率低于d点,可能原因是催化剂中毒 D、生产时反应温度控制在80~85℃为宜21. 在起始时向1.0 L恒容密闭容器中加入0.1 mol 、0.2 mol 及0.2 mol , 发生反应: , 测得平衡时气体体积分数与温度的关系如图所示(假设固体物质所占体积忽略不计)。下列说法正确的是( ) A、该反应的 B、曲线b代表生成物CO C、M点与N点的压强之比为15:16 D、若保持M点条件不变,再充入、CO及各0.1 mol,则达平衡前v(正)<v(逆)22. 已知在一恒容密闭容器中,加入一定量的R(g)和足量的W(s),发生反应 , 平衡状态时M(g)的物质的量浓度与温度T的关系如图所示,下列说法正确的是( )
A、该反应的 B、曲线b代表生成物CO C、M点与N点的压强之比为15:16 D、若保持M点条件不变,再充入、CO及各0.1 mol,则达平衡前v(正)<v(逆)22. 已知在一恒容密闭容器中,加入一定量的R(g)和足量的W(s),发生反应 , 平衡状态时M(g)的物质的量浓度与温度T的关系如图所示,下列说法正确的是( ) A、该反应的 B、混合气体的密度:状态a<状态b<状态c C、向c点体系中再充入一定量的R(g),W的质量不变 D、若该反应在℃、℃时的平衡压强分别为、 , 则23. T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论错误的是( )
A、该反应的 B、混合气体的密度:状态a<状态b<状态c C、向c点体系中再充入一定量的R(g),W的质量不变 D、若该反应在℃、℃时的平衡压强分别为、 , 则23. T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论错误的是( ) A、反应进行的前3min内,用X表示的反应速率v(X)=0.1mol/(L·min) B、容器中发生的反应可表示为3X(g)+Y(g)2Z(g) C、保持其他条件不变,升高温度,反应的化学平衡常数K增大 D、若改变反应条件,使反应进程如图3所示,则改变的条件可能是升高温度24. 用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)CH3OH(g)△H<0,初始投料相同时,测得CO在不同温度下的平衡转化率与压强的关系如图。下列说法正确的是( )
A、反应进行的前3min内,用X表示的反应速率v(X)=0.1mol/(L·min) B、容器中发生的反应可表示为3X(g)+Y(g)2Z(g) C、保持其他条件不变,升高温度,反应的化学平衡常数K增大 D、若改变反应条件,使反应进程如图3所示,则改变的条件可能是升高温度24. 用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)CH3OH(g)△H<0,初始投料相同时,测得CO在不同温度下的平衡转化率与压强的关系如图。下列说法正确的是( ) A、平均摩尔质量:M(a)>M(b)>M(d)>M(c) B、正反应速率:v(a)>v(c)、v(b)>v(d) C、温度:T1>T2>T3 D、平衡常数:K(a)>K(c)、K(b)>K(d)25. 知:CH4(g)+2H2S(g)⇌CS2(g)+4H2(g)。向恒容密闭容器中充入0.1molCH4和0.2molH2S,测得平衡时体系中各物质的物质的量分数与温度的关系如图所示。
A、平均摩尔质量:M(a)>M(b)>M(d)>M(c) B、正反应速率:v(a)>v(c)、v(b)>v(d) C、温度:T1>T2>T3 D、平衡常数:K(a)>K(c)、K(b)>K(d)25. 知:CH4(g)+2H2S(g)⇌CS2(g)+4H2(g)。向恒容密闭容器中充入0.1molCH4和0.2molH2S,测得平衡时体系中各物质的物质的量分数与温度的关系如图所示。
下列说法不正确的是( )
A、该反应的ΔH>0 B、X点CH4的转化率为20% C、X点与Y点容器内压强比 51∶55
D、维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1mol时v(正)<v(逆)
26. 合成氨反应:N2(g)+3H2(g)2NH3(g) ΔH<0。图1表示在2L恒容密闭容器中NH3的物质的量浓度随时间的变化曲线。图2表示在其他条件不变时,平衡时NH3的体积分数随起始时H2的物质的量的变化曲线。下列说法正确的是( )
51∶55
D、维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1mol时v(正)<v(逆)
26. 合成氨反应:N2(g)+3H2(g)2NH3(g) ΔH<0。图1表示在2L恒容密闭容器中NH3的物质的量浓度随时间的变化曲线。图2表示在其他条件不变时,平衡时NH3的体积分数随起始时H2的物质的量的变化曲线。下列说法正确的是( ) A、图1中,10min末H2的消耗速率v(H2)=0.045mol/(L·min) B、图1中,其他条件不变,第11min迅速压缩容器体积为1L,则c(NH3)-t曲线变化为a C、图2中,反应物N2的平衡转化率:b>a>c D、图2中,T1、T2表示温度,则T1>T227. 在2L恒容密闭容器中充入2 mol SO2和1 mol O2发生反应: , 其他条件相同,混合体系中SO2的体积分数(x)随温度变化的关系如图所示。下列推断正确的是( )
A、图1中,10min末H2的消耗速率v(H2)=0.045mol/(L·min) B、图1中,其他条件不变,第11min迅速压缩容器体积为1L,则c(NH3)-t曲线变化为a C、图2中,反应物N2的平衡转化率:b>a>c D、图2中,T1、T2表示温度,则T1>T227. 在2L恒容密闭容器中充入2 mol SO2和1 mol O2发生反应: , 其他条件相同,混合体系中SO2的体积分数(x)随温度变化的关系如图所示。下列推断正确的是( ) A、Q点时,SO2的转化率最大 B、W点与M点SO2的反应速率相等 C、Q点时,充入:2 mol SO2和1 mol O2 , 重新平衡后SO2的平衡转化率与原平衡相等 D、M点时,充入SO3气体,重新平衡后SO2的体积分数比原平衡大28. 温度为T℃,向体积不等的恒容密闭容器中均充入1mol气体X,发生反应: , 反应均进行10min,测得各容器中X的转化率与容器体积的关系如图所示.下列说法正确的是( )
A、Q点时,SO2的转化率最大 B、W点与M点SO2的反应速率相等 C、Q点时,充入:2 mol SO2和1 mol O2 , 重新平衡后SO2的平衡转化率与原平衡相等 D、M点时,充入SO3气体,重新平衡后SO2的体积分数比原平衡大28. 温度为T℃,向体积不等的恒容密闭容器中均充入1mol气体X,发生反应: , 反应均进行10min,测得各容器中X的转化率与容器体积的关系如图所示.下列说法正确的是( ) A、a点再充入一定量的X,X的转化率减小 B、d点有 C、正反应速率 D、若c点为平衡点,则浓度平衡常数29. 一定温度下,向三个体积分别为、、()的密闭容器中分别加入足量活性炭和 , 发生反应: , 在相同时间内测得各容器中的转化率与容器体积的关系如图所示。下列说法正确的是( )
A、a点再充入一定量的X,X的转化率减小 B、d点有 C、正反应速率 D、若c点为平衡点,则浓度平衡常数29. 一定温度下,向三个体积分别为、、()的密闭容器中分别加入足量活性炭和 , 发生反应: , 在相同时间内测得各容器中的转化率与容器体积的关系如图所示。下列说法正确的是( ) A、bc曲线上反应均达到平衡状态 B、容器内的压强: C、a、c两点时气体的颜色相同 D、该温度下,a、b、c三点时反应的平衡常数:
A、bc曲线上反应均达到平衡状态 B、容器内的压强: C、a、c两点时气体的颜色相同 D、该温度下,a、b、c三点时反应的平衡常数:二、多选题
-
30. 向体积均为1L的两个恒容密闭容器中分别充入2molX和1molY发生反应: , 其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示,下列说法正确的是( )
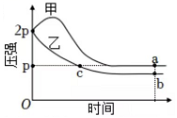 A、 B、气体总物质的量: C、a点平衡常数: D、反应速率:
A、 B、气体总物质的量: C、a点平衡常数: D、反应速率: