【备考2024年】从巩固到提高 高考化学二轮微专题21 等效平衡
试卷更新日期:2024-02-23 类型:二轮复习
一、选择题
-
1. 如表所示,在三个初始温度均为的容器中进行反应: , 下列说法正确的是( )
容器编号
容器类型
初始体积
反应物的起始投入量/
平衡时
A
B
C
甲
恒温恒容
0
0
2
1.6
乙
恒容绝热
2
1
0
a
丙
恒温恒容
6
3
0
b
A、 B、 C、下该反应的平衡常数 D、平衡时A的正反应速率:2. 恒容密闭容器中,与在不同温度下发生反应: , 达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图所示: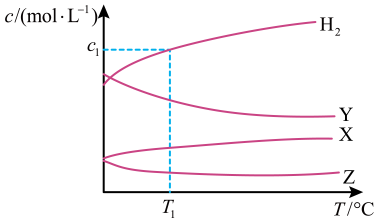
下列说法正确的是
A、该反应的平衡常数随温度升高而增大 B、曲线Y表示随温度的变化关系 C、提高投料比 , 可提高的平衡转化率 D、其他条件不变,与在℃下反应,达到平衡时3. 已知 △H<0,向同温、同体积的甲、乙、丙三个密闭容器中分别充入2mol A(g)和1mol B(g)、1mol A(g)和0.5mol B(g)、2mol C(g)。恒温,恒容下反应达平衡时,下列关系一定正确的是( )A、C的质量m: B、容器内压强p: C、c(A)与c(B)之比k: D、反应放出或吸收热量的数值Q:4. 在3种不同条件下,分别向容积为2 L的恒容密闭容器中充入2 mol A和1 mol B,发生反应2A(g) +B(g)2D(g) ΔH 实验的相关条件和数据如下表所示: 下列说法正确的是( )实验编号
实验I
实验II
实验III
反应温度/℃
800
800
850
达到平衡时间/min
40
10
30
平衡时c(D)/(mol·L-1)
0.5
0.5
0.15
反应的能量变化
Q1
Q2
Q3
A、由表中信息可知:ΔH>0 B、实验I达到平衡后,恒温条件下再向容器中通入1 mol A和1 mol D, 达到平衡时,c(D) = 1.0mol·L-1 C、实验II可能隐含的条件是使用催化剂,实验III,30 min 内:v(D) = 0.05mol ·L-1 ·min-1
D、由表中信息可知: Q1=Q2<Q35. 某温度下,反应CO2(g)+H2(g)⇌CO(g)+H2O(g)的平衡常数K=2.25,该温度下,在体积均为10L的三个密闭容器中分别加入反应物,起始加入量如表所示,下列判断错误的是( )起始量
甲
乙
丙
H2(mol)
1
2
2
CO2(mol)
1
1
2
A、反应开始时,甲中的反应速率最慢,丙中的反应速率最快 B、平衡时,甲和丙中CO2的转化率相等,均是60% C、平衡时,乙中H2的转化率大于60% D、平衡时,丙中c(H2)是0.08mol/L6. 500K时,在三个容积均为2L的恒容密闭容器中,发生反应:。实验测得 , 。其中、为速率常数,受温度影响。下列说法正确的是( )容器编号
起的时物质的量/mol
平衡时的物质的量/mol
I
0
0
1.2
0.4
II
0.4
1.0
0.6
III
0.7
1.2
0
A、到达平衡时,容器III中的体积分数小于50% B、到达平衡时,容器I与容器II中的总压强之比为4:5 C、到达平衡时,容器II中比容器I中的大 D、当温度改变为T时。若、则7. 如图所示,初始体积均为1L的两容器,甲保持恒容,乙保持恒压。起始时关闭活塞K,向甲中充入1molPCl5(g),乙中充入1molPCl3(g)和1molCl2(g)。恒温下,均发生反应:PCl5(g)PCl3(g)+Cl2(g)。达平衡时,乙的容积为0.8L。下列说法错误的是( ) A、平衡时PCl5(g)的体积分数:甲<乙 B、从乙中移走0.5molPCl3(g),0.5molCl2(g),再次平衡时乙中n(PCl5)=0.2mol C、打开K一段时间,再次平衡时乙容器的体积为0.6L D、甲中PCl5(g)的转化率小于60%8. 一定压强下,向10L密闭容器中充入 和 , 发生反应: 。 的消耗速率(v)、 的消耗速率(v)、温度(T)三者的关系如图所示,以下说法中不正确的是( )
A、平衡时PCl5(g)的体积分数:甲<乙 B、从乙中移走0.5molPCl3(g),0.5molCl2(g),再次平衡时乙中n(PCl5)=0.2mol C、打开K一段时间,再次平衡时乙容器的体积为0.6L D、甲中PCl5(g)的转化率小于60%8. 一定压强下,向10L密闭容器中充入 和 , 发生反应: 。 的消耗速率(v)、 的消耗速率(v)、温度(T)三者的关系如图所示,以下说法中不正确的是( )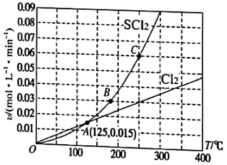 A、A,B,C三点对应状态下,达到平衡状态的是C B、温度升高,平衡常数K减小 C、若投料改为通入 和 , 的平衡转化率不变 D、125℃,平衡时 的消耗速率为0.0159. 相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:2SO3(g)2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:
A、A,B,C三点对应状态下,达到平衡状态的是C B、温度升高,平衡常数K减小 C、若投料改为通入 和 , 的平衡转化率不变 D、125℃,平衡时 的消耗速率为0.0159. 相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:2SO3(g)2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:容器编号
起始时各物质物 质 的量 /mol
平衡时反应中的能量变化
SO3
SO2
O2
①
2
0
0
吸收热量akJ
②
0
2
1
放出热 量 bkJ
③
4
0
0
吸收热量ckJ
下列叙述正确的是( )
A、达平衡时O2的体积分数:①>③ B、热量关系:a一定等于b C、①②③ 反应的平衡常数:③>①>② D、①中的密度不再改变时说明反应已达到平衡状态10. 在相同温度和压强下,对反应CO2(g)+H2(g) CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见表物质的量
CO2
H2
CO
H2O
甲
amol
amol
0mol
0mol
乙
2amol
amol
0mol
0mol
丙
0mol
0mol
2amol
2amol
丁
0mol
0mol
amol
amol
上述四种情况达到平衡后,n(CO)的大小顺序是( )
A、乙=丁>丙=甲 B、乙>丁>甲>丙 C、丁>乙>丙=甲 D、丙>乙>丁=甲11. 向甲、乙、丙三个恒容密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)⇌2C(g) △H=akJ·mol-1。相关数据如表所示,反应过程中C的浓度随时间的变化关系如图所示。下列说法正确的是( )容器
甲
乙
丙
容积
0.5L
0.5L
1.0L
温度
T1
T2
T2
反应物起始量
1.5molA0.5molB
1.5molA0.5molB
6molA2molB
 A、10min内甲容器中反应的平均速率v(A)=0.10mol·L-1·min-1 B、a>0,x=1 C、T2时,该反应的平衡常数为0.8 D、平衡时,C的体积分数:丙>乙12. 某密闭容器中充入1molN2、3molH2 , 在温度恒定时达平衡,测得NH3为0.6mol。若该容器起始时充入2molN2、6molH2 , 同温下达到平衡,对容器内NH3物质的量的说法正确的是( )A、若为恒容容器,n(NH3)<1.2mol B、若为恒压容器,n(NH3)=0.6mol C、若为恒容容器,n(NH3)=1.2mol D、若为恒压容器,n(NH3)=1.2mol13. 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始 ,在相同温度和催化剂的条件下,两容器中各自发生下列反应: ;达到平衡时, ,则下列说法错误的是( )
A、10min内甲容器中反应的平均速率v(A)=0.10mol·L-1·min-1 B、a>0,x=1 C、T2时,该反应的平衡常数为0.8 D、平衡时,C的体积分数:丙>乙12. 某密闭容器中充入1molN2、3molH2 , 在温度恒定时达平衡,测得NH3为0.6mol。若该容器起始时充入2molN2、6molH2 , 同温下达到平衡,对容器内NH3物质的量的说法正确的是( )A、若为恒容容器,n(NH3)<1.2mol B、若为恒压容器,n(NH3)=0.6mol C、若为恒容容器,n(NH3)=1.2mol D、若为恒压容器,n(NH3)=1.2mol13. 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始 ,在相同温度和催化剂的条件下,两容器中各自发生下列反应: ;达到平衡时, ,则下列说法错误的是( ) A、反应开始时,B容器中化学反应速率快 B、A容器比B容器中X的转化率大 C、打开K一段时间达平衡时,A的体积为2.4aL(连通管中气体体积不计) D、打开K达新平衡后,升高B容器温度,A容器体积会增大14. 温度为 时,向容积为2L的密闭容器甲、乙中分别充入一定量的CO(g)和 ,发生反应: .数据如下,下列说法正确的是( )
A、反应开始时,B容器中化学反应速率快 B、A容器比B容器中X的转化率大 C、打开K一段时间达平衡时,A的体积为2.4aL(连通管中气体体积不计) D、打开K达新平衡后,升高B容器温度,A容器体积会增大14. 温度为 时,向容积为2L的密闭容器甲、乙中分别充入一定量的CO(g)和 ,发生反应: .数据如下,下列说法正确的是( )容器
甲
乙
反应物
CO
CO
起始时物质的量(mol)
1.2
0.6
2.4
1.2
平衡时物质的量(mol)
0.9
0.3
a
b
A、甲容器中,平衡时,反应放出的热量为13.2kJ B、 时,反应的平衡常数 C、乙容器中,平衡时CO的转化率为35% D、平衡时,乙中CO的浓度是甲中的2倍15. 700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O(g),发生如下反应: ,反应过程中测定的部分数据见下表(表中t1<t2),下列说法错误的是( )反应时间/min
n(CO)/mol
n(H2O)/mol
0
1.20
0.60
t1
0.80
t2
0.20
A、反应在t1min内的平均速率为v(H2)= mol/(L·min) B、保持其他条件不变,若起始时向容器中充入0.60 molCO和1.20 mol H2O (g),则到达平衡时n(CO2)=0.40 mol C、保持其他条件不变,若平衡后向容器中再充入0.40 mol CO和0.40 mol CO2 , 则平衡将向正反应方向移动 D、温度升至800℃,上述反应的平衡常数为0.64,则该反应的正反应为放热反应16. 某温度下,在2L的密闭容器中,加入1mol X(g)和2mol Y(g)发生反应: X(g)+mY(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述错误的是A、m=2 B、两次平衡的平衡常数相同 C、X与Y的平衡转化率之比为1:1 D、第二次平衡时,Z的浓度为0.4mol/L17. 某温度时,发生反应2HI(g) H2(g)+I2(g)ΔH>0,向三个体积相等的恒容密闭容器A、B、C中,分别加入①2molHI;②3molHI;③1molH2与1molI2 , 分别达到平衡时,以下关系正确的是( )A、平衡时,各容器的压强:②=①=③ B、平衡时,I2的浓度:②>①>③ C、平衡时,I2的体积分数:②=①=③ D、从反应开始到达平衡的时间:①>②=③18. 已知2SO2(g)+O2(g) 2SO3(g) ΔH=-197 kJ·mol-1 . 向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)1 mol SO2和0.5 mol O2;(丙)2 mol SO3 . 恒温、恒容下反应达平衡时,下列关系一定正确的是( )A、容器内压强p:P甲=P丙>2P乙 B、SO2的质量m:m甲=m丙>2m乙 C、c(SO2)与c(O2)之比k:k甲=k丙=2k乙 D、甲乙中SO2的转化率分别为a 甲、a 乙 , 丙中SO3的转化率为a 丙:a 甲>a 乙 , a 甲+a 丙=119. 已知N2(g)+3H2(g) 2NH3(g) △H=−92.4 kJ·mol-1 , 在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是( )容器
甲
乙
丙
反应物投入量
1 mol N2、3 mol H2
2 mol N2、6 mol H2
2 mol NH3
NH3的浓度(mol·L-1)
c1
c2
c3
反应的能量变化
放出Q1kJ
放出Q2kJ
吸收Q3kJ
体系压强(Pa)
p1
p2
p3
反应物转化率
α1
α2
α3
A、Q3+92.4c1=92.4 B、α2+α3<1 C、2p1=2p3<p2 D、达到平衡时丙容器中NH3的体积分数最大20. 700℃时,向容积为 的恒容密闭容器中充入一定量的CO和 ,发生如下反应: ,反应过程中测定的部分数据见表:反应时间/min
0
0.30
0.60
20
0.10
30
0.20
下列说法正确的是( )
A、保持其他条件不变,升高温度,平衡时 ,则反应的 B、反应在 内的平均速率为 C、保持其他条件不变,再向平衡体系中同时通入 ,达到新平衡前v(正)<v(逆) D、相同温度下,若起始时向容器中充入 ,达到平衡时 转化率大于21. 一定温度下,将 2mol NO2 装入 5 L 带活塞的密闭容器中,当反应 2NO2(g)⇋ N2O4(g)ΔH=-60 kJ/mol 达到平衡时,恢复到原来的温度,测得此过程中体系向外界共释放了 40 kJ 的热量。 下列说法正确的是( )A、温度升高,平衡常数 K 增大 B、慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅 C、上述反应达到平衡时,NO2的转化率是 40% D、若起始时向容器中充入 1.0 mol N2O4 , 保持温度不变,达到平衡时共吸收 20 kJ的热量22. 已知2SO2(g) + O2(g) 2SO3(g);ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是( )A、容器内压强p:P甲=P丙> 2P乙 B、SO3的质量m:m甲=m丙> 2m乙 C、c(SO2)与c(O2)之比k:k甲=k丙> k乙 D、反应放出或吸收热量的数值Q:Q甲=Q丙> 2Q乙二、多选题
-
23. 初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生如下反应:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1 , 测得反应的相关数据如下:
容器
容器类型
初始体积
初始压强/Pa
反应物投入量/mol
平衡时Cl2的物质的量/mol
HCl
O2
Cl2
H2O
I
恒温恒容
1L
4
1
0
0
1
II
绝热恒容
1L
p2
0
0
2
2
a
III
恒温恒压
2L
p3
8
2
0
0
b
下列说法正确的是( )
A、反应4HCl(g)+O2(g) 2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1 B、a>1, b>2 C、p2=1.6×105Pa,p3=4×105Pa D、若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行24. 在3个初始温度均为T℃的密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g) (正反应放热)。下列说法正确的是( )容器编号
容器类型
初始体积
起始物质的量/mol
平衡时SO3物质的量/mol
SO2
O2
SO3
I
恒温恒容
1.0 L
2
1
0
1.6
II
绝热恒容
1.0 L
2
1
0
a
III
恒温恒压
0.5 L
0
0
1
b
A、a>1.6 B、b<0.8 C、平衡时v正(SO2):v(I)<v(II) D、若起始时向容器I中充入1.0 mol SO2(g)、0.20 mol O2(g)和4.0molSO3(g),则反应将向正反应方向进行25. 在1L密闭容器中通入2mol氨气,在一定温度下,发生下列反应:2NH3 N2+3H2 , 达到平衡时,容器内N2的百分含量为a%,若维持容器的体积和温度都不变,分别通入下列几组物质,达到平衡时,容器内N2的含量仍为a%的是( )A、3molH2和1molN2 B、2molNH3和1molN2 C、2molN2和3molH2 D、0.1molNH3 , 0.95molN2和2.85molH2三、非选择题
-
26. 请回答下列问题:(1)、Ⅰ.恒温、恒压下,在一个可变容积的容器中发生如下反应:A(g)+B(g) C(g)
若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为mol。
(2)、若开始时放入3molA和3 molB,到达平衡后,生成C的物质的量为mol。(3)、若开始时放入xmolA、2 molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3amol,则x =mol,y =mol。平衡时,B的物质的量可能大于,等于或小于2mol,作出判断的理由是。(4)、若在(3)的平衡混合物中再加入3molC,待再次达到平衡后,C的物质的量分数是(5)、Ⅱ.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。开始时放入1molA和1molB到达平衡后生成bmolC.将b与(1)小题中的a进行比较(选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是。