【备考2024年】从巩固到提高 高考化学二轮微专题19 催化剂
试卷更新日期:2024-02-23 类型:二轮复习
一、选择题
-
1. 甲酸甲酯作为潜在的储氢材料受到关注,科学家发现使用配合物催化剂可以使甲酸甲酯温和释氢,其可能的反应过程如下图所示。下列说法错误的是( )
 A、为极性分子,为非极性分子 B、每消耗生成 C、总反应为 D、反应涉及键断裂和键形成2. 科研人员利用高压气流将水微滴喷射到涂覆催化剂的石墨网上,研究常温制氨,其反应历程中微粒转化关系如图1,相对能量变化关系如图2,图中*表示催化剂表面吸附位。下列说法正确的是( )
A、为极性分子,为非极性分子 B、每消耗生成 C、总反应为 D、反应涉及键断裂和键形成2. 科研人员利用高压气流将水微滴喷射到涂覆催化剂的石墨网上,研究常温制氨,其反应历程中微粒转化关系如图1,相对能量变化关系如图2,图中*表示催化剂表面吸附位。下列说法正确的是( ) A、过程中发生非极性键的断裂与形成 B、Ⅰ转化为和的过程中会生成 C、Ⅱ表示的微粒符号是 D、反应历程中放热最多的反应是3. 与在不同催化剂作用下反应生成的反应历程图(为过渡态。*表示吸附在催化剂表面的物种)如图所示。下列说法正确的是( )
A、过程中发生非极性键的断裂与形成 B、Ⅰ转化为和的过程中会生成 C、Ⅱ表示的微粒符号是 D、反应历程中放热最多的反应是3. 与在不同催化剂作用下反应生成的反应历程图(为过渡态。*表示吸附在催化剂表面的物种)如图所示。下列说法正确的是( )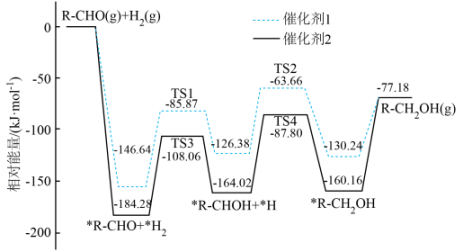 A、该反应为放热反应 B、催化剂1和催化剂2均降低了反应的焓变 C、反应过程中有非极性键的断裂和形成 D、催化剂1作用下的决速步为4. 黄铵铁矾能催化形成自由基(过程可能的机理如图所示),氧化去除废水中的偶氮染料。下列说法不正确的是( )。
A、该反应为放热反应 B、催化剂1和催化剂2均降低了反应的焓变 C、反应过程中有非极性键的断裂和形成 D、催化剂1作用下的决速步为4. 黄铵铁矾能催化形成自由基(过程可能的机理如图所示),氧化去除废水中的偶氮染料。下列说法不正确的是( )。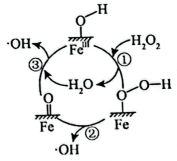 A、图中
A、图中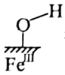 指黄铵铁矾
B、图所示过程可生成
C、反应③有极性共价键的断裂和形成
D、温度越高,偶氮染料去除率越大
5. 煤的间接液化可先转化为一氧化碳和氢气,后在催化剂作用下合成甲醇,其中一氧化碳与氢气的反应历程如下图所示,吸附在催化剂表面上的物种用*标注。下列说法正确的是( )
指黄铵铁矾
B、图所示过程可生成
C、反应③有极性共价键的断裂和形成
D、温度越高,偶氮染料去除率越大
5. 煤的间接液化可先转化为一氧化碳和氢气,后在催化剂作用下合成甲醇,其中一氧化碳与氢气的反应历程如下图所示,吸附在催化剂表面上的物种用*标注。下列说法正确的是( ) A、煤中含有苯和甲苯,可以通过分馏的方式将它们分离出来 B、该反应历程中决速步骤的活化能为1.6eV C、石油裂解和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 D、虚线框内发生的化学反应方程式可能为H3CO*+H2=CH3OH*6. 正丁烷催化裂解为乙烷和乙烯的反应历程如下(*代表催化剂):
A、煤中含有苯和甲苯,可以通过分馏的方式将它们分离出来 B、该反应历程中决速步骤的活化能为1.6eV C、石油裂解和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 D、虚线框内发生的化学反应方程式可能为H3CO*+H2=CH3OH*6. 正丁烷催化裂解为乙烷和乙烯的反应历程如下(*代表催化剂):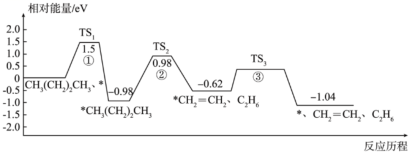
下列说法正确的是( )
A、使用催化剂能降低该反应的 B、过渡态、、中稳定性最强的是 C、正丁烷裂解生成乙烷和乙烯的反应为放热反应 D、正丁烷裂解生成乙烷和乙烯的决速步骤是反应①7. 采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇(CH3OH)方向取得重要进展,该反应历程如图所示。下列说法错误的是( )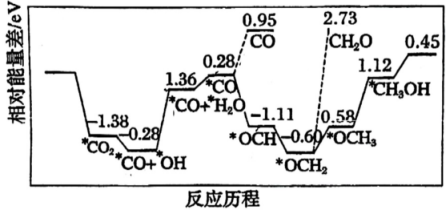 A、总反应焓变 B、上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低*CO+*OH→*CO+*H2O的能量
A、总反应焓变 B、上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低*CO+*OH→*CO+*H2O的能量变化。
C、该催化剂可有效提高反应物的平衡转化率 D、容易得到的副产物有CO和CH2O,其中相对较多的副产物为CO8. 催化剂光助―芬顿反应用于漂白有机染料的一种机理如图所示,其中包括①②光激发产生光生电子与光生空穴( , 具有很强的得电子能力)、③④空穴氧化、⑥超氧自由基氧化、⑦光生电子还原铁离子等。下列说法正确的是( ) A、、和在漂白颜料时体现了强还原性 B、催化剂可以降低反应活化能,提高单位体积内活化分子百分数 C、反应⑤每消耗1 , 共转移4 D、反应⑨有非极性键的断裂与形成9. 与在镍基催化剂催化作用下能发生如图所示的可逆反应,下列说法错误的是( )
A、、和在漂白颜料时体现了强还原性 B、催化剂可以降低反应活化能,提高单位体积内活化分子百分数 C、反应⑤每消耗1 , 共转移4 D、反应⑨有非极性键的断裂与形成9. 与在镍基催化剂催化作用下能发生如图所示的可逆反应,下列说法错误的是( ) A、总反应为 B、催化剂能降低反应的活化能,增大单位体积内活化分子数目 C、图示反应过程中有极性键的断裂与形成 D、更换更高效的催化剂,能提高的平衡转化率10. 1 mol HCOOH在Pd催化剂表面脱氢的反应历程与能量的关系如图所示,下列说法正确的( )
A、总反应为 B、催化剂能降低反应的活化能,增大单位体积内活化分子数目 C、图示反应过程中有极性键的断裂与形成 D、更换更高效的催化剂,能提高的平衡转化率10. 1 mol HCOOH在Pd催化剂表面脱氢的反应历程与能量的关系如图所示,下列说法正确的( ) A、反应历程用DCOOH代替HCOOH,得到的产物可能有HD和 B、Pd催化剂可以加快反应速率,降低反应的活化能,但不参与反应 C、历程中决速步骤的活化能为80.3 kJ/mol D、以上反应历程涉及极性键和非极性键的断裂与形成11. 采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。下列说法错误的是( )
A、反应历程用DCOOH代替HCOOH,得到的产物可能有HD和 B、Pd催化剂可以加快反应速率,降低反应的活化能,但不参与反应 C、历程中决速步骤的活化能为80.3 kJ/mol D、以上反应历程涉及极性键和非极性键的断裂与形成11. 采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。下列说法错误的是( ) A、容易得到的副产物有CO和CH2O,其中相对较多的副产物为CO B、上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低*CO+*OH→*CO+*H2O的能量变化。 C、该催化剂可有效提高反应物的平衡转化率 D、总反应焓变12. 二维锑片 (Sb)是一种新型的CO2电化学还原催化剂。酸性条件下人工固碳装置中CO2气体在Sb表面发生三种催化竞争反应,其反应历程如下图所示(*表示吸附态中间体)。下列说法不正确的是( )
A、容易得到的副产物有CO和CH2O,其中相对较多的副产物为CO B、上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低*CO+*OH→*CO+*H2O的能量变化。 C、该催化剂可有效提高反应物的平衡转化率 D、总反应焓变12. 二维锑片 (Sb)是一种新型的CO2电化学还原催化剂。酸性条件下人工固碳装置中CO2气体在Sb表面发生三种催化竞争反应,其反应历程如下图所示(*表示吸附态中间体)。下列说法不正确的是( ) A、生成HCOOH的速率最快 B、生成CO吸收的能量最多 C、Sb电极表面生成HCOOH的反应为: D、三种催化反应均为氧化还原反应13. 最近,中科院大连化物所研究发现了以Cu-ZnZr三元氧化物为催化剂时,CO2加氢制甲醇的反应机理如图所示(带*微粒为催化剂表面的吸附物种):
A、生成HCOOH的速率最快 B、生成CO吸收的能量最多 C、Sb电极表面生成HCOOH的反应为: D、三种催化反应均为氧化还原反应13. 最近,中科院大连化物所研究发现了以Cu-ZnZr三元氧化物为催化剂时,CO2加氢制甲醇的反应机理如图所示(带*微粒为催化剂表面的吸附物种):
下列判断错误的是( )
A、CO2是该反应的氧化剂 B、生成的CH3OH可用作车用燃料 C、催化剂能加快反应速率,但不改变反应的反应热 D、该反应过程中既有非极性键的断裂,又有非极性键的形成14. 甲烷单加氧酶(s-mmo)含有双核铁活性中心,是氧化生成的催化剂,反应过程如图所示。下列说法不正确的是( )
 A、每一步骤都存在铁元素和氧元素之间的电子转移 B、步骤③中有非极性键的断裂和极性键的生成 C、该催化循环过程中,s-mmo的双核铁活性中心先被氧化后被还原 D、图中的总过程可表示为:15. 近日,哈尔滨工业大学的研究团队发现,以非晶态(Ⅲ)基硫化物为催化剂,能有效催化OER(析氧反应)和UOR(尿素氧化反应),从而降低电解水制氢过程中的能耗,其工作原理和反应机理如图所示:
A、每一步骤都存在铁元素和氧元素之间的电子转移 B、步骤③中有非极性键的断裂和极性键的生成 C、该催化循环过程中,s-mmo的双核铁活性中心先被氧化后被还原 D、图中的总过程可表示为:15. 近日,哈尔滨工业大学的研究团队发现,以非晶态(Ⅲ)基硫化物为催化剂,能有效催化OER(析氧反应)和UOR(尿素氧化反应),从而降低电解水制氢过程中的能耗,其工作原理和反应机理如图所示:
下列说法正确的是( )
A、电解过程中,电极附近溶液的不变 B、非晶态(Ⅲ)基硫化物能改变OER反应的反应热 C、OER分四步进行,其中没有非极性键的形成与断裂 D、UOR的电化学反应总过程为16. 1,2-丙二醇脱氧脱水反应的催化循环机理如图所示。下列说法正确的是( ) A、过程①②均有O-H键断裂,过程③④均有C-C键断裂 B、过程①只发生了加成反应 C、该过程中催化剂通过增大反应的活化能来提高化学反应速率 D、该过程的化学方程式为
A、过程①②均有O-H键断裂,过程③④均有C-C键断裂 B、过程①只发生了加成反应 C、该过程中催化剂通过增大反应的活化能来提高化学反应速率 D、该过程的化学方程式为 17. 我国科学家合成了Y、Sc( , )单原子催化剂,用于电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。下列说法中错误的是( )
17. 我国科学家合成了Y、Sc( , )单原子催化剂,用于电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。下列说法中错误的是( ) A、其它条件相同下,使用催化剂更有利于提高产量 B、两种催化剂,反应的快慢都是由生成*NNH的速率决定 C、实际生产中将催化剂处理成纳米级颗粒可提高氨气的平衡转化率 D、工业合成氨与电化学催化还原氮气均涉及到共价键的断裂与形成18. 2021年中国科学院和中国工程院评选出2020年世界十大科技进展,排在第四位的是一种可借助光将二氧化碳转化为甲烷的新型催化转化方法: , 这是迄今最接近人造光合作用的方法,加氢制的一种催化机理如图。下列说法正确的是( )
A、其它条件相同下,使用催化剂更有利于提高产量 B、两种催化剂,反应的快慢都是由生成*NNH的速率决定 C、实际生产中将催化剂处理成纳米级颗粒可提高氨气的平衡转化率 D、工业合成氨与电化学催化还原氮气均涉及到共价键的断裂与形成18. 2021年中国科学院和中国工程院评选出2020年世界十大科技进展,排在第四位的是一种可借助光将二氧化碳转化为甲烷的新型催化转化方法: , 这是迄今最接近人造光合作用的方法,加氢制的一种催化机理如图。下列说法正确的是( ) A、反应中是中间产物 B、转化为利用了的氧化性 C、经过活性中心裂解产生带负电荷的H D、使用催化剂可以降低反应的焓变,从而提高化学反应速率19. 有学者提出,在铜基催化剂作用下,合成甲醇的转化过程如图所示。下列说法证确的是( )
A、反应中是中间产物 B、转化为利用了的氧化性 C、经过活性中心裂解产生带负电荷的H D、使用催化剂可以降低反应的焓变,从而提高化学反应速率19. 有学者提出,在铜基催化剂作用下,合成甲醇的转化过程如图所示。下列说法证确的是( )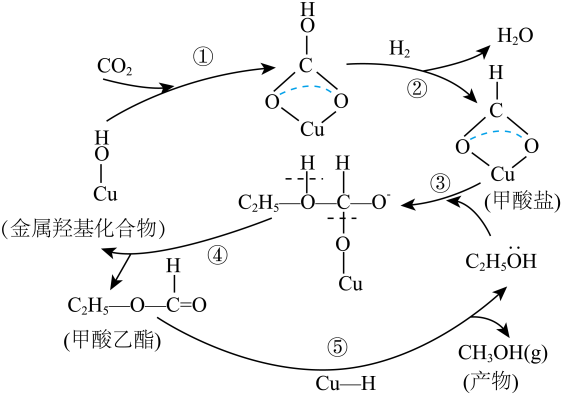 A、转化过程中碳原子有3种杂化方式 B、和均是由极性键构成的极性分子 C、能与溶液反应的甲酸乙酯的同分异构体分有1种 D、该过程的总反应方程式为20. 据文献报道:催化某反应的一种反应机理如下图所示。下列叙述正确的是( )
A、转化过程中碳原子有3种杂化方式 B、和均是由极性键构成的极性分子 C、能与溶液反应的甲酸乙酯的同分异构体分有1种 D、该过程的总反应方程式为20. 据文献报道:催化某反应的一种反应机理如下图所示。下列叙述正确的是( ) A、该反应有助于去除温室气体 B、该催化循环中Fe的成键数目未发生变化 C、的使用降低了总反应的焓变 D、参与了该催化循环21. 我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,下图为该历程示意图,下列说法不正确的是( )
A、该反应有助于去除温室气体 B、该催化循环中Fe的成键数目未发生变化 C、的使用降低了总反应的焓变 D、参与了该催化循环21. 我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,下图为该历程示意图,下列说法不正确的是( ) A、①→②放出能量并形成了C-C键 B、催化剂可提高反应物的平衡转化率 C、生成CH3COOH总反应的原子利用率为100% D、CH4→CH3COOH过程中,有C-H键发生断裂22. NH3选择性催化还原NO的反应为 , 其反应历程如图所示,一定温度下,向恒容密闭容器中充入一定量的NH3、NO、O2 , 下列说法不正确的是( )
A、①→②放出能量并形成了C-C键 B、催化剂可提高反应物的平衡转化率 C、生成CH3COOH总反应的原子利用率为100% D、CH4→CH3COOH过程中,有C-H键发生断裂22. NH3选择性催化还原NO的反应为 , 其反应历程如图所示,一定温度下,向恒容密闭容器中充入一定量的NH3、NO、O2 , 下列说法不正确的是( )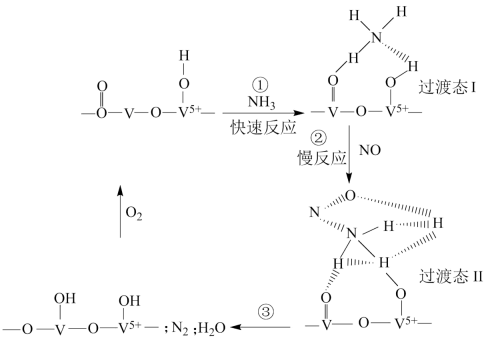 A、NO的转化率可能随NH3浓度的增大而增大 B、NH3与催化剂发生强的化学吸附,而NO在此过程中几乎不被催化剂吸附 C、反应①的活化能小,反应速率快,是控速步骤 D、过渡态Ⅱ化合物中,NH3提供的H原子中的2个与NO中的O结合生成H2O23. 甲烷单加氧酶(s-mmo)含有双核铁活性中心,是O2氧化CH4生成CH3OH的催化剂,反应过程如图所示。下列叙述错误的是( )
A、NO的转化率可能随NH3浓度的增大而增大 B、NH3与催化剂发生强的化学吸附,而NO在此过程中几乎不被催化剂吸附 C、反应①的活化能小,反应速率快,是控速步骤 D、过渡态Ⅱ化合物中,NH3提供的H原子中的2个与NO中的O结合生成H2O23. 甲烷单加氧酶(s-mmo)含有双核铁活性中心,是O2氧化CH4生成CH3OH的催化剂,反应过程如图所示。下列叙述错误的是( ) A、基态Fe(Ⅱ)的核外电子排布式为[Ar]3d6 B、步骤③有非极性键的断裂和极性键的形成 C、图中的总过程可表示为:CH4+O2+2H++2e-CH3OH+H2O D、每一步骤都存在铁和氧元素之间的电子转移24. 利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2 , 生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )
A、基态Fe(Ⅱ)的核外电子排布式为[Ar]3d6 B、步骤③有非极性键的断裂和极性键的形成 C、图中的总过程可表示为:CH4+O2+2H++2e-CH3OH+H2O D、每一步骤都存在铁和氧元素之间的电子转移24. 利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2 , 生成两种无毒物质,其反应历程如图所示,下列说法正确的是( ) A、反应过程中NO2、NH之间的反应是氧化还原反应 B、汽车尾气中含有的氮氧化合物是由汽油燃烧产生的 C、NH中含有非极性共价键 D、上述历程的总反应为2NH3+NO+NO22N2+3H2O25. 三效催化剂能有效实现汽车尾气中三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。下列说法正确的是( )
A、反应过程中NO2、NH之间的反应是氧化还原反应 B、汽车尾气中含有的氮氧化合物是由汽油燃烧产生的 C、NH中含有非极性共价键 D、上述历程的总反应为2NH3+NO+NO22N2+3H2O25. 三效催化剂能有效实现汽车尾气中三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。下列说法正确的是( ) A、在转化过程中,氮元素均被还原 B、依据图示判断催化剂不参与储存和还原过程 C、还原过程中每生成1分子 , 转移5个电子 D、X的化学式为26. 有科研人员认为 CeO2催化合成 DMC 需经历三步反应(如图)。下列说法正确的是( )
A、在转化过程中,氮元素均被还原 B、依据图示判断催化剂不参与储存和还原过程 C、还原过程中每生成1分子 , 转移5个电子 D、X的化学式为26. 有科研人员认为 CeO2催化合成 DMC 需经历三步反应(如图)。下列说法正确的是( ) A、DMC 是乙酸乙酯的同系物 B、CH3OH 和 CO2生成 DMC 的原子利用率为 100% C、CO2中 O-C-O 键的键角没被催化剂 CeO2改变 D、1mol DMC 在碱性条件下完全水解消耗 NaOH 的物质的量为 2mol27. 我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下:
A、DMC 是乙酸乙酯的同系物 B、CH3OH 和 CO2生成 DMC 的原子利用率为 100% C、CO2中 O-C-O 键的键角没被催化剂 CeO2改变 D、1mol DMC 在碱性条件下完全水解消耗 NaOH 的物质的量为 2mol27. 我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下:
下列说法正确的是( )
A、反应①的产物中含有水 B、反应②属于加成反应 C、汽油主要是C5和C11的烃类混合物 D、图中a的名称是2-甲基戊烷28. Fokin等人提出铜催化叠氮与炔烃环反应的机理如图,下列有关说法错误的是( ) A、铜降低反应的活化能,提高反应物的平衡转化率 B、
A、铜降低反应的活化能,提高反应物的平衡转化率 B、 分子中至少有四个原子在一条直线上
C、产物
分子中至少有四个原子在一条直线上
C、产物 中五元环(五元环为平面结构)上的原子均采用sp2杂化
D、此过程的总反应为加成反应
中五元环(五元环为平面结构)上的原子均采用sp2杂化
D、此过程的总反应为加成反应
二、非选择题
-
29. CO2与氢气在固载金属催化剂上可发生以下反应:
反应i. CO2(g)+H2(g) HCOOH(g) ΔH1
反应ii. CO2(g)+H2(g) H2O(g)+CO(g) ΔH2>0
反应iii.……
可能的反应机理如下(M为催化剂);
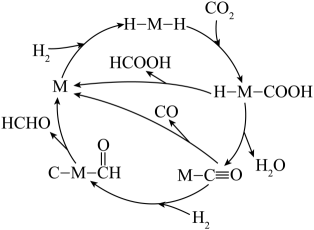
回答下列问题:
(1)、反应iii的化学方程式为。(2)、已知下列几种物质的标准摩尔生成焓(在101kPa时,由最稳定单质合成1mol指定产物时所放出的热量):物质
CO2(g)
H2(g)
HCOOH(g)
标准摩尔生成焓/kJ·mol-1
-393.51
0
-362.3
依据以上信息,ΔH1=。
(3)、在一定压强下,按n(H2):n(CO2)=1:1 投料,发生反应i和反应ii (忽略反应iii), 反应相同时间,CO2的转化率及HCOOH选择性(甲酸选择性=随温度变化曲线如下图所示。
①下列措施能提高CO2平衡转化率的是 ( 填标号)。
A.降低温度 B.再充入Ar C.分离出HCOOH
②673.15K,反应后体系中H2的分压为a MPa,则反应i的压力商计算式Qp= MPa-1。
③当温度高于673.15K,随温度升高,反应i与反应ii的反应速率相比,增加更显著的是反应 (填“ i”或“ii”),判断的理由是。
(4)、若在Bi或Bi/CeO2催化剂表面还原CO2生成HCOOH, 模拟经历两种中间体的能量变化如图所示。HCOOH的合成更倾向于通过生成中间体,且 (填 “Bi”或“Bi/CeO2”)的催化活性更优异。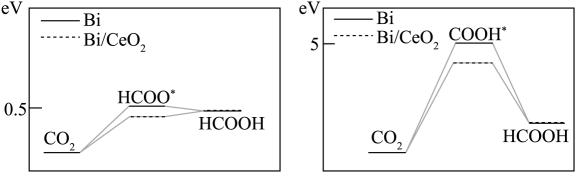 30. 2022年诺贝尔化学奖授予了对点击化学和生物正交化学做出贡献的科学家。点击化学的代表反应为铜([Cu])催化的叠氮−炔基Husigen成环反应,其原理如下图。
30. 2022年诺贝尔化学奖授予了对点击化学和生物正交化学做出贡献的科学家。点击化学的代表反应为铜([Cu])催化的叠氮−炔基Husigen成环反应,其原理如下图。
下列说法不正确的是
A、上述循环中H+ 是中间产物之一 B、上述循环过程中只有极性键的断裂和形成 C、Cu能降低反应的活化能,但不改变总反应的焓变 D、中间产物 中N采取sp2、杂化
中N采取sp2、杂化