【备考2024年】从巩固到提高 高考化学二轮微专题18 工业合成氨
试卷更新日期:2024-02-23 类型:二轮复习
一、选择题
-
1. 下图为工业合成氨的流程图。图中为提高原料转化率而采取的措施是( )
 A、①②③ B、①③⑤ C、②④⑤ D、②③④2. 关于合成氨反应 , 下列说法不正确的是( )A、使用高效催化剂能减小反应活化能 B、为了提高原料利用率,和循环使用 C、工业合成氨温度为700K是因为升高温度有利于提高的平衡转化率 D、恒温恒容下,若体系的总压强不再改变,说明该反应已达平衡状态3. 工业合成氨的反应为: kJ·mol , 用○、●分别表示H原子、N原子,
A、①②③ B、①③⑤ C、②④⑤ D、②③④2. 关于合成氨反应 , 下列说法不正确的是( )A、使用高效催化剂能减小反应活化能 B、为了提高原料利用率,和循环使用 C、工业合成氨温度为700K是因为升高温度有利于提高的平衡转化率 D、恒温恒容下,若体系的总压强不再改变,说明该反应已达平衡状态3. 工业合成氨的反应为: kJ·mol , 用○、●分别表示H原子、N原子, 表示催化剂,反应微观历程如下图所示,下列说法中错误的是( )
表示催化剂,反应微观历程如下图所示,下列说法中错误的是( )
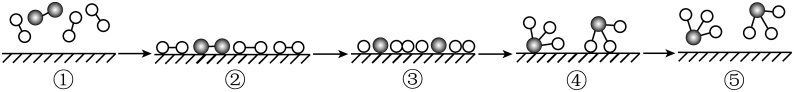 A、过程②→③吸收能量,过程③→④放出能量 B、使用新型催化剂可使与在较低温度和压强下合成 C、合成氨反应达平衡时,反应速率关系: D、合成氨工业中采用循环操作的主要目的是提高与的利用率4. 下列有关工业合成氮反应: 的说法不正确的是( )A、合成氨采取循环操作目的是提高氮气和氢气的利用率 B、除原料气中CO反应: , 适宜低温高压环境 C、合成塔压强调控在10MPa~30MPa之间,是对生产设备条件和经济成本的综合考虑结果 D、合成塔使用热交换控制体系温度400~500℃左右,主要目的是有利于平衡正向移动5. 对于工业合成氨反应 , 以下分析错误的是( )A、可以通过改变温度、压强控制合成氨的反应限度 B、高压比常压条件更有利于合成氨的反应,提高氨气的产率 C、500℃左右比室温更有利于合成氨的反应,提高氨气的产率 D、合成氨工业采用高压,不仅能提高转化率,还能缩短到达平衡的时间6. 工业合成氨是人类科学技术的一项重大突破。下的合成氨反应:
A、过程②→③吸收能量,过程③→④放出能量 B、使用新型催化剂可使与在较低温度和压强下合成 C、合成氨反应达平衡时,反应速率关系: D、合成氨工业中采用循环操作的主要目的是提高与的利用率4. 下列有关工业合成氮反应: 的说法不正确的是( )A、合成氨采取循环操作目的是提高氮气和氢气的利用率 B、除原料气中CO反应: , 适宜低温高压环境 C、合成塔压强调控在10MPa~30MPa之间,是对生产设备条件和经济成本的综合考虑结果 D、合成塔使用热交换控制体系温度400~500℃左右,主要目的是有利于平衡正向移动5. 对于工业合成氨反应 , 以下分析错误的是( )A、可以通过改变温度、压强控制合成氨的反应限度 B、高压比常压条件更有利于合成氨的反应,提高氨气的产率 C、500℃左右比室温更有利于合成氨的反应,提高氨气的产率 D、合成氨工业采用高压,不仅能提高转化率,还能缩短到达平衡的时间6. 工业合成氨是人类科学技术的一项重大突破。下的合成氨反应:下列关于工业合成氨条件选择的说法,正确的是( )
A、下该反应的 , 必须降低温度以保证合成氨顺利进行 B、增压有利于合成氨平衡正向移动,因此实际工业中反应压强越大越好 C、通过液化分离的方式不断移除产品 , 有利于增大反应平衡常数,促进反应正向进行 D、原料气进入合成塔之前,须经过干燥净化,以防止催化剂中毒7. 有关合成氨反应的说法,正确的是( )A、根据计算,常温下合成氨反应的ΔH-TΔS<0,所以常温下的反应速率很快 B、升高温度,既可以加快合成氨的速率,又可以提高平衡转化率 C、工业合成氨的反应是熵增加的放热反应,在任何温度下都可自发进行 D、工业合成氨的反应是熵减小的放热反应,在常温时可自发进行8. 下图所示为工业合成氨的流程图。下列有关生产条件的调控作用分析错误的是( ) A、步骤①中“净化”可以防止催化剂中毒 B、步骤②“加压”可以加快反应速率,但压强过高,氨的产率会降低 C、步骤③一般选择控制反应温度为400~500℃,因为在该温度下催化剂的活性最大 D、步骤④⑤有利于提高原料的利用率,能节约生产成本9. 合成氨及其相关工业中,部分物质间的转化关系如下:
A、步骤①中“净化”可以防止催化剂中毒 B、步骤②“加压”可以加快反应速率,但压强过高,氨的产率会降低 C、步骤③一般选择控制反应温度为400~500℃,因为在该温度下催化剂的活性最大 D、步骤④⑤有利于提高原料的利用率,能节约生产成本9. 合成氨及其相关工业中,部分物质间的转化关系如下:
下列说法不正确的是( )
A、甲、乙、丙三种物质中都含有氮元素 B、反应II、III和Ⅳ的氧化剂相同 C、VI的产物可在上述流程中被再次利用 D、V中发生反应:NH3 + CO2 + H2O + NaCl = NaHCO3↓+ NH4Cl10. 有关工业合成氨的说法错误的是( )A、不断移去液氨,有利于反应正向进行 B、400~500℃时,原料的平衡转化率最大 C、增大压强,氨的分解速率增加 D、原料气须经过净化处理,以防止催化剂中毒11. 合成氨反应是一种有效的工业固氮方法,解决了数亿人口生存问题。诺贝尔奖获得者埃特尔提出了合成氨反应吸附解离的机理,通过实验测得合成氨过程中能量(E)变化如图所示,其中吸附在催化剂表面的物种用“ad”表示。下列说法正确的是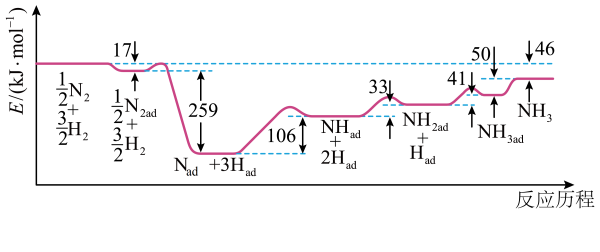 A、该反应中,反应物总能量比反应产物的总能量高 B、该反应历程中的决速步骤为 C、使用催化剂后,合成氨反应的和活化能均改变 D、工业上通常让合成氨反应在高温高压条件下进行来提高的平衡产率12. 合成氨及其衍生工业是化工生产的重要门类,请结合图示判断下列说法正确的是
A、该反应中,反应物总能量比反应产物的总能量高 B、该反应历程中的决速步骤为 C、使用催化剂后,合成氨反应的和活化能均改变 D、工业上通常让合成氨反应在高温高压条件下进行来提高的平衡产率12. 合成氨及其衍生工业是化工生产的重要门类,请结合图示判断下列说法正确的是 A、可用排空气法收集气体1 B、用湿润的淀粉试纸可以鉴别气体2和溴蒸气 C、在饱和NaCl溶液中先通入过量 , 再通入过量可得到固体1 D、相同条件下,1L气体1、2的混合气(体积比为)与在一定条件下转化为对环境无害的物质,反应方程式为13. 工业上通常采用铁触媒、在和的条件下合成氨。合成氨的反应为。下列说法正确的是A、的 B、采用的高温是有利于提高平衡转化率 C、采用的高压能增大反应的平衡常数 D、使用铁触媒可以降低反应的活化能14. 工业上,合成氨反应N2 + 3H2
A、可用排空气法收集气体1 B、用湿润的淀粉试纸可以鉴别气体2和溴蒸气 C、在饱和NaCl溶液中先通入过量 , 再通入过量可得到固体1 D、相同条件下,1L气体1、2的混合气(体积比为)与在一定条件下转化为对环境无害的物质,反应方程式为13. 工业上通常采用铁触媒、在和的条件下合成氨。合成氨的反应为。下列说法正确的是A、的 B、采用的高温是有利于提高平衡转化率 C、采用的高压能增大反应的平衡常数 D、使用铁触媒可以降低反应的活化能14. 工业上,合成氨反应N2 + 3H2 2NH3的微观历程如图所示。用
2NH3的微观历程如图所示。用 、
、 、
、 分别表示N2、H2、NH3 , 下列说法错误的是
分别表示N2、H2、NH3 , 下列说法错误的是 A、①→② 催化剂在吸附N2、H2时,未形成新的化学键 B、②→③ 形成N原子和H原子是放热过程 C、③→④形成了新的化学键 D、使用合适的催化剂,能提高合成氨反应的速率15. 如图所示为工业合成氨的流程图。下列说法错误的是( )
A、①→② 催化剂在吸附N2、H2时,未形成新的化学键 B、②→③ 形成N原子和H原子是放热过程 C、③→④形成了新的化学键 D、使用合适的催化剂,能提高合成氨反应的速率15. 如图所示为工业合成氨的流程图。下列说法错误的是( ) A、步骤①中“净化”可以防止催化剂中毒 B、步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率 C、步骤③、④、⑤均有利于提高原料平衡的转化率 D、为保持足够高的原料转化率,应在反应达到一定时间时将氨从混合气中分离出去16. 氨对发展农业有着重要意义,也是重要的化工原料。合成氨的生产流程示意如下。
A、步骤①中“净化”可以防止催化剂中毒 B、步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率 C、步骤③、④、⑤均有利于提高原料平衡的转化率 D、为保持足够高的原料转化率,应在反应达到一定时间时将氨从混合气中分离出去16. 氨对发展农业有着重要意义,也是重要的化工原料。合成氨的生产流程示意如下。
下列说法错误的是( )
A、控制原料气=2.7~2.9,是因为N2相对易得,适度过量利于提高H2转化率 B、合成氨一般选择400~500℃进行,主要是让铁触媒的活性最大,平衡转化率高 C、热交换的目的是预热原料气,同时对合成的氨气进行降温利于液化分离 D、中国科学家研制的新型锰系催化剂将合成氨的温度、压强分别降到了350℃、1MPa,显著降低合成氨的能耗二、非选择题
-
17. 有人设计了如图装置模拟工业合成氨(图中夹持装置均已略去)。

[实验操作]
①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生。在F出口处收集氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)、检验氢气纯度的目的是。(2)、C瓶内水位下降到液面保持不变时,A装置内发生的现象是 , 防止了实验装置中压强过大。C瓶内气体的成分是。(3)、在步骤③中,先加热铁催化剂的原因是。18.(1)、哈伯发明用氮气和氢气合成氨的方法,获得了1918年诺贝尔化学奖。其原理为 , (填“>”“<”或“=”)0。下列关于工业合成氨的说法不正确的是(填标号)。
A.因为 , 所以该反应一定能自发进行
B.采用高压是为了增大反应速率,但会使反应物的转化率降低
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂增大反应速率是因为催化剂降低了反应的活化能
(2)、在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是(填标号)。a.容器内、、的浓度之比为1∶3∶2
b.
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)、工业上合成氨的部分工艺流程如图:
请用平衡移动原理解释在工艺流程中及时分离出氨气和将分离后的原料气循环使用的原因。
(4)、某科研小组研究在其他条件不变的情况下,改变起始时氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示的物质的量)。①图中和的关系:(填“>”“<”或“=”)。
②a、b、c、d四点所处的平衡状态中,的转化率最高的是(填字母)。
 (5)、恒温下,向一个4L的密闭容器中充入5.2mol和2mol , 反应过程中对的浓度进行测定,得到的数据如表所示:
(5)、恒温下,向一个4L的密闭容器中充入5.2mol和2mol , 反应过程中对的浓度进行测定,得到的数据如表所示:时间/min
5
10
15
20
25
30
0.08
0.14
0.18
0.20
0.20
0.20
①此条件下该反应的化学平衡常数。
②若维持容器容积不变,温度不变,向原平衡体系中加入、和各4mol,化学平衡将向(填“正”或“逆”)反应方向移动。
(6)、已知:写出氨气催化氧化生成NO和水蒸气的热化学方程式。
19. 合成氨工业对国民经济和社会发展具有重要的意义,其原理为: , 在不同温度、压强和相同催化剂条件下,初始、分别为1mol、3mol时,平衡后混合物中氨的体积分数()如图所示,回答以下问题: (1)、合成氨反应的0(填“>”“<”或“=”),原因是。(2)、、和由大到小的顺序是。(3)、①若分别用和表示平衡状态A、B时的化学反应速率,则(填“>”“<”或“=”)。(4)、用
(1)、合成氨反应的0(填“>”“<”或“=”),原因是。(2)、、和由大到小的顺序是。(3)、①若分别用和表示平衡状态A、B时的化学反应速率,则(填“>”“<”或“=”)。(4)、用 、
、 、
、 、
、 分别表示、、和固体Fe催化剂,则在固体催化剂表面合成氨的过程如图2所示:
分别表示、、和固体Fe催化剂,则在固体催化剂表面合成氨的过程如图2所示:

①吸附后,能量状态最高的是(填序号)。
②结合上述原理,在固体Fe催化剂表面进行的分解实验,发现的分解速率与其浓度的关系如图3所示。从吸附和解吸过程分析,之后反应速率降低的原因可能是。
③研究表明,合成氨的速率与相关物质的浓度的关系为 , k为速率常数。能使合成氨的速率增大的措施有(填序号)。
A.使用更有效的催化剂
B.一定温度下,将原容器中的及时分离出来
C.总压强一定,增大的值
D.按照原来比值增大反应物的浓度
20. 工业合成氨是人类科学技术的一项重大突破。其合成原理为:N2(g)+3H2(g)2NH3(g)△H<0,△S<0。(1)、下列关于工业合成氨的说法正确的是 。A、因为△H<0,所以该反应一定能自发进行 B、因为△S<0,所以该反应一定不能自发进行 C、在高温下进行是为了提高反应物的转化率 D、该反应在低温下能自发进行(2)、在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是 。A、容器内N2、H2、NH3的浓度之比为1:3:2 B、N2百分含量保持不变 C、容器内压强保持不变 D、混合气体的密度保持不变(3)、某科研小组研究:在其他条件不变的情况下,不同温度时,固定氮气的投入量,起始氢气的物质的量与平衡时氨气的百分含量关系如右图:
①图像中T2和T1的关系是:T1T2(填“>,<或=”)。
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是:。
③ 合成氨工业中,为提高氨气的平衡产率,除适当控制反应的温度和压强外,还可采取的措施是 。
(4)、恒温下,向一个4L的恒容密闭容器中充入1.8mol N2和4.2mol H2 , 反应过程中对NH3的浓度进行检测:①20min后,反应达平衡,氨气的浓度为0.3 mol·L -1 , 用N2表示的平均反应速率为mol/(L·min)。且此时,混合气体的总压强为p,则该反应的化学平衡常数Kp= [对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数]。
②若维持容器体积不变,温度不变,向原平衡体系中再加入1.8mol N2和4.2mol H2 , 再次达平衡后,氨气的浓度0.6 mol·L -1(填“大于”或“小于”或“等于”)。
21. 合成NH3是重要的研究课题,一种合成NH3的流程示意如图。
相关数据如表:
物质
熔点/℃
沸点/℃
与N2反应温度/℃
分解温度/℃
Mg
649
1090
>300
Mg3N2:>800
已知:Mg3N2溶于水发生反应Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
(1)、I.固氮:从结构上解释N2化学性质稳定的原因。上述固氮反应的化学方程式是。固氮的适宜温度范围是。(填编号)
a.500~600℃ b.700~800℃ c.900~1000℃
(2)、检测固氮作用:向固氮后的产物中加水,(填操作和现象),说明Mg能起到固氮作用。(3)、II.转氨:选用试剂a完成转化。选用H2O进行转化,发现从体系中分离出NH3较困难,若选用HCl气体进行转化,发现能产生NH3 , 且产物MgCl2能直接循环利用,但NH3的收率较低,原因是。
活性炭还原NO2的原理为2NO2(g)+2C(s)N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2N2O4)。实验测得NO2的转化率与时间的关系如图所示:
 (4)、反应达到平衡时CO2的体积分数为 , 混合气体的平均摩尔质量(A)(B)(填“大于”“小于”或“等于”)。(5)、下列能够判断该反应已达到平衡状态的是。(填序号)
(4)、反应达到平衡时CO2的体积分数为 , 混合气体的平均摩尔质量(A)(B)(填“大于”“小于”或“等于”)。(5)、下列能够判断该反应已达到平衡状态的是。(填序号)a.CO2的质量分数保持不变
b.容器中N2与CO2的百分含量之比保持不变
c.2v(逆)(NO2)=V(正)(N2)
d.混合气体的颜色保持不变
22. 工业合成氨原理:N2(g)+3H2(g)2NH3(g) ∆H<0。(1)、下列关于合成氨的说法正确的是____。A、合成氨是目前自然固氮最重要的途径 B、合成氨反应的∆H与温度有关,而∆S与温度无关 C、合成氨反应常采用400~500℃是综合考虑了反应速率与平衡产率的矛盾 D、将原料气加压至10MPa~30MPa,是为了保证尽可能高的平衡转化率和快的反应速率 E、合成氨生产过程中将NH3液化分离,是为了加快正反应速率,提高N2、H2的转化率(2)、已知某温度下合成氨反应达平衡时各物质均为 , 容器容积为VL,保持温度和压强不变,又充入3amol N2后,平衡(填“向左”、“向右”或“不”)移动。(3)、压强下,向密闭容器中充入一定量的N2和H2 , 相同时间内测得体系中N2的体积分数与温度(T)的关系如下图所示。
①N2的体积分数随温度升高先减小后增大的原因是。
②研究表明,温度越高,温度对平衡的影响大于压强对平衡的影响。保持其他条件不变,请在上图中画出P2压强下 (P2>P1)N2的体积分数与温度(T)的关系趋势图。
(4)、LiH-3d过渡金属复合催化剂可用于催化合成氨,已知N2被吸附发生反应3LiH+N2=Li2NH+LiNH2 , 用一个化学方程式表示H2被吸附发生的反应。23. 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为:。回答下列问题:(1)、合成氨反应在常温下(填“能”或“不能”)自发。(2)、温(填“高”或“低”,下同)有利于提高反应速率,温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用。针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
(3)、方案一:双温-双控-双催化剂。使用双催化剂,通过光辐射产生温差(如体系温度为时,的温度为 , 而的温度为)。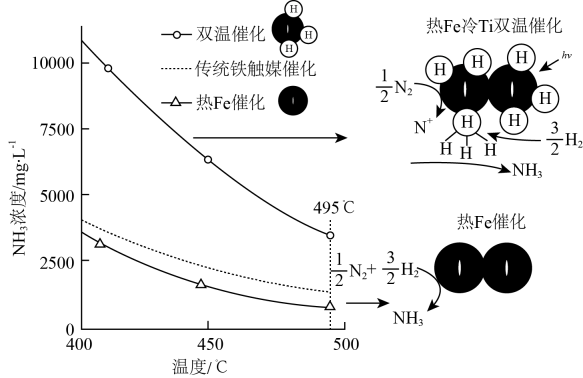
下列说法正确的是。
a.氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b.在“热Fe”表面断裂,有利于提高合成氨反应速率
c.“热Fe”高于体系温度,有利于提高氨的平衡产率
d.“冷Ti”低于体系温度,有利于提高合成氨反应速率
(4)、方案二:复合催化剂。
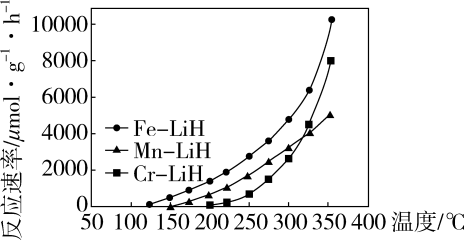
下列说法正确的是。
a.时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(5)、某合成氨速率方程为: , 根据表中数据,;实验
1
m
n
p
q
2
2m
n
p
2q
3
m
n
0.1p
10q
4
m
2n
p
2.828q
在合成氨过程中,需要不断分离出氨的原因为。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
(6)、某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为 , 则M元素为(填元素符号);在该化合物中,M离子的价电子排布式为。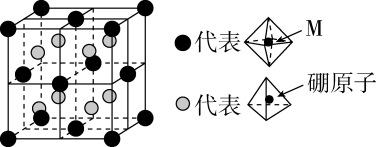 24. 工业合成氨是人类科学技术的一项重大突破。其反应为:。(1)、合成氨生产流程示意图如下。
24. 工业合成氨是人类科学技术的一项重大突破。其反应为:。(1)、合成氨生产流程示意图如下。
①流程中,有利于提高原料利用率的措施是;有利于提高单位时间内氨的产率的措施有。
②干燥净化中,有一步操作是用铜氨液除去原料气中的CO,其反应为:。对吸收CO后的铜氨废液应该怎样处理?请提出你的建议:。
(2)、实验室研究是工业生产的基石。下图中的实验数据是在其它条件不变时,不同温度(、、)、压强下,平衡混合物中NH3的物质的量分数的变化情况。
①曲线a对应的温度是。
②M、N、Q点平衡常数K的大小关系是。
25. 回答下列问题:(1)、合成氨工业对化学和国防工业具有重要意义。如下图表示298.15K时,、、与的平均能量与合成氨反应的活化能的曲线图:
①写出该反应的热化学方程式
②图中曲线(填“a”或“b”)表示加入铁触媒的能量变化曲线,铁触媒能加快反应速率的原理是。
(2)、合成氨生产流程示意图如下图所示:
根据生产流程示意图,请回答下列问题:
①合成氨工业中循环利用的物质有(填化学式),采用循环操作主要是为了。
②工业合成氨采取了下列措施,其中能提高氨气的产率是(填编号)。
A.用铁触媒作催化剂 B.选择400℃至500℃的温度
C.用压缩机加压 D.冷却并分离出液态氨
26. 工业上用N2和H2合成NH3 “N2 + 3H2 ⇌2NH3+Q”(反应条件略)。请回答下列问题:(1)、在实际化工生产中,为提高NH3的产率,可以采取的措施有(写两个): , 。(2)、氨气与酸反应得到铵盐,某(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡(用离子方程式表示),该反应对水的电离平衡起到作用(填“促进”“抑制”或“无影响”)。(NH4)2SO4溶液中的离子浓度由大到小的顺序为。(3)、某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响。实验结果如图所示:(图中T表示温度,n表示起始时H2物质的量)
①图像中T2和T1的关系是:T2T1(填“ ”“ ”“ ”或“无法确定”)。
②在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是(填字母)。
③若容器容积为2L,b点对应的n=0.15mol,测得平衡时H2、N2的转化率均为60%,则平衡时N2的物质的量浓度为 mol/L。