【备考2024年】高考化学广东卷真题变式分层精准练(第09题)
试卷更新日期:2024-02-23 类型:二轮复习
一、真题重现
-
1. 按图装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是( )
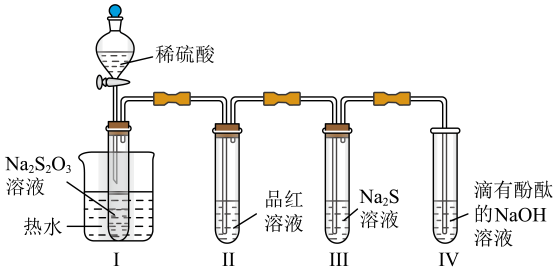 A、Ⅰ中试管内的反应,体现的氧化性 B、Ⅱ中品红溶液褪色,体现的还原性 C、在Ⅰ和Ⅲ的试管中,都出现了浑浊现象 D、撤掉水浴,重做实验,Ⅳ中红色更快褪去
A、Ⅰ中试管内的反应,体现的氧化性 B、Ⅱ中品红溶液褪色,体现的还原性 C、在Ⅰ和Ⅲ的试管中,都出现了浑浊现象 D、撤掉水浴,重做实验,Ⅳ中红色更快褪去二、基础巩固
-
2. 如图装置可用于收集气体并验证其某些化学性质,能达到目的是( )

选项
气体
试剂
现象
结论
A
酚酞试液
溶液变红色
氨水是碱性
B
紫色石蕊试液
溶液先变红后褪色
有酸性和漂白性
C
溴水
溶液褪色
分子中含碳碳双键
D
X
KI淀粉溶液
溶液变蓝
X可能是
A、A B、B C、C D、D3. 打开分液漏斗活塞和玻璃塞,进行如图所示的探究实验,对实验现象分析正确的是( ) A、试管中产生大量气泡,说明被氧化产生 B、试管内层溶液褪色,说明具有还原性 C、一段时间后试管内有白色沉淀,说明有生成 D、试管中浸有品红溶液的棉球褪色,说明具有氧化性4. 探究蔗糖与浓硫酸反应及气体产物的性质,设计如图所示实验,下列说法正确的是( )
A、试管中产生大量气泡,说明被氧化产生 B、试管内层溶液褪色,说明具有还原性 C、一段时间后试管内有白色沉淀,说明有生成 D、试管中浸有品红溶液的棉球褪色,说明具有氧化性4. 探究蔗糖与浓硫酸反应及气体产物的性质,设计如图所示实验,下列说法正确的是( ) A、蔗糖变为黑色,说明浓硫酸有强氧化性 B、品红和酸性溶液褪色原理相同 C、石蕊变红,说明气体产物溶于水有酸性 D、澄清石灰水变浑浊,气体产物一定含5. 大约4000年前,埃及人会用硫燃烧产生的来漂白布匹.利用下列装置验证性质,有关说法不正确的是( )
A、蔗糖变为黑色,说明浓硫酸有强氧化性 B、品红和酸性溶液褪色原理相同 C、石蕊变红,说明气体产物溶于水有酸性 D、澄清石灰水变浑浊,气体产物一定含5. 大约4000年前,埃及人会用硫燃烧产生的来漂白布匹.利用下列装置验证性质,有关说法不正确的是( )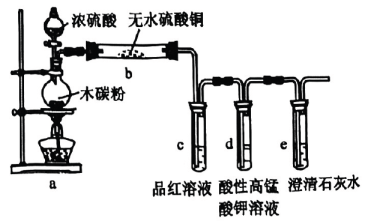 A、装置a中的反应体现了浓硫酸的强氧化性 B、装置b中白色粉末变蓝 C、品红和酸性溶液褪色原理相同 D、澄清石灰水变浑浊,气体产物中可能含
A、装置a中的反应体现了浓硫酸的强氧化性 B、装置b中白色粉末变蓝 C、品红和酸性溶液褪色原理相同 D、澄清石灰水变浑浊,气体产物中可能含三、能力提升
-
6. 实验室用如图所示装置研究不同价态硫元素之间的转化,下列说法正确的是( )
 A、将①中生成的气体通入BaCl2溶液中会出现白色沉淀 B、②中棉花紫色褪去,体现SO2的漂白性 C、③中有黄色固体生成,氧化剂与还原剂物质的量之比为2∶1 D、实验后向④的小烧杯中加入足量盐酸,可能产生黄绿色气体7. 用如图装置分别进行两个实验:①先注入 , 再打开止水夹;②先打开止水夹 , 再将中水注入烧瓶。下列说法正确的是( )
A、将①中生成的气体通入BaCl2溶液中会出现白色沉淀 B、②中棉花紫色褪去,体现SO2的漂白性 C、③中有黄色固体生成,氧化剂与还原剂物质的量之比为2∶1 D、实验后向④的小烧杯中加入足量盐酸,可能产生黄绿色气体7. 用如图装置分别进行两个实验:①先注入 , 再打开止水夹;②先打开止水夹 , 再将中水注入烧瓶。下列说法正确的是( )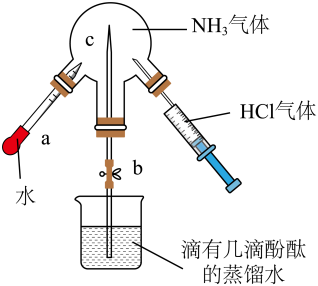 A、实验室可以加热直接制取 B、实验②观察到烧瓶中产生红色的“喷泉” C、实验①先产生白雾,然后观察到喷泉现象 D、实验①后烧瓶中一定存在8. 铁是应用最广泛的金属,在一定条件下可与水蒸气反应(装置如下图所示),下列说法错误的是
A、实验室可以加热直接制取 B、实验②观察到烧瓶中产生红色的“喷泉” C、实验①先产生白雾,然后观察到喷泉现象 D、实验①后烧瓶中一定存在8. 铁是应用最广泛的金属,在一定条件下可与水蒸气反应(装置如下图所示),下列说法错误的是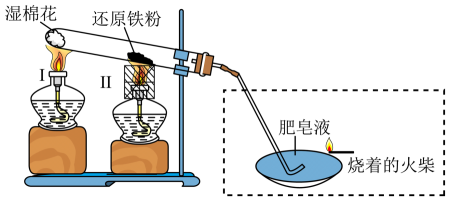 A、充分反应后,还原铁粉变成红色固体 B、湿棉花的作用是提供反应所需水蒸气 C、虚线方框中装置是为了检验反应产生的气体 D、酒精灯Ⅱ配用的金属套筒目的是聚集火焰,提高温度9. 高铁酸钠是一种新型绿色消毒剂,主要用于饮用水处理。某化学兴趣小组用废铁屑(主要成分为 , 杂质有及油脂)制备高铁酸钠的主要流程如下。下列说法错误的是( )
A、充分反应后,还原铁粉变成红色固体 B、湿棉花的作用是提供反应所需水蒸气 C、虚线方框中装置是为了检验反应产生的气体 D、酒精灯Ⅱ配用的金属套筒目的是聚集火焰,提高温度9. 高铁酸钠是一种新型绿色消毒剂,主要用于饮用水处理。某化学兴趣小组用废铁屑(主要成分为 , 杂质有及油脂)制备高铁酸钠的主要流程如下。下列说法错误的是( ) A、“碱浸”可以除去废铁屑中的油脂 B、“滤渣”的主要成分是和 C、“操作Ⅰ”通入的空气可以用溶液代替 D、若流程改为先“氧化”后“调”,可能会生成10. 硫酰氯()是一种重要的化工试剂,常用纯净的氯气和二氧化硫合成。
A、“碱浸”可以除去废铁屑中的油脂 B、“滤渣”的主要成分是和 C、“操作Ⅰ”通入的空气可以用溶液代替 D、若流程改为先“氧化”后“调”,可能会生成10. 硫酰氯()是一种重要的化工试剂,常用纯净的氯气和二氧化硫合成。已知:① ,
②常温下硫酰氯为无色液体,熔点 , 沸点 , 在潮湿空气中“发烟”。
实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出):则下列说法错误的是( )
 A、硫酰氯在潮湿空气中“发烟”的原因是 B、装置A中发生反应的离子方程式为 C、仪器E的作用是冷凝回流,减少的挥发损失 D、F装置只起到吸收尾气的作用11. 通过测定混合气中含量可计算已变质的(含)纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是( )
A、硫酰氯在潮湿空气中“发烟”的原因是 B、装置A中发生反应的离子方程式为 C、仪器E的作用是冷凝回流,减少的挥发损失 D、F装置只起到吸收尾气的作用11. 通过测定混合气中含量可计算已变质的(含)纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是( )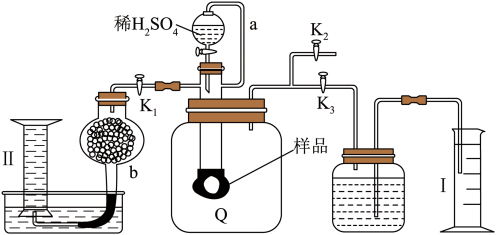 A、Q气囊中产生的气体主要成分为、 B、测定气体总体积必须关闭、 , 打开 C、读完气体总体积后,关闭 , 缓缓打开 , 可观察到Q气囊慢慢缩小 D、量筒I用于测二氧化碳的量,干燥管b中装入碱石灰,量筒Ⅱ用于测氧气的量
A、Q气囊中产生的气体主要成分为、 B、测定气体总体积必须关闭、 , 打开 C、读完气体总体积后,关闭 , 缓缓打开 , 可观察到Q气囊慢慢缩小 D、量筒I用于测二氧化碳的量,干燥管b中装入碱石灰,量筒Ⅱ用于测氧气的量四、模拟演练
-
12. 为回收利用含I2的CCl4废液,某化学兴趣小组设计方案如下所示,下列说法不正确的是( )
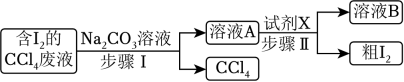 A、步骤Ⅰ中,加入足量Na2CO3溶液充分反应后,上下两层均为无色 B、步骤Ⅰ中,分液时从分液漏斗下口放出溶液A C、试剂X可用硫酸 D、粗I2可用升华法进一步提纯13. 实验小组按如图装置进行实验,制备并探究的性质。下列说法错误的是( )
A、步骤Ⅰ中,加入足量Na2CO3溶液充分反应后,上下两层均为无色 B、步骤Ⅰ中,分液时从分液漏斗下口放出溶液A C、试剂X可用硫酸 D、粗I2可用升华法进一步提纯13. 实验小组按如图装置进行实验,制备并探究的性质。下列说法错误的是( )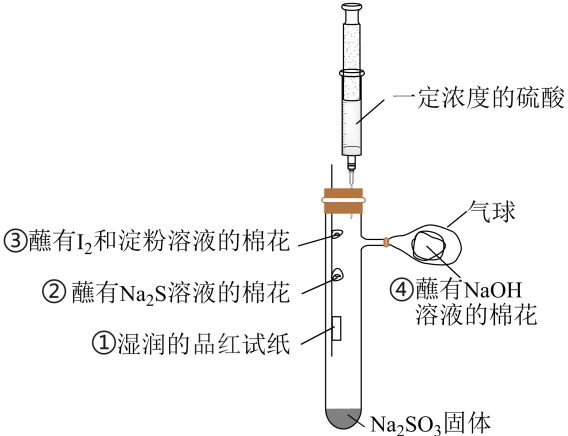 A、试管内制备的化学方程式为 B、②处观察到淡黄色固体生成,说明具有还原性 C、①、③处均可观察到颜色褪去,但褪色原理不相同 D、④处NaOH溶液可吸收多余的14. 某学习小组设计用98%的浓硫酸制取SO2并验证其部分性质的实验装置图如下(夹持装置省略)。下列叙述不正确的是( )
A、试管内制备的化学方程式为 B、②处观察到淡黄色固体生成,说明具有还原性 C、①、③处均可观察到颜色褪去,但褪色原理不相同 D、④处NaOH溶液可吸收多余的14. 某学习小组设计用98%的浓硫酸制取SO2并验证其部分性质的实验装置图如下(夹持装置省略)。下列叙述不正确的是( )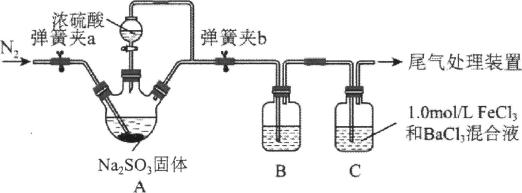 A、装置A中发生的离子反应方程式为:2H++= SO2↑+H2O B、若装置B中装有品红溶液,观察到B中溶液红色褪去,则说明SO2具有漂白性 C、若装置B中装有酸性高锰酸钾溶液,观察到B中溶液褪色,则说明SO2具有还原性 D、装置C产生的白色沉淀为BaSO415. 某实验小组用如图装置制备氯气并探究其性质(夹持装置已省略),下列分析错误的是( )
A、装置A中发生的离子反应方程式为:2H++= SO2↑+H2O B、若装置B中装有品红溶液,观察到B中溶液红色褪去,则说明SO2具有漂白性 C、若装置B中装有酸性高锰酸钾溶液,观察到B中溶液褪色,则说明SO2具有还原性 D、装置C产生的白色沉淀为BaSO415. 某实验小组用如图装置制备氯气并探究其性质(夹持装置已省略),下列分析错误的是( )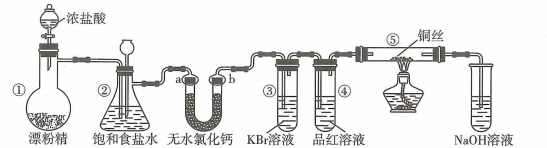 A、装置①中生成氯气反应的化学方程式: B、a、b分别放干燥和湿润的有色布条,可以验证干燥的不具有漂白性 C、反应开始后可观察到③中溶液变黄,④中溶液褪色,说明氯水具有氧化性和漂白性 D、反应开始后点燃酒精灯,可在⑤号硬质玻璃管中观察到棕黄色烟16. 将铜丝插入浓硝酸中进行如图所示的实验,下列说法正确的是
A、装置①中生成氯气反应的化学方程式: B、a、b分别放干燥和湿润的有色布条,可以验证干燥的不具有漂白性 C、反应开始后可观察到③中溶液变黄,④中溶液褪色,说明氯水具有氧化性和漂白性 D、反应开始后点燃酒精灯,可在⑤号硬质玻璃管中观察到棕黄色烟16. 将铜丝插入浓硝酸中进行如图所示的实验,下列说法正确的是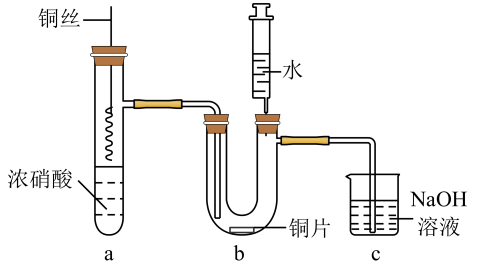 A、装置a中出现红棕色气体,只体现的酸性 B、一段时间后抽出铜丝,向装置b注入水,b中气体红棕色变浅 C、注入水后装置b中铜片表面产生气泡,说明与硝酸生成 D、装置c用吸收尾气,说明和均是酸性氧化物17. 下列关于Fe3+、Fe2+性质实验的说法错误的是( )
A、装置a中出现红棕色气体,只体现的酸性 B、一段时间后抽出铜丝,向装置b注入水,b中气体红棕色变浅 C、注入水后装置b中铜片表面产生气泡,说明与硝酸生成 D、装置c用吸收尾气,说明和均是酸性氧化物17. 下列关于Fe3+、Fe2+性质实验的说法错误的是( ) A、用如图装置可以制备Fe(OH)2沉淀 B、配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 C、向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,此现象不能确定溶液中含有Fe2+ D、向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化18. 氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33 ℃,沸点为73 ℃,遇水易反应。实验室可用如图装置(部分夹持装置已略去)制取ICl3 , 制备的反应原理:I2+3 Cl2=2ICl3 , 下列说法正确的是( )
A、用如图装置可以制备Fe(OH)2沉淀 B、配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 C、向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,此现象不能确定溶液中含有Fe2+ D、向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化18. 氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33 ℃,沸点为73 ℃,遇水易反应。实验室可用如图装置(部分夹持装置已略去)制取ICl3 , 制备的反应原理:I2+3 Cl2=2ICl3 , 下列说法正确的是( )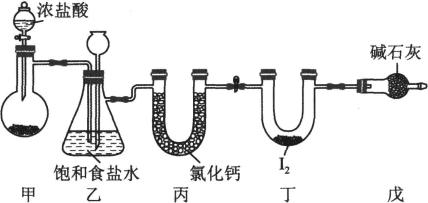 A、甲装置是制备Cl2的装置,可利用MnO2和浓盐酸的反应 B、装置乙中长颈漏斗内液面上升说明装置可能发生堵塞 C、装置丙和戊的作用为除水,防止与ICl3反应,可更换为浓硫酸 D、装置丁中生成ICI3 , 碘元素的化合价为-319. 对浓盐酸与高锰酸钾反应产生的气体进行如下图所示的探究实验,下列分析正确的是( )
A、甲装置是制备Cl2的装置,可利用MnO2和浓盐酸的反应 B、装置乙中长颈漏斗内液面上升说明装置可能发生堵塞 C、装置丙和戊的作用为除水,防止与ICl3反应,可更换为浓硫酸 D、装置丁中生成ICI3 , 碘元素的化合价为-319. 对浓盐酸与高锰酸钾反应产生的气体进行如下图所示的探究实验,下列分析正确的是( ) A、a处酚酞褪色,说明了氯气有漂白性 B、b处湿润的红布条褪色,说明氯气有漂白性 C、c湿润的蓝色石蕊试纸先变红后褪色,说明氯气与水生成了酸性物质和漂白性物质 D、d处溶液变成橙黄色、e处试纸变成蓝色,说明氧化性:
A、a处酚酞褪色,说明了氯气有漂白性 B、b处湿润的红布条褪色,说明氯气有漂白性 C、c湿润的蓝色石蕊试纸先变红后褪色,说明氯气与水生成了酸性物质和漂白性物质 D、d处溶液变成橙黄色、e处试纸变成蓝色,说明氧化性:
-