【备考2024年】从巩固到提高 高考化学二轮微专题16 二次电池
试卷更新日期:2024-02-23 类型:二轮复习
一、选择题
-
1. 钠基海水电池是一种能量密度高、环境友好的储能电池(示意图如下),电极材料为钠基材料和选择性催化材料(能抑制海水中的吸附和氧化),固体电解质只允许透过。下列说法正确的是( )
 A、放电时,a电极发生还原反应 B、放电时,电极的电势低于电极 C、充电时,电极的电极反应式为: D、充电时,每转移电子,理论上有由电极迁移到电极2. 某生物质电池原理如下图所示,充、放电时分别得到高附加值的醇和羧酸。下列说法正确的是( )
A、放电时,a电极发生还原反应 B、放电时,电极的电势低于电极 C、充电时,电极的电极反应式为: D、充电时,每转移电子,理论上有由电极迁移到电极2. 某生物质电池原理如下图所示,充、放电时分别得到高附加值的醇和羧酸。下列说法正确的是( )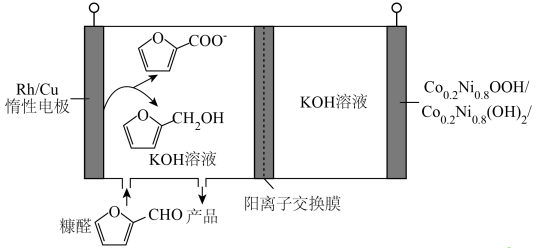 A、放电时,正极电极反应为:
A、放电时,正极电极反应为: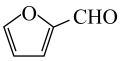 +H2O-2e-=
+H2O-2e-=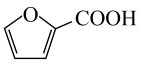 +2H+
B、放电时,转化为
C、充电时,通过交换膜从左室向右室迁移
D、充电时,阴极电极反应为:
+2H+
B、放电时,转化为
C、充电时,通过交换膜从左室向右室迁移
D、充电时,阴极电极反应为: +2H2O+2e-=
+2H2O+2e-=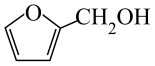 +2OH-
3. 水系电池在碳循环方面具有广阔的应用前景。该电池的示意图如下,其中双极膜在工作时催化解离为和 , 并在直流电场的作用下分别向两极迁移。下列说法正确的是( )
+2OH-
3. 水系电池在碳循环方面具有广阔的应用前景。该电池的示意图如下,其中双极膜在工作时催化解离为和 , 并在直流电场的作用下分别向两极迁移。下列说法正确的是( )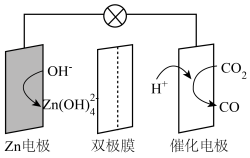 A、放电时,电极为负极,发生还原反应 B、充电时,从电极通过双极膜到达催化电极发生反应 C、放电时,催化电极上的反应为 D、充电时,电极上的反应为4. 一种基于固体电解质的可充电熔融钠电池,具有安全、电流密度高、使用条件宽泛等优点,其工作示意图如下所示,已知电池放电时不断有生成。下列说法错误的是( )
A、放电时,电极为负极,发生还原反应 B、充电时,从电极通过双极膜到达催化电极发生反应 C、放电时,催化电极上的反应为 D、充电时,电极上的反应为4. 一种基于固体电解质的可充电熔融钠电池,具有安全、电流密度高、使用条件宽泛等优点,其工作示意图如下所示,已知电池放电时不断有生成。下列说法错误的是( )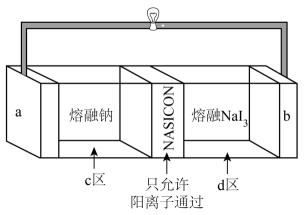 A、放电时电极为负极 B、固体电解质含钠离子 C、充电时阳极反应式: D、转移时,区和区的质量差改变5. 我国学者研制了一种锌基电极,与涂覆氢氧化镍的镍基电极组成可充电电池,其示意图如下。放电时,转化为。下列说法错误的是( )
A、放电时电极为负极 B、固体电解质含钠离子 C、充电时阳极反应式: D、转移时,区和区的质量差改变5. 我国学者研制了一种锌基电极,与涂覆氢氧化镍的镍基电极组成可充电电池,其示意图如下。放电时,转化为。下列说法错误的是( ) A、放电时,正极反应为: B、放电时,若外电路有电子转移,则有向正极迁移 C、充电时,为外接电源负极 D、充电时,阴极反应为:6. 某钠离子电池的负极材料为NaxCy , 正极材料为Na2Mn[Fe(CN)6],其充放电过程是Na+在正负极间的镶嵌与脱嵌(图中箭头指示电子的转移方向)。下列说法正确的是( )
A、放电时,正极反应为: B、放电时,若外电路有电子转移,则有向正极迁移 C、充电时,为外接电源负极 D、充电时,阴极反应为:6. 某钠离子电池的负极材料为NaxCy , 正极材料为Na2Mn[Fe(CN)6],其充放电过程是Na+在正负极间的镶嵌与脱嵌(图中箭头指示电子的转移方向)。下列说法正确的是( )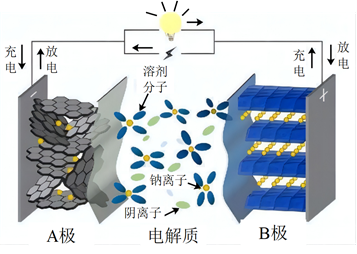 A、放电时,电子的流向为A→外电路→B→电解质溶液→A B、该电池可以选择NaOH溶液为电解质 C、充电时,Na+从B极脱嵌,在A极嵌入 D、放电时,B极的电极反应式为:NaxCy- xe-═ xNa++ Cy7. 2023年星恒电源发布“超钠F1”开启钠电在电动车上产业化元年.该二次电池的电极材料为(普鲁士白)和(嵌钠硬碳).下列说法中错误的是( )
A、放电时,电子的流向为A→外电路→B→电解质溶液→A B、该电池可以选择NaOH溶液为电解质 C、充电时,Na+从B极脱嵌,在A极嵌入 D、放电时,B极的电极反应式为:NaxCy- xe-═ xNa++ Cy7. 2023年星恒电源发布“超钠F1”开启钠电在电动车上产业化元年.该二次电池的电极材料为(普鲁士白)和(嵌钠硬碳).下列说法中错误的是( ) A、放电时,左边电极电势高 B、放电时,负极的电极反应式可表示为: C、充电时,电路中每转移电子,阳极质量增加 D、比能量:锂离子电池高于钠离子电池8. 科学家研制了以为活性材料的水系液流电池,充电时其工作原理如图所示。已知Nafion膜是一种特殊的质子交换膜,具有较高的质子传导率。下列说法不正确的是( )
A、放电时,左边电极电势高 B、放电时,负极的电极反应式可表示为: C、充电时,电路中每转移电子,阳极质量增加 D、比能量:锂离子电池高于钠离子电池8. 科学家研制了以为活性材料的水系液流电池,充电时其工作原理如图所示。已知Nafion膜是一种特殊的质子交换膜,具有较高的质子传导率。下列说法不正确的是( ) A、放电时,电极N是负极 B、放电时,总反应为 C、充电时,阴极室中溶液逐渐增大 D、充电时,若电极N上产物分别为和 , 则电路中转移相同数目的电子消耗的物质的量之比为1:29. 一种可充电锌—空气电池放电时的工作原理如下图所示。已知:Ⅰ室溶液中,锌主要以的形式存在,并存在。下列说法正确的是( )
A、放电时,电极N是负极 B、放电时,总反应为 C、充电时,阴极室中溶液逐渐增大 D、充电时,若电极N上产物分别为和 , 则电路中转移相同数目的电子消耗的物质的量之比为1:29. 一种可充电锌—空气电池放电时的工作原理如下图所示。已知:Ⅰ室溶液中,锌主要以的形式存在,并存在。下列说法正确的是( )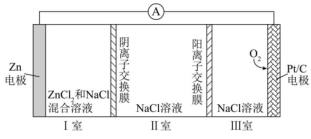 A、放电时,Ⅰ室溶液pH增大 B、放电时,该装置Ⅱ室可实现海水淡化 C、充电时,Zn电极反应为 D、充电时,每生成 , Ⅲ室溶液质量理论上减少32g10. 沉积型锌镍单液流电池是介于双液流电池和传统二次电池之间的一种储能装置,放电时的电池结构见如图。下列说法正确的是( )
A、放电时,Ⅰ室溶液pH增大 B、放电时,该装置Ⅱ室可实现海水淡化 C、充电时,Zn电极反应为 D、充电时,每生成 , Ⅲ室溶液质量理论上减少32g10. 沉积型锌镍单液流电池是介于双液流电池和传统二次电池之间的一种储能装置,放电时的电池结构见如图。下列说法正确的是( ) A、充电时电极电势:电极电极 B、放电时向电极移动 C、放电时储液罐中溶液浓度减小 D、充电时电极发生反应:11. 现在广泛使用的锂离子电池有多种类型,某可充电钴酸锂电池的工作原理如图所示。下列叙述正确的是( )
A、充电时电极电势:电极电极 B、放电时向电极移动 C、放电时储液罐中溶液浓度减小 D、充电时电极发生反应:11. 现在广泛使用的锂离子电池有多种类型,某可充电钴酸锂电池的工作原理如图所示。下列叙述正确的是( )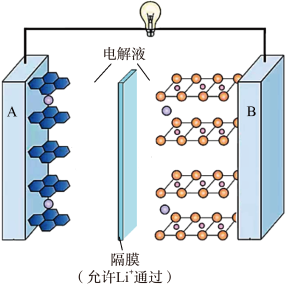 A、该电池放电时,其中正极的电极反应式是 B、充电时A极与电源的正极相连 C、放电时,移向电势较高的电极后得到电子发生还原反应 D、拆解废电池前先进行充电处理既可以保证安全又有利于回收锂12. 氢负离子具有强还原性,是一种颇具潜力的能量载体.2023年4月5日,我国科学家开发了首例室温全固态氢负离子二次电池,该电池通过固态氢负离子导体实现对的快速传导,其工作原理如图所示,其中放电时乙电极的电极反应式为(M为Li、Na、K、Mg、Ti等金属),下列说法错误的是( )
A、该电池放电时,其中正极的电极反应式是 B、充电时A极与电源的正极相连 C、放电时,移向电势较高的电极后得到电子发生还原反应 D、拆解废电池前先进行充电处理既可以保证安全又有利于回收锂12. 氢负离子具有强还原性,是一种颇具潜力的能量载体.2023年4月5日,我国科学家开发了首例室温全固态氢负离子二次电池,该电池通过固态氢负离子导体实现对的快速传导,其工作原理如图所示,其中放电时乙电极的电极反应式为(M为Li、Na、K、Mg、Ti等金属),下列说法错误的是( )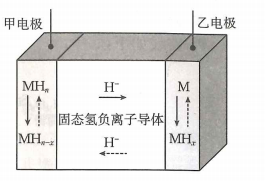 A、放电时,电子经外电路流向甲电极 B、放电时,氢负离子移向乙电极 C、充电时,甲电极发生的反应可表示为 D、可将固态离子导体替换成水溶液电解质,对氢负离子进行传导13. 中国科学院研究团队在碱性锌铁液流二次电池电池研究方面取得新进展。下列叙述不正确的是( )
A、放电时,电子经外电路流向甲电极 B、放电时,氢负离子移向乙电极 C、充电时,甲电极发生的反应可表示为 D、可将固态离子导体替换成水溶液电解质,对氢负离子进行传导13. 中国科学院研究团队在碱性锌铁液流二次电池电池研究方面取得新进展。下列叙述不正确的是( )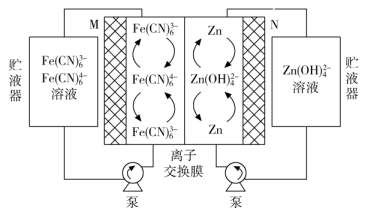 A、充电时,电极M与电源正极相连 B、充电时,阳极的电极反应式为Fe(CN)64--e-=Fe(CN)63- C、放电时,电极N发生氧化反应 D、放电时,电路中转移2 mol电子时,负极区电解质溶液增重65g14. 2023年我国首个兆瓦级铁铬液流电池储能项目在内蒙古成功运行.电池利用溶解在盐酸溶液中的铁、铬离子价态差异进行充放电,工作原理如图.有关叙述不正确的是( )
A、充电时,电极M与电源正极相连 B、充电时,阳极的电极反应式为Fe(CN)64--e-=Fe(CN)63- C、放电时,电极N发生氧化反应 D、放电时,电路中转移2 mol电子时,负极区电解质溶液增重65g14. 2023年我国首个兆瓦级铁铬液流电池储能项目在内蒙古成功运行.电池利用溶解在盐酸溶液中的铁、铬离子价态差异进行充放电,工作原理如图.有关叙述不正确的是( )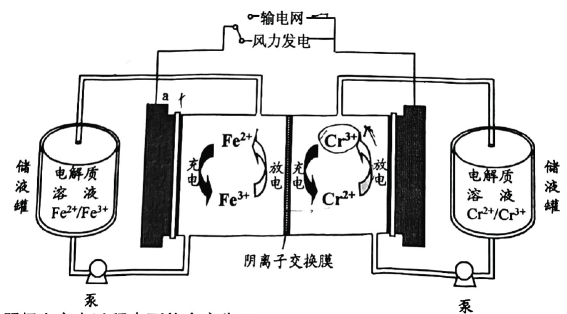 A、阴极在充电过程中可能会产生 B、接输电网时,a极的电极电势高于b C、充电时,阳极的电极反应为 D、放电时,每移向b极,减少15. 我国某大学科研团队提出用多孔泡沫铁、高度膨化的纳米泡沫碳和添加了的溶液构建独特的“摇椅式”全铁离子电池,电池结构如图(阴离子未标出).下列说法错误的是( )
A、阴极在充电过程中可能会产生 B、接输电网时,a极的电极电势高于b C、充电时,阳极的电极反应为 D、放电时,每移向b极,减少15. 我国某大学科研团队提出用多孔泡沫铁、高度膨化的纳米泡沫碳和添加了的溶液构建独特的“摇椅式”全铁离子电池,电池结构如图(阴离子未标出).下列说法错误的是( ) A、可增加电解质溶液的导电性 B、充电时,阳极的电极反应式为 C、放电时,电极N为负极 D、放电时,每转移 , 参与反应的铁元素的总质量为16. 一种以Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其电池放电时的反应原理为2Al+3Fe[Fe(CN)6]+ 14NaAlCl4 =Na2Fe[Fe(CN)6]+8NaAl2Cl7。下列说法错误的是( )
A、可增加电解质溶液的导电性 B、充电时,阳极的电极反应式为 C、放电时,电极N为负极 D、放电时,每转移 , 参与反应的铁元素的总质量为16. 一种以Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其电池放电时的反应原理为2Al+3Fe[Fe(CN)6]+ 14NaAlCl4 =Na2Fe[Fe(CN)6]+8NaAl2Cl7。下列说法错误的是( )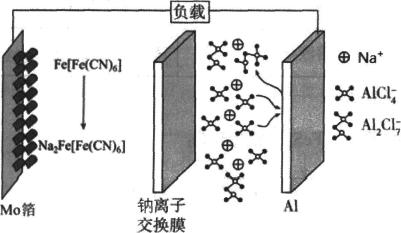 A、充电时,外接直流电源的负极应与Al电极连接 B、充电时,外电路中通过0.2mol电子时,阳极质量变化4.6g C、放电时,每转移1mol电子,负极区电解质溶液质量增加9g D、放电时,正极电极反应式为2Na++2e-+Fe [Fe(CN)6]=Na2Fe[Fe(CN)6]17. 一种水系可逆锌一二氧化碳电池结构如图(在电场的作用下,双极膜的阴、阳膜复合层间的解离成和并分别通过阴膜和阳膜),下列说法正确的是( )
A、充电时,外接直流电源的负极应与Al电极连接 B、充电时,外电路中通过0.2mol电子时,阳极质量变化4.6g C、放电时,每转移1mol电子,负极区电解质溶液质量增加9g D、放电时,正极电极反应式为2Na++2e-+Fe [Fe(CN)6]=Na2Fe[Fe(CN)6]17. 一种水系可逆锌一二氧化碳电池结构如图(在电场的作用下,双极膜的阴、阳膜复合层间的解离成和并分别通过阴膜和阳膜),下列说法正确的是( ) A、放电时,正极区溶液的增大 B、放电时,双极膜产生的移向选择性催化材料 C、充电时,若阴极增重6.5g,则阳极产生1.6g D、充电时,选择性催化材料的电极反应为18. 我国科学家研制了Cu2P2O7催化剂建构Zn—CO2二次电池,实现了电还原CO2合成多碳产品(如乙酸,乙醇等),装置如图所示。双极膜中水电离出的H+和OH-在电场作用下可以分别向两极迁移。下列说法不正确的是( )
A、放电时,正极区溶液的增大 B、放电时,双极膜产生的移向选择性催化材料 C、充电时,若阴极增重6.5g,则阳极产生1.6g D、充电时,选择性催化材料的电极反应为18. 我国科学家研制了Cu2P2O7催化剂建构Zn—CO2二次电池,实现了电还原CO2合成多碳产品(如乙酸,乙醇等),装置如图所示。双极膜中水电离出的H+和OH-在电场作用下可以分别向两极迁移。下列说法不正确的是( ) A、放电时,双极膜中H+向Cu2P2O7极迁移 B、电势:Cu2P2O7极高于Zn极 C、当外电路通过2mol电子时,理论上双极膜中水减少18g D、充电时,阳极上的电极反应式为C2H5OH-12e-+3H2O=2CO2↑+12H+19. 近年来钠离子电池备受关注。利用钠离子在电极间“脱嵌”实现充放电的原理如图所示,电池工作时总反应为( )
A、放电时,双极膜中H+向Cu2P2O7极迁移 B、电势:Cu2P2O7极高于Zn极 C、当外电路通过2mol电子时,理论上双极膜中水减少18g D、充电时,阳极上的电极反应式为C2H5OH-12e-+3H2O=2CO2↑+12H+19. 近年来钠离子电池备受关注。利用钠离子在电极间“脱嵌”实现充放电的原理如图所示,电池工作时总反应为( )
NaxC+Na1-xMnO2C+NaMnO2 , 下列说法不正确的是
A、放电时,正极反应为 B、放电时,当电路中转移1mol电子时,正极质量增加23g C、充电时,电子由电源负极经硬碳、电解液、NaMnO2流向电源正极 D、若用该电池进行电镀铜,镀件应与硬碳相连20. 从玉米穗轴、燕麦与小麦的麦麸和锯木屑等各种农副产品中萃取。清华大学某科研团队创造了一种新型可充放电的生物质电池,其工作原理如图所示:
从玉米穗轴、燕麦与小麦的麦麸和锯木屑等各种农副产品中萃取。清华大学某科研团队创造了一种新型可充放电的生物质电池,其工作原理如图所示:
下列说法正确的是( )
A、放电时,电极发生还原反应 B、充电时,OH-由右侧通过阴离子交换膜移向左侧 C、放电时,若外电路转移1mol电子,理论上正极增重1g D、充电时,阴极电极反应为
