【备考2024年】从巩固到提高 高考化学二轮微专题15 电解池
试卷更新日期:2024-02-23 类型:二轮复习
一、选择题
-
1. 利用下图的电化学装置,可实现
 对的固定。下列说法错误的是( )
对的固定。下列说法错误的是( )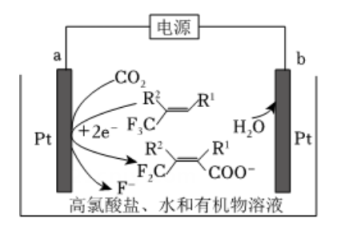 A、向b电极移动 B、a电极的电极反应式为
A、向b电极移动 B、a电极的电极反应式为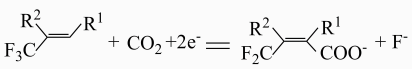 C、电解过程中有生成
D、b电极的Pt用Cu代替后总反应不变
2. 铝的冶炼在工业上通常采用电解Al2O3的方法,装置示意图如图。研究表明,电解AlCl3-NaCl熔融盐也可得到Al,熔融盐中铝元素主要存在形式为AlCl和Al2Cl。下列说法不正确的是( )
C、电解过程中有生成
D、b电极的Pt用Cu代替后总反应不变
2. 铝的冶炼在工业上通常采用电解Al2O3的方法,装置示意图如图。研究表明,电解AlCl3-NaCl熔融盐也可得到Al,熔融盐中铝元素主要存在形式为AlCl和Al2Cl。下列说法不正确的是( )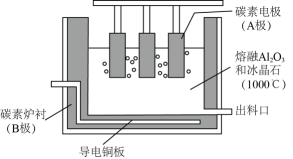 A、电解Al2O3装置中B电极为阴极,发生还原反应 B、电解Al2O3过程中碳素电极虽为惰性电极,但生产中会有损耗,需定期更换 C、电解AlCl3-NaCl时阴极反应式可表示为4Al2Cl+3e—=Al+7AlCl D、电解AlCl3-NaCl时AlCl从阳极流向阴极3. 用一种具有“卯榫”结构的双极膜组装电解池(下图),可实现大电流催化电解溶液制氨。工作时,在双极膜界面处被催化解离成和 , 有利于电解反应顺利进行。下列说法不正确的是( )
A、电解Al2O3装置中B电极为阴极,发生还原反应 B、电解Al2O3过程中碳素电极虽为惰性电极,但生产中会有损耗,需定期更换 C、电解AlCl3-NaCl时阴极反应式可表示为4Al2Cl+3e—=Al+7AlCl D、电解AlCl3-NaCl时AlCl从阳极流向阴极3. 用一种具有“卯榫”结构的双极膜组装电解池(下图),可实现大电流催化电解溶液制氨。工作时,在双极膜界面处被催化解离成和 , 有利于电解反应顺利进行。下列说法不正确的是( )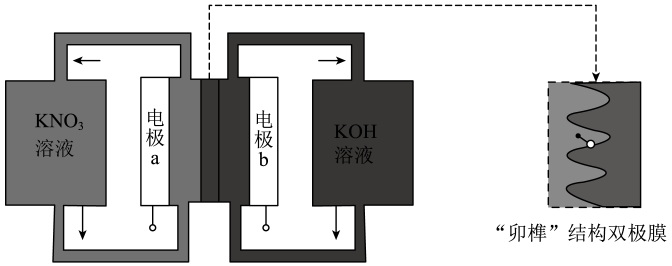 A、电解总反应: B、每生成 , 双极膜处有的解离 C、电解过程中,阳极室中的物质的量不因反应而改变 D、相比于平面结构双极膜,“卯榫”结构可提高氨生成速率4. 氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗,下列说法不正确的是
A、电解总反应: B、每生成 , 双极膜处有的解离 C、电解过程中,阳极室中的物质的量不因反应而改变 D、相比于平面结构双极膜,“卯榫”结构可提高氨生成速率4. 氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗,下列说法不正确的是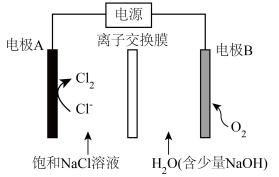 A、电极A接电源正极,发生氧化反应 B、电极B的电极反应式为: C、应选用阳离子交换膜,在右室获得浓度较高的溶液 D、改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少能耗5. 某无隔膜流动海水电解法制的装置如下图所示,其中高选择性催化剂可抑制产生。下列说法正确的是
A、电极A接电源正极,发生氧化反应 B、电极B的电极反应式为: C、应选用阳离子交换膜,在右室获得浓度较高的溶液 D、改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少能耗5. 某无隔膜流动海水电解法制的装置如下图所示,其中高选择性催化剂可抑制产生。下列说法正确的是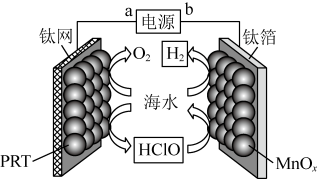 A、b端电势高于a端电势 B、理论上转移生成 C、电解后海水下降 D、阳极发生:6. 一种用于发动机SCR系统的电解尿素()混合装置(X、Y为石墨电极,隔膜仅阻止气体通过)如图,下列说法不正确的是
A、b端电势高于a端电势 B、理论上转移生成 C、电解后海水下降 D、阳极发生:6. 一种用于发动机SCR系统的电解尿素()混合装置(X、Y为石墨电极,隔膜仅阻止气体通过)如图,下列说法不正确的是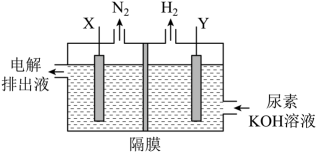 A、装置工作时,电子由Y极流入,X极流出 B、Y极发生还原反应 C、X极的电极反应式为 D、若用铅酸蓄电池为电源,理论上消耗49 g 时,此装置中有0.5mol 生成7. 羟基自由基具有极强的氧化能力,它能有效地氧化降解废水中的有机污染物。在直流电源作用下,利用双极膜电解池产生羟基自由基处理含苯酚废水和含甲醛废水,原理如图所示。已知:双极膜中间层中的解离为和。下列说法错误的是
A、装置工作时,电子由Y极流入,X极流出 B、Y极发生还原反应 C、X极的电极反应式为 D、若用铅酸蓄电池为电源,理论上消耗49 g 时,此装置中有0.5mol 生成7. 羟基自由基具有极强的氧化能力,它能有效地氧化降解废水中的有机污染物。在直流电源作用下,利用双极膜电解池产生羟基自由基处理含苯酚废水和含甲醛废水,原理如图所示。已知:双极膜中间层中的解离为和。下列说法错误的是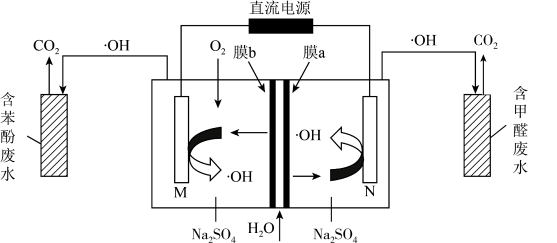 A、M极为阴极,电极反应式: B、双极膜中解离出的透过膜a向N极移动 C、每处理甲醛,理论上有透过膜b D、通电一段时间后,理论上苯酚和甲醛转化生成物质的量之比为6∶78. 电解法制取Na2FeO4的总反应为 , 工作原理如图所示。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。下列叙述正确的是
A、M极为阴极,电极反应式: B、双极膜中解离出的透过膜a向N极移动 C、每处理甲醛,理论上有透过膜b D、通电一段时间后,理论上苯酚和甲醛转化生成物质的量之比为6∶78. 电解法制取Na2FeO4的总反应为 , 工作原理如图所示。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。下列叙述正确的是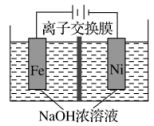 A、铁电极做阳极,发生还原反应 B、Ni电极发生的反应为: C、通电后Na+向右移动,阴极区Na+浓度增大 D、当电路中通过1 mol电子时,阴极区有11.2 L H2生成9. 过硫酸铵可用作氧化剂、漂白剂。利用电解法在两极分别生产过硫酸铵和过氧化氢的装置如图所示。下列说法错误的是
A、铁电极做阳极,发生还原反应 B、Ni电极发生的反应为: C、通电后Na+向右移动,阴极区Na+浓度增大 D、当电路中通过1 mol电子时,阴极区有11.2 L H2生成9. 过硫酸铵可用作氧化剂、漂白剂。利用电解法在两极分别生产过硫酸铵和过氧化氢的装置如图所示。下列说法错误的是 A、a为外接电源的负极 B、电解总反应: C、阴离子交换膜可用阳离子交换膜替代 D、电解池工作时,I室溶液质量理论上逐渐减小10. 通过电解废旧锂电池可回收锂和锰,电解示意图如下(滤布的作用是阻挡固体颗粒,但离子可自由通过)。下列说法正确的是
A、a为外接电源的负极 B、电解总反应: C、阴离子交换膜可用阳离子交换膜替代 D、电解池工作时,I室溶液质量理论上逐渐减小10. 通过电解废旧锂电池可回收锂和锰,电解示意图如下(滤布的作用是阻挡固体颗粒,但离子可自由通过)。下列说法正确的是 A、电极B与电源正极相连,发生还原反应 B、电极A的电极反应: C、当电路中通过时,最多可回收含33g锰 D、电解过程中,的比值不断减小11. 铁碳微电解技术是处理酸性废水的一种工艺,装置如下图所示。若上端口打开,并鼓入空气,可得到强氧化性中间体羟基自由基;若上端口关闭,可得到强还原性中间体氢原子。下列说法正确的是
A、电极B与电源正极相连,发生还原反应 B、电极A的电极反应: C、当电路中通过时,最多可回收含33g锰 D、电解过程中,的比值不断减小11. 铁碳微电解技术是处理酸性废水的一种工艺,装置如下图所示。若上端口打开,并鼓入空气,可得到强氧化性中间体羟基自由基;若上端口关闭,可得到强还原性中间体氢原子。下列说法正确的是 A、无论上端口是关闭还是打开,正极反应式均为: B、完全转化为羟基自由基时转移了电子 C、若处理含酚类的酸性废水,则上端口应关闭 D、若处理含的酸性废水,则上端口应打开并鼓入空气12. 四川大学余达刚教授课题组发展了一种镍催化下用CO2制备苯乙酸的反应,反应原理如图所示。下列有关说法正确的是
A、无论上端口是关闭还是打开,正极反应式均为: B、完全转化为羟基自由基时转移了电子 C、若处理含酚类的酸性废水,则上端口应关闭 D、若处理含的酸性废水,则上端口应打开并鼓入空气12. 四川大学余达刚教授课题组发展了一种镍催化下用CO2制备苯乙酸的反应,反应原理如图所示。下列有关说法正确的是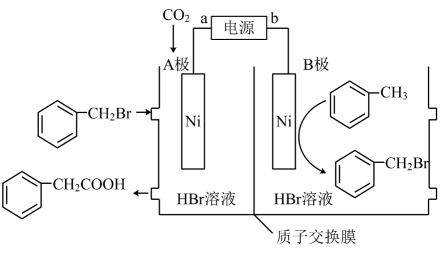 A、H+向B极移动 B、A极的电极反应式为
A、H+向B极移动 B、A极的电极反应式为 C、若使用铅蓄电池作电源,则每生成0.5mol苯乙酸,消耗49gH2SO4
D、该反应的原子利用率为100%,有利于实现碳中和
13. 为实现碳中和,可通过电解法用制备 , 电解装置如图,下列说法错误的是
C、若使用铅蓄电池作电源,则每生成0.5mol苯乙酸,消耗49gH2SO4
D、该反应的原子利用率为100%,有利于实现碳中和
13. 为实现碳中和,可通过电解法用制备 , 电解装置如图,下列说法错误的是 A、玻碳电极为阳极,发生氧化反应 B、铂电极的电极反应: C、制得28g时,产生32g D、电解一段时间后,右池中溶液的pH可能不变14. 新型三步法氯碱工艺,具有清洁、低成本的特点,其工作原理如图所示,假定各装置中溶液体积均为(忽略反应过程中体积变化)。各步骤开始工作时,下列说法错误的是
A、玻碳电极为阳极,发生氧化反应 B、铂电极的电极反应: C、制得28g时,产生32g D、电解一段时间后,右池中溶液的pH可能不变14. 新型三步法氯碱工艺,具有清洁、低成本的特点,其工作原理如图所示,假定各装置中溶液体积均为(忽略反应过程中体积变化)。各步骤开始工作时,下列说法错误的是 A、与传统方法相比,该方法可不需要离子交换膜 B、过程①中b极电极反应式: C、过程②外电路转移时,溶液物质的量浓度变为 D、过程③中溶液中向f极方向移动失去电子产生15. 某有色金属工业的高盐废水中主要含有、、、、和 , 利用如图电解装置可回收、并尽可能除去和 , 其中双极膜(BP)中间层的解离为和 , 并在直流电场作用下分别向两极迁移,M膜、N膜需在一价阴离子交换膜和阳离子交换膜中选择。下列说法错误的是
A、与传统方法相比,该方法可不需要离子交换膜 B、过程①中b极电极反应式: C、过程②外电路转移时,溶液物质的量浓度变为 D、过程③中溶液中向f极方向移动失去电子产生15. 某有色金属工业的高盐废水中主要含有、、、、和 , 利用如图电解装置可回收、并尽可能除去和 , 其中双极膜(BP)中间层的解离为和 , 并在直流电场作用下分别向两极迁移,M膜、N膜需在一价阴离子交换膜和阳离子交换膜中选择。下列说法错误的是 A、BP膜中均向右侧溶液迁移,M膜为一价阴离子交换膜 B、溶液a的溶质主要为HF和HCl,溶液b的溶质主要为和 C、当阳极产生22.4L气体(标准状况)时,有4mol离子通过N膜 D、电解过程中,应控制高盐废水的pH不能过高16. 据文献报道,利用阴极膜过滤反应器能除去废水中的磷元素(假设磷元素的存在形态只有),其装置原理示意图如图所示[图中CaP的组成为3Ca3(PO4)2·CaHPO4·zH2O]:下列叙述正确的是
A、BP膜中均向右侧溶液迁移,M膜为一价阴离子交换膜 B、溶液a的溶质主要为HF和HCl,溶液b的溶质主要为和 C、当阳极产生22.4L气体(标准状况)时,有4mol离子通过N膜 D、电解过程中,应控制高盐废水的pH不能过高16. 据文献报道,利用阴极膜过滤反应器能除去废水中的磷元素(假设磷元素的存在形态只有),其装置原理示意图如图所示[图中CaP的组成为3Ca3(PO4)2·CaHPO4·zH2O]:下列叙述正确的是 A、三电极流出(入)的电子数均相等 B、工作时Ti/SnO2-Sb电极应与直流电源的负极相连 C、Ti/SnO2-Sb电极周围H2O分子被氧化,其氧化产物为H+和O2 D、阴极区的总反应式:20Ca2++14+26e-+2zH2O=2[3Ca3(PO4)2·CaHPO4·zH2O]↓+13H2↑17. 由乙烯制备2-氯乙醇(HOCH2CH2Cl)的原理为:CH2=CH2+HClO→HOCH2CH2Cl。用铂(Pt)作电极电解KCl溶液制备2-氯乙醇的装置如下图所示。下列说法错误的是( )
A、三电极流出(入)的电子数均相等 B、工作时Ti/SnO2-Sb电极应与直流电源的负极相连 C、Ti/SnO2-Sb电极周围H2O分子被氧化,其氧化产物为H+和O2 D、阴极区的总反应式:20Ca2++14+26e-+2zH2O=2[3Ca3(PO4)2·CaHPO4·zH2O]↓+13H2↑17. 由乙烯制备2-氯乙醇(HOCH2CH2Cl)的原理为:CH2=CH2+HClO→HOCH2CH2Cl。用铂(Pt)作电极电解KCl溶液制备2-氯乙醇的装置如下图所示。下列说法错误的是( ) A、Y连接电源的负极 B、电解时,K+通过阳离子交换膜从左侧移向右侧 C、理论上,制取1 mol 2-氯乙醇生成气体b的体积为11.2L (标准状况) 。 D、电解时,左侧溶液pH逐渐减小,右侧溶液pH逐渐增大18. Adv.Mater报道我国科学家耦合光催化/电催化分解水的装置如图,光照时,光催化电极产生电子和空穴。下列有关说法正确的是( )
A、Y连接电源的负极 B、电解时,K+通过阳离子交换膜从左侧移向右侧 C、理论上,制取1 mol 2-氯乙醇生成气体b的体积为11.2L (标准状况) 。 D、电解时,左侧溶液pH逐渐减小,右侧溶液pH逐渐增大18. Adv.Mater报道我国科学家耦合光催化/电催化分解水的装置如图,光照时,光催化电极产生电子和空穴。下列有关说法正确的是( ) A、光催化装置中溶液的减小 B、离子交换膜为阴离子交换膜 C、电催化装置阳极电极反应式: D、整套装置转移 , 光催化装置生成19. 用石墨作电极电解a浊液,记录如表。
A、光催化装置中溶液的减小 B、离子交换膜为阴离子交换膜 C、电催化装置阳极电极反应式: D、整套装置转移 , 光催化装置生成19. 用石墨作电极电解a浊液,记录如表。实验装置
实验现象

I.a为AgCl
II.a为AgI
两电极均产生气泡,有黑色固体在阴极附近生成,并沉降在烧杯底部,烧杯中的液体逐渐变澄清透明
两电极均产生气泡,阴极表面附着少量银白色固体,烧杯中的液体逐渐变为棕黄色
下列说法错误的是
A、I中阳极气体可能为Cl2和O2 , II中阳极气体为O2 B、I和II中阴极生成气体的方程式均为2H2O+2e-=H2↑+2OH- C、II中液体变为棕黄色,说明阳极上发生了反应2AgI-2e-=I2+2Ag+ D、两实验阴极现象有差异的原因可能是II中c(Ag+)比I中的小二、非选择题
-
20. 电镀实验在生产生活中应用广泛。(1)、
Ⅰ.某实验小组设计了如图在纽扣上电镀铜的实验装置:
如图中,石墨是(填阴极或阳极),对应的电极方程式为:;如图装置电解一段时间后,溶液中(填微粒化学式)浓度下降,从而影响镀铜的速率和质量。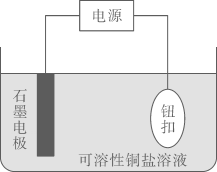 (2)、Ⅱ.实验小组利用如图装置进行铁上电镀铜的实验探究:
(2)、Ⅱ.实验小组利用如图装置进行铁上电镀铜的实验探究:装置示意图
序号
电解质溶液
实验现象
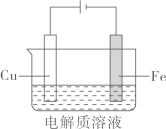
①
0.1mol/L+少量
阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验,铁电极表面有生成。
②
0.1mol/L+过量氨水
阴极表面未观察到气体,一段时间后阴极表面有致密红色固体,经检验,电解液中无Fe元素。
实验①中,无色气体产生的原因是或。
(3)、实验①中,气体减少,推测是由于溶液中减少,且。(4)、欲测定实验①溶液中的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线时,改用胶头滴管滴加蒸馏水至溶液的 , 用标准溶液滴定时应选用滴定管(填“酸式”或“碱式”)。(5)、为确定实验①电解质溶液中的准确浓度 , 实验操作为:准确量取含有的溶液于带塞锥形瓶中,调节溶液 , 加入过量的 , 用标准溶液滴定至终点,消耗溶液。上述过程中反应的离子方程式: , 。滴定选用的指示剂为 , 滴定终点观察到的现象为:当滴入最后半滴标准溶液时,锥形㼛中溶液。(用、、等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果(填“偏大”“偏小”或“无影响”)。(6)、实验②中,与过量氨水反应的离子方程式为 , 反应后的体系呈色。21. (NH4)2S2O8电化学循环氧化法可用于废水中苯酚的降解,示意图如图。 (1)、(NH4)2S2O8的电解法制备
(1)、(NH4)2S2O8的电解法制备已知:电解效率η的定义为η(B)=×100%
①电极b是极。
②生成的电极反应式是。
③向阳极室和阴极室各加入100mL溶液。制备的同时,还在电极b表面收集到2.5×10-4mol气体,气体是。经测定η()为80%,不考虑其他副反应,则制备的(NH4)2S2O8的物质的量浓度为mol/L。
(2)、苯酚的降解已知:·具有强氧化性,Fe2+浓度较高时会导致·猝灭。可将苯酚氧化为CO2 , 但反应速率较慢。加入Fe2+可加快反应,过程为:
ⅰ. +Fe2+=+·+Fe3+
ⅱ. ·将苯酚氧化
① ·氧化苯酚的离子方程式是。
②将电解得到的含溶液稀释后加入苯酚处理器,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图。

用等物质的量的铁粉代替FeSO4 , 可明显提高苯酚的降解率,主要原因是。
(3)、苯酚残留量的测定已知:电解中转移1mol电子所消耗的电量为F库仑
取处理后的水样100mL,酸化后加入KBr溶液,通电。电解产生的Br2全部与苯酚反应,当苯酚完全反应时,消耗的电量为a库仑,则样品中苯酚的含量为g/L。(苯酚的摩尔质量:94g/mol)