【备考2024年】从巩固到提高 高考化学二轮微专题14 原电池
试卷更新日期:2024-02-23 类型:二轮复习
一、选择题
-
1. 如图,b为标准氢电极,可发生还原反应()或氧化反应(),a、c分别为、电极。实验发现:1与2相连a电极质量减小,2与3相连c电极质量增大。下列说法正确的是( )
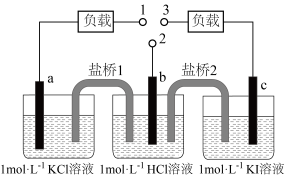 A、1与2相连,盐桥1中阳离子向b电极移动 B、2与3相连,电池反应为 C、1与3相连,a电极减小的质量等于c电极增大的质量 D、1与2、2与3相连,b电极均为流出极2. 利用下图的电化学装置,可实现
A、1与2相连,盐桥1中阳离子向b电极移动 B、2与3相连,电池反应为 C、1与3相连,a电极减小的质量等于c电极增大的质量 D、1与2、2与3相连,b电极均为流出极2. 利用下图的电化学装置,可实现 对的固定。下列说法错误的是( )
对的固定。下列说法错误的是( )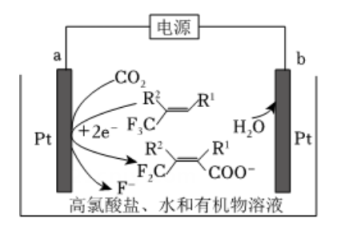 A、向b电极移动 B、a电极的电极反应式为
A、向b电极移动 B、a电极的电极反应式为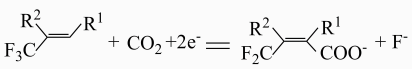 C、电解过程中有生成
D、b电极的Pt用Cu代替后总反应不变
3. 某科研机构研发的NO—空气燃料电池的工作原理如图所示,下列叙述正确的是
C、电解过程中有生成
D、b电极的Pt用Cu代替后总反应不变
3. 某科研机构研发的NO—空气燃料电池的工作原理如图所示,下列叙述正确的是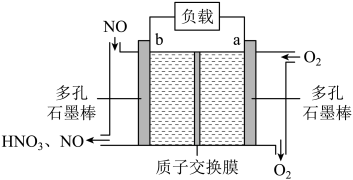 A、a电极为电池负极 B、电池工作时透过质子交换膜从右向左移动 C、b电极的电极反应: D、当外电路中通过电子时,a电极处消耗4. 利用金属Al、海水及其中的溶解氧可组成电池,如图所示。下列说法正确的是( )
A、a电极为电池负极 B、电池工作时透过质子交换膜从右向左移动 C、b电极的电极反应: D、当外电路中通过电子时,a电极处消耗4. 利用金属Al、海水及其中的溶解氧可组成电池,如图所示。下列说法正确的是( )
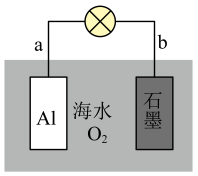 A、b电极为电池正极 B、电池工作时,海水中的向a电极移动 C、电池工作时,紧邻a电极区域的海水呈强碱性 D、每消耗1kgAl,电池最多向外提供37mol电子的电量5. 用一种具有“卯榫”结构的双极膜组装电解池(下图),可实现大电流催化电解溶液制氨。工作时,在双极膜界面处被催化解离成和 , 有利于电解反应顺利进行。下列说法不正确的是( )
A、b电极为电池正极 B、电池工作时,海水中的向a电极移动 C、电池工作时,紧邻a电极区域的海水呈强碱性 D、每消耗1kgAl,电池最多向外提供37mol电子的电量5. 用一种具有“卯榫”结构的双极膜组装电解池(下图),可实现大电流催化电解溶液制氨。工作时,在双极膜界面处被催化解离成和 , 有利于电解反应顺利进行。下列说法不正确的是( )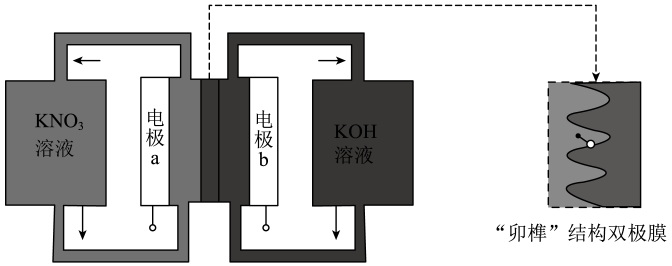 A、电解总反应: B、每生成 , 双极膜处有的解离 C、电解过程中,阳极室中的物质的量不因反应而改变 D、相比于平面结构双极膜,“卯榫”结构可提高氨生成速率6. 甲酸燃料电池工作原理如下图所示,已知该半透膜只允许K+通过。下列有关说法错误的是
A、电解总反应: B、每生成 , 双极膜处有的解离 C、电解过程中,阳极室中的物质的量不因反应而改变 D、相比于平面结构双极膜,“卯榫”结构可提高氨生成速率6. 甲酸燃料电池工作原理如下图所示,已知该半透膜只允许K+通过。下列有关说法错误的是 A、物质A是H2SO4 B、K+经过半透膜自a极向b极迁移 C、a极电极半反应为:HCOO-+2e-+2OH-=+H2O D、Fe3+可以看作是该反应的催化剂,可以循环利用7. 将表面发黑(黑色物质为Ag2S)的银器浸入盛有食盐水的铝制容器中(如图),一段时间后黑色褪去。有关说法正确的是 ( )
A、物质A是H2SO4 B、K+经过半透膜自a极向b极迁移 C、a极电极半反应为:HCOO-+2e-+2OH-=+H2O D、Fe3+可以看作是该反应的催化剂,可以循环利用7. 将表面发黑(黑色物质为Ag2S)的银器浸入盛有食盐水的铝制容器中(如图),一段时间后黑色褪去。有关说法正确的是 ( )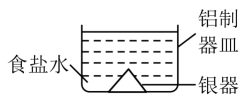 A、该处理过程中电能转化为化学能 B、铝质容器为阳极,其质量变轻 C、Ag2S溶解于食盐水生成了AgCl D、银器为正极,Ag2S被还原为单质银8. 我国科研人员将单独脱除的反应与制备的反应相结合,实现协同转化。
A、该处理过程中电能转化为化学能 B、铝质容器为阳极,其质量变轻 C、Ag2S溶解于食盐水生成了AgCl D、银器为正极,Ag2S被还原为单质银8. 我国科研人员将单独脱除的反应与制备的反应相结合,实现协同转化。已知:反应①单独制备: , 不能自发进行;
反应②单独脱除: , 能自发进行。
协同转化装置如图(在电场作用下,双极膜中间层的解离为和 , 并向两极迁移)。下列分析错误的是
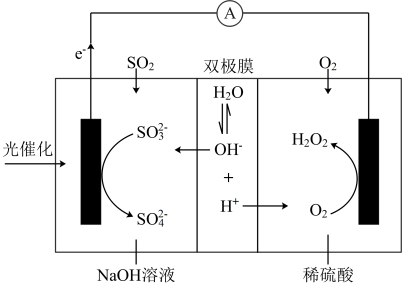 A、反应②释放的能量可以用于反应① B、产生的电极反应: C、当生成0.1 mol 时,负极区溶液质量增重9.8 g D、协同转化总反应:9. 将铜片与石墨连接浸入到稀硫酸溶液中(如图) ,过了较长时间后,发现溶液出现蓝色,下列说法正确的是 ( )
A、反应②释放的能量可以用于反应① B、产生的电极反应: C、当生成0.1 mol 时,负极区溶液质量增重9.8 g D、协同转化总反应:9. 将铜片与石墨连接浸入到稀硫酸溶液中(如图) ,过了较长时间后,发现溶液出现蓝色,下列说法正确的是 ( )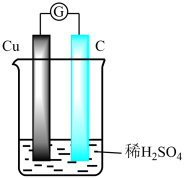 A、铜发生了析氢腐蚀 B、石墨电极发生 O2+4e—+2H2O = 4OH- C、电池总反应是:2Cu+2H2SO4+O2 =2CuSO4+2H2O D、石墨电极附近 Cu2+浓度增加,H+浓度增加10. 利用电化学原理消除污染,还可获得电能,下面是一种处理垃圾渗透液的装置工作原理图。下列说法错误的是 ( )
A、铜发生了析氢腐蚀 B、石墨电极发生 O2+4e—+2H2O = 4OH- C、电池总反应是:2Cu+2H2SO4+O2 =2CuSO4+2H2O D、石墨电极附近 Cu2+浓度增加,H+浓度增加10. 利用电化学原理消除污染,还可获得电能,下面是一种处理垃圾渗透液的装置工作原理图。下列说法错误的是 ( )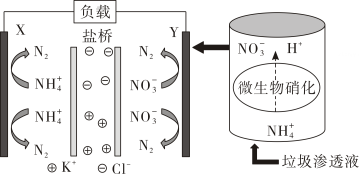 A、X极的电极反应式为 B、Y是正极,发生还原反应 C、当电路中通过5 mol电子,正极区有14 g气体放出 D、盐桥内移向X电极11. 直接NaBH4-H2O2燃料电池具有比能量高等优点,该电池正、负极区域电解质溶液分别为H2SO4溶液、NaOH溶液,并采用阳离子交换膜,放电时( )A、负极上被还原 B、正极发生的反应为 C、由负极移向正极 D、正极区溶液中保持不变12. 我国科研人员利用双极膜技术构造出一类具有高能量密度、优异的循环性能的新型水系电池,模拟装置如图所示。已知电极材料分别为Zn和MnO2 , 相应的产物为和Mn2+。下列说法错误的是
A、X极的电极反应式为 B、Y是正极,发生还原反应 C、当电路中通过5 mol电子,正极区有14 g气体放出 D、盐桥内移向X电极11. 直接NaBH4-H2O2燃料电池具有比能量高等优点,该电池正、负极区域电解质溶液分别为H2SO4溶液、NaOH溶液,并采用阳离子交换膜,放电时( )A、负极上被还原 B、正极发生的反应为 C、由负极移向正极 D、正极区溶液中保持不变12. 我国科研人员利用双极膜技术构造出一类具有高能量密度、优异的循环性能的新型水系电池,模拟装置如图所示。已知电极材料分别为Zn和MnO2 , 相应的产物为和Mn2+。下列说法错误的是 A、双极膜中的OH-通过膜a移向M极 B、电池工作一段时间后,NaOH溶液的pH不变 C、N电极的反应式为MnO2 +4H+ +2e- =Mn2+ +2H2O D、若电路中通过2 mol e- , 则稀硫酸溶液质量增加89 g13. 某微生物燃料电池在废水处理和新能源开发领域具有广阔的应用前景,其工作原理如图所示。下列说法正确的是
A、双极膜中的OH-通过膜a移向M极 B、电池工作一段时间后,NaOH溶液的pH不变 C、N电极的反应式为MnO2 +4H+ +2e- =Mn2+ +2H2O D、若电路中通过2 mol e- , 则稀硫酸溶液质量增加89 g13. 某微生物燃料电池在废水处理和新能源开发领域具有广阔的应用前景,其工作原理如图所示。下列说法正确的是 A、该燃料电池不宜在高温下使用 B、电极b为阳极,发生氧化反应 C、HS-化菌作用下发生反应:HS- -8e-+9OH-=+5H2O D、若该电池外电路有0.4 mol电子转移,则质子交换膜在标准状况下电极b消耗氧气1.12L14. pH计是通过测定电池两极电势差(即电池电动势E)确定待测液pH的仪器,复合电极pH计的工作原理如图。室温下,E=0.059pH+0.2 (E的单位为V)。下列说法错误的是( )
A、该燃料电池不宜在高温下使用 B、电极b为阳极,发生氧化反应 C、HS-化菌作用下发生反应:HS- -8e-+9OH-=+5H2O D、若该电池外电路有0.4 mol电子转移,则质子交换膜在标准状况下电极b消耗氧气1.12L14. pH计是通过测定电池两极电势差(即电池电动势E)确定待测液pH的仪器,复合电极pH计的工作原理如图。室温下,E=0.059pH+0.2 (E的单位为V)。下列说法错误的是( ) A、pH计工作时,化学能转变为电能 B、指示电极的电极电势随待测溶液的c(H+)变化而变化 C、若参比电极电势比指示电极电势高,则指示电极的电极反应式:AgCl(s)+e- = Ag(s) +Cl- D、室温下,若E为0. 377V,则待测溶液的pH=3.015. 将铜棒插入浓、稀溶液中(装置如图)、观察到电流计指针发生偏转,一段时间后,浸入浓溶液的铜棒变粗。下列说法错误的是
A、pH计工作时,化学能转变为电能 B、指示电极的电极电势随待测溶液的c(H+)变化而变化 C、若参比电极电势比指示电极电势高,则指示电极的电极反应式:AgCl(s)+e- = Ag(s) +Cl- D、室温下,若E为0. 377V,则待测溶液的pH=3.015. 将铜棒插入浓、稀溶液中(装置如图)、观察到电流计指针发生偏转,一段时间后,浸入浓溶液的铜棒变粗。下列说法错误的是 A、铜棒变粗的反应: B、导线中电子移动的方向:b→a C、随着反应的进行,浓、稀溶液的浓度逐渐接近 D、的氧化性随增大而增强,Cu的还原性随增大而减弱16. 某种培根型碱性氢氧燃料电池示意图如所示,下列有关该电池的说法错误的是
A、铜棒变粗的反应: B、导线中电子移动的方向:b→a C、随着反应的进行,浓、稀溶液的浓度逐渐接近 D、的氧化性随增大而增强,Cu的还原性随增大而减弱16. 某种培根型碱性氢氧燃料电池示意图如所示,下列有关该电池的说法错误的是 A、电池放电时,向镍电极Ⅰ的方向迁移 B、正极电极反应为: C、出口Ⅰ处有水生成 D、循环泵可使电解质溶液不断浓缩、循环17. 我国科学家近期开发了一种高性能的水系锰基锌电池。 其工作原理如图所示,已知该装置工作一段时间后,K2SO4溶液的浓度增大。下列说法正确的是
A、电池放电时,向镍电极Ⅰ的方向迁移 B、正极电极反应为: C、出口Ⅰ处有水生成 D、循环泵可使电解质溶液不断浓缩、循环17. 我国科学家近期开发了一种高性能的水系锰基锌电池。 其工作原理如图所示,已知该装置工作一段时间后,K2SO4溶液的浓度增大。下列说法正确的是 A、电子流向:Zn电极→b膜→a膜→MnO2电极→负载→Zn电极 B、负极的电极反应式为MnO2+2e-+4H+=Mn2++2H2O C、a膜为阴离子交换膜,b膜为阳离子交换膜 D、装置工作一段时间后,正极区溶液的pH降低18. 目前科学家发明了一种利用微生物进行脱硫、脱氮的原电池装置,其基本原理如图所示(图中隔膜为质子交换膜)。下列有关说法正确的是
A、电子流向:Zn电极→b膜→a膜→MnO2电极→负载→Zn电极 B、负极的电极反应式为MnO2+2e-+4H+=Mn2++2H2O C、a膜为阴离子交换膜,b膜为阳离子交换膜 D、装置工作一段时间后,正极区溶液的pH降低18. 目前科学家发明了一种利用微生物进行脱硫、脱氮的原电池装置,其基本原理如图所示(图中隔膜为质子交换膜)。下列有关说法正确的是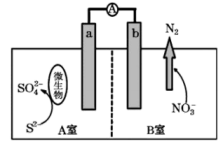 A、a极的电极反应式为 B、H+从B室向A室迁移 C、电池工作时,线路中通过1mol电子,则在b极析出2.24LN2 D、若用该电池给铅蓄电池充电,应将b极连在正极上
A、a极的电极反应式为 B、H+从B室向A室迁移 C、电池工作时,线路中通过1mol电子,则在b极析出2.24LN2 D、若用该电池给铅蓄电池充电,应将b极连在正极上

