【备考2024年】从巩固到提高 高考化学二轮微专题13 金属的电化学腐蚀与防护
试卷更新日期:2024-02-23 类型:二轮复习
一、选择题
-
1. 将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在如图所示的情境中,下列有关说法正确的是
 A、钢铁设施表面因积累大量电子而被保护 B、金属M的活动性比Fe的活动性弱 C、阴极的电极反应式为 D、钢铁设施在河水中的腐蚀速率比在海水中的快2. 海港、码头的钢制管桩会受到海水的长期侵袭,常用外加电流法对其进行保护(如图所示,其中高硅铸铁为惰性辅助电极)。下列有关叙述中错误的是
A、钢铁设施表面因积累大量电子而被保护 B、金属M的活动性比Fe的活动性弱 C、阴极的电极反应式为 D、钢铁设施在河水中的腐蚀速率比在海水中的快2. 海港、码头的钢制管桩会受到海水的长期侵袭,常用外加电流法对其进行保护(如图所示,其中高硅铸铁为惰性辅助电极)。下列有关叙述中错误的是 A、a为负极,b为正极 B、高硅铸铁是作为损耗阳极材料发挥作用的 C、通电时,海水中的阳离子向钢制管柱电极移动 D、通电后使钢制管桩表面的腐蚀电流接近零3. 用如图示的方法可以保护钢质闸门。下列说法正确的是
A、a为负极,b为正极 B、高硅铸铁是作为损耗阳极材料发挥作用的 C、通电时,海水中的阳离子向钢制管柱电极移动 D、通电后使钢制管桩表面的腐蚀电流接近零3. 用如图示的方法可以保护钢质闸门。下列说法正确的是 A、当a、b间用导线连接时,X可以是锌棒,X上发生氧化反应 B、当a、b间用导线连接时,X可以是锌棒,电子经导线流入X C、当a、b与外接电源相连时,a应连接电源的正极 D、当a、b与外接电源相连时,阴极的电极反应式:2Cl--2e-=Cl2↑4. 某同学利用如图所示装置探究金属的腐蚀与防护,下列说法错误的是
A、当a、b间用导线连接时,X可以是锌棒,X上发生氧化反应 B、当a、b间用导线连接时,X可以是锌棒,电子经导线流入X C、当a、b与外接电源相连时,a应连接电源的正极 D、当a、b与外接电源相连时,阴极的电极反应式:2Cl--2e-=Cl2↑4. 某同学利用如图所示装置探究金属的腐蚀与防护,下列说法错误的是 A、③区电极电势Cu高于Fe B、①区Fe电极和③区Fe电极电极反应均为Fe-2e-=Fe2+ C、②区Zn电极和④区Cu电极电极反应均为2H2O+2e-=H2↑+2OH- D、②区Fe电极和④区Fe电极附近滴加K3[Fe(CN)6]溶液,均会出现蓝色沉淀5. 用压强传感器探究生铁分别在pH=2.0、4.0和6.0的酸性溶液中发生电化学腐蚀,得到反应体系气体压强与时间的关系如图。有关叙述错误的是
A、③区电极电势Cu高于Fe B、①区Fe电极和③区Fe电极电极反应均为Fe-2e-=Fe2+ C、②区Zn电极和④区Cu电极电极反应均为2H2O+2e-=H2↑+2OH- D、②区Fe电极和④区Fe电极附近滴加K3[Fe(CN)6]溶液,均会出现蓝色沉淀5. 用压强传感器探究生铁分别在pH=2.0、4.0和6.0的酸性溶液中发生电化学腐蚀,得到反应体系气体压强与时间的关系如图。有关叙述错误的是 A、负极的电极反应式均为: B、pH=2.0时,压强增大主要是因为产生了 C、pH=4.0时,不发生析氢腐蚀,只发生吸氧腐蚀 D、pH=6.0时,正极一定会发生的电极反应为6. 利用如图装置探究铁在海水中的电化学防护,下列说法错误的是
A、负极的电极反应式均为: B、pH=2.0时,压强增大主要是因为产生了 C、pH=4.0时,不发生析氢腐蚀,只发生吸氧腐蚀 D、pH=6.0时,正极一定会发生的电极反应为6. 利用如图装置探究铁在海水中的电化学防护,下列说法错误的是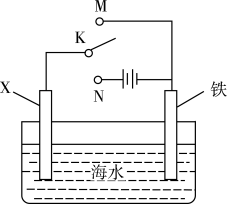 A、若X为锌棒,开关K置于M处,可减缓铁的腐蚀 B、若X为锌棒,开关K置于M处,海水降低 C、若X为碳棒,开关K置于N处,可减缓铁的腐蚀 D、若X为碳棒,开关K置于N处,碳棒上发生氧化反应7. 含可钝化金属的工业管道或反应器,由于会被内部溶液腐蚀,通过外接电源而钝化,称之为阳极保护法。下图是某金属外接电势与电流密度的变化关系,有关说法正确的是( )
A、若X为锌棒,开关K置于M处,可减缓铁的腐蚀 B、若X为锌棒,开关K置于M处,海水降低 C、若X为碳棒,开关K置于N处,可减缓铁的腐蚀 D、若X为碳棒,开关K置于N处,碳棒上发生氧化反应7. 含可钝化金属的工业管道或反应器,由于会被内部溶液腐蚀,通过外接电源而钝化,称之为阳极保护法。下图是某金属外接电势与电流密度的变化关系,有关说法正确的是( ) A、阳极保护法中受保护的金属外接电源的负极 B、电流密度越大,金属受保护程度越好 C、CFD区,金属受到保护 D、外接电势越高,对金属保护性越有效8. 在硫酸盐还原细菌的作用下,深埋地下的铁管道与土壤中的硫酸根离子会发生电化学腐蚀,其原理如图所示。下列说法正确的是( )
A、阳极保护法中受保护的金属外接电源的负极 B、电流密度越大,金属受保护程度越好 C、CFD区,金属受到保护 D、外接电势越高,对金属保护性越有效8. 在硫酸盐还原细菌的作用下,深埋地下的铁管道与土壤中的硫酸根离子会发生电化学腐蚀,其原理如图所示。下列说法正确的是( ) A、铁管道发生的是吸氧腐蚀 B、铁管道附近土壤的pH会减小 C、铁管道上镀锌可以延缓管道的腐蚀 D、输送高温水蒸汽的铁管道也会发生该类型腐蚀9. 家庭常用的一种储水式电热水器的结构如下图所示,其中a、b为水管口。
A、铁管道发生的是吸氧腐蚀 B、铁管道附近土壤的pH会减小 C、铁管道上镀锌可以延缓管道的腐蚀 D、输送高温水蒸汽的铁管道也会发生该类型腐蚀9. 家庭常用的一种储水式电热水器的结构如下图所示,其中a、b为水管口。
下列说法错误的是( )
A、电热水器可将电能转化为热能 B、该热水器采用了牺牲阳极的电化学保护法 C、镁棒可以有效防止内部水垢生成 D、a应为出水口,b应为进水口10. “外加电流法”和“牺牲阳极法”均可有效防止铁发生电化学腐蚀。下列说法不正确的是( )A、铁发生电化学腐蚀的原因是在其表面形成了原电池 B、利用“外加电流法”时,铁连接电源负极 C、“牺牲阳极法”利用了电解池原理 D、两种保护法中都要采用辅助阳极11. 我国学者进行了如下模拟实验:将甲、乙两片相同的低合金钢片用导线连接插入海水中,钢片甲附近通入氧气,钢片乙附近通入氮气。研究表明钢片乙的腐蚀速率明显高于钢片甲,下列说法不正确的是( )A、钢片甲作正极 B、氮气在钢片乙上得电子 C、在海水中阳离子向钢片甲移动 D、能产生电流的主要原因是两极上氧气浓度不同12. 在船体的钢铁外壳上镶嵌锌块可以有效避免船体遭受腐蚀。下列说法不正确的是( )A、锌块作原电池的负极 B、钢铁在海水中易发生吸氧腐蚀 C、电子由船体钢铁外壳向锌块移动 D、在海水中阳离子向船体钢铁外壳移动13. 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。下列说法错误的是( )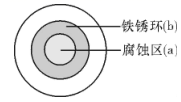 A、铁片腐蚀最严重区域不是生锈最多的区域 B、液滴边缘是正极区,发生的电极反应为O2+2H2O+4e-=4OH- C、液滴下氧气含量少,铁片作负极,发生的还原反应为Fe-2e-=Fe2+ D、铁片腐蚀过程发生的总化学方程式为4Fe+6H2O+3O2=4Fe(OH)314. 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
A、铁片腐蚀最严重区域不是生锈最多的区域 B、液滴边缘是正极区,发生的电极反应为O2+2H2O+4e-=4OH- C、液滴下氧气含量少,铁片作负极,发生的还原反应为Fe-2e-=Fe2+ D、铁片腐蚀过程发生的总化学方程式为4Fe+6H2O+3O2=4Fe(OH)314. 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。①
②
③
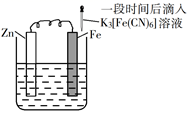
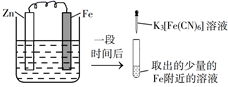
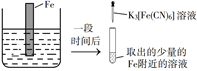
在Fe表面生成蓝色沉淀
试管内无明显变化
试管内生成蓝色沉淀
下列说法错误的是( )
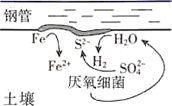
A、对比②③,可以判定Zn保护了Fe B、对比①②,K3[Fe(CN)6]可能将Fe氧化 C、验证Zn保护Fe时不能用①的方法 D、将Zn换成Cu,用①的方法可判断Fe比Cu活泼15. 对金属腐蚀及防护的表述正确的是( )A、金属腐蚀的本质:金属失电子发生还原反应 B、牺牲阳极的阴极保护法:被保护的金属应做负极 C、外加电流阴极保护法:被保护的金属应与电源正极相连 D、钢铁表面烤蓝生成一层致密的 ,能起到防腐蚀作用16. 在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,厌氧细菌可促使土壤中的 与H2反应生成S2- , 加速钢管的腐蚀,其反应原理如下图所示。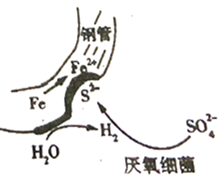
下列说法正确的是( )
A、正极的电极反应式为:2H2O+O2+4e-=4OH- B、钢管腐蚀的直接产物中含有FeS、Fe(OH)2 C、在钢管表面镀锌或镀铜均可减缓钢管的腐蚀 D、 与H2的反应可表示为:4H2+ -8e- S2-+4H2O17. 选取 和 的醋酸溶液分别与生铁反应,进行腐蚀实验,测量密闭容器内压强变化情况如图。下列结论错误的是( ) A、 的醋酸溶液中一定存在吸氧腐蚀 B、酸度不同,腐蚀的主要类型可能不同 C、两组溶液的pH一定逐渐变大 D、若改用盐酸进行实验,腐蚀速率一定变大18. 港珠澳大桥桥体的钢构件采用了多种防腐方法。有关其分析正确的是( )A、越靠近海底的钢构件,腐蚀越严重 B、钢构件上镶嵌铝块,属牺牲阳极阴极保护法 C、钢构件若腐蚀,正极反应式为:Fe-2e-=Fe2+ D、钢构件表面喷涂环氧树脂涂层,防止形成电解池19. 研究电化学腐蚀及防护的装置如下图所示。下列有关说法错误的是( )
A、 的醋酸溶液中一定存在吸氧腐蚀 B、酸度不同,腐蚀的主要类型可能不同 C、两组溶液的pH一定逐渐变大 D、若改用盐酸进行实验,腐蚀速率一定变大18. 港珠澳大桥桥体的钢构件采用了多种防腐方法。有关其分析正确的是( )A、越靠近海底的钢构件,腐蚀越严重 B、钢构件上镶嵌铝块,属牺牲阳极阴极保护法 C、钢构件若腐蚀,正极反应式为:Fe-2e-=Fe2+ D、钢构件表面喷涂环氧树脂涂层,防止形成电解池19. 研究电化学腐蚀及防护的装置如下图所示。下列有关说法错误的是( )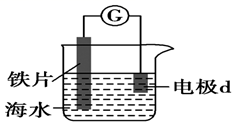 A、d为石墨,铁片腐蚀加快 B、d为石墨,石墨上电极反应为O2+2H2O+4e‒=4OH‒ C、d为锌块,铁片不易被腐蚀 D、d为锌块,锌块上电极反应为2H++2e‒=H2↑20. 用如图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强随时间变化关系以及溶解氧随时间变化关系的曲线如下。
A、d为石墨,铁片腐蚀加快 B、d为石墨,石墨上电极反应为O2+2H2O+4e‒=4OH‒ C、d为锌块,铁片不易被腐蚀 D、d为锌块,锌块上电极反应为2H++2e‒=H2↑20. 用如图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强随时间变化关系以及溶解氧随时间变化关系的曲线如下。
下列说法错误的是( )
A、压强增大主要是因为产生了H2 B、整个过程中,负极电极反应式为:Fe–2e- = Fe2+ C、pH= 4.0时,不发生析氢腐蚀,只发生吸氧腐蚀 D、pH= 2.0时,正极电极反应式为:2H+ + 2e- = H2↑ 和 O2 + 4e- + 4H+ = 2H2O21. 考古发掘出的古代青铜器(含铜锡等金属)表面经常出现小孔腐蚀,这是一种电化学腐蚀现象。小孔腐蚀的过程及铜腐蚀产物(铜锈)的成分如下图所示: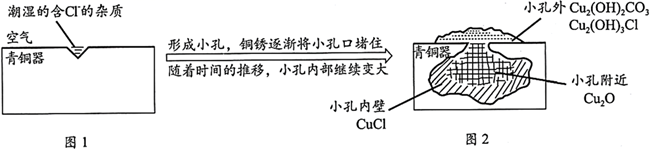
已知:2CuCl+H2O Cu2O+2HCl
下列分析错误的是( )
A、氧气是正极反应物 B、铜锈的成分与氧气浓度、pH有关 C、图2中,Cl-从小孔内向小孔外移动 D、青铜中的锡也会发生电化学腐蚀22. 潮湿环境、Cl-、溶解氧是造成青铜器锈蚀的主要环境因素,腐蚀严重的青铜器表面大多存在起催化作用的多孔催化层。图为青铜器发生电化学腐蚀的原理示意图,下列说法正确的是( ) A、腐蚀过程中,青铜基体是正极 B、若有64gCu腐蚀,理论上耗氧体积为22.4L(标准状况) C、多孔催化层的形成加速了青铜器的腐蚀速率,是因为改变了反应的焓变 D、环境中的Cl-、正负极产物作用生成多孔粉状锈,其离子方程式为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓23. 支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( )
A、腐蚀过程中,青铜基体是正极 B、若有64gCu腐蚀,理论上耗氧体积为22.4L(标准状况) C、多孔催化层的形成加速了青铜器的腐蚀速率,是因为改变了反应的焓变 D、环境中的Cl-、正负极产物作用生成多孔粉状锈,其离子方程式为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓23. 支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( ) A、通入保护电流使钢管桩表面腐蚀电流接近于零 B、通电后外电路电子被强制从高硅铸铁流向钢管桩 C、高硅铸铁的作用是作为损耗阳极材料和传递电流 D、通入的保护电流应该根据环境条件变化进行调整24. 研究性学习小组用如图装置研究钢铁在海水中的腐蚀与防腐,
A、通入保护电流使钢管桩表面腐蚀电流接近于零 B、通电后外电路电子被强制从高硅铸铁流向钢管桩 C、高硅铸铁的作用是作为损耗阳极材料和传递电流 D、通入的保护电流应该根据环境条件变化进行调整24. 研究性学习小组用如图装置研究钢铁在海水中的腐蚀与防腐,
下列说法正确的是( )
A、1中只发生化学腐蚀 B、2中发生的是析氢腐蚀 C、3为外加电流的阴极保护法 D、钢铁被腐蚀的速率: 1>2>325. 我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是( ) A、通电时,锌环是阳极,发生氧化反应 B、通电时,阴极上的电极反应为2H2O+2e-=H2↑+2OH- C、断电时,锌环上的电极反应为Zn2++2e-=Zn D、断电时,仍能防止铁帽被腐蚀26. 研究金属桥墩腐蚀及防护是跨海建桥的重要课题.下列有关判断中正确的是( )
A、通电时,锌环是阳极,发生氧化反应 B、通电时,阴极上的电极反应为2H2O+2e-=H2↑+2OH- C、断电时,锌环上的电极反应为Zn2++2e-=Zn D、断电时,仍能防止铁帽被腐蚀26. 研究金属桥墩腐蚀及防护是跨海建桥的重要课题.下列有关判断中正确的是( )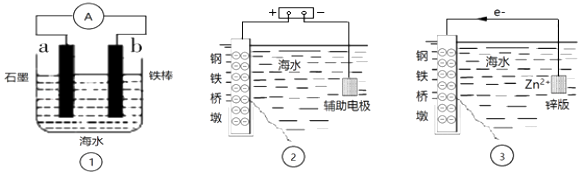 A、用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀 B、②中桥墩与外加电源正极连接能确保桥墩不被腐蚀 C、③中采用了牺牲阳极的阴极保护法保护桥墩 D、①②③中海水均是实现化学能与电能相互转化的电解质
A、用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀 B、②中桥墩与外加电源正极连接能确保桥墩不被腐蚀 C、③中采用了牺牲阳极的阴极保护法保护桥墩 D、①②③中海水均是实现化学能与电能相互转化的电解质二、多选题
-
27. 在缺乏氧气的深层潮湿土壤中存在的硫酸盐还原菌,会附着在钢管表面促进钢铁的腐蚀,这个过程被称为厌氧腐蚀,其反应原理如图所示,下列说法正确的是( )
 A、厌氧腐蚀属于电化学腐蚀 B、负极的电极反应式为 C、每生成1 mol FeS,最终转移的电子数为2 D、镀锌或铜的钢管破损后均会加快钢管的腐蚀
A、厌氧腐蚀属于电化学腐蚀 B、负极的电极反应式为 C、每生成1 mol FeS,最终转移的电子数为2 D、镀锌或铜的钢管破损后均会加快钢管的腐蚀三、非选择题
-
28. 铁的腐蚀与防护与生产生活密切相关。(1)、Ⅰ.研究铁的腐蚀
实验步骤如下:
步骤1:将铁粉放置于0.002 溶液中浸泡,过滤后用水洗涤。
步骤2:向15.00 mL 1 NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。
步骤3:采集溶液pH随时间变化的数据。

第一阶段,主要发生析氢腐蚀,Cu上发生的电极反应为。
(2)、第二、三阶段主要发生吸氧腐蚀。①选取b点进行分析,经检验溶液中含有 , 写出Fe被腐蚀的总反应。
②取b点溶液向其中滴加KSCN无明显现象,加入稀盐酸后立即变红。写出b点被氧化的离子方程式。
③依据b点发生的反应,分析第二阶段pH上升的原因是。
(3)、Ⅱ.研究铁的防护在铁表面镀锌可有效防止铁被腐蚀
已知:放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。
①镀件Fe应与电源的相连。
②向电解液中加入NaCN溶液,将转化为 , 电解得到的镀层更加致密、细腻,原因是。
(4)、电镀后的废水中含有 , 一种测定其含量的方法是:取废水50 mL,再加KI溶液1 mL,用c 溶液滴定,消耗溶液V mL。已知:(无色) , 。①滴定终点的现象是。
②废水中的含量是(填计算式)。
-