【备考2024年】从巩固到提高 高考化学二轮微专题12 化学反应与能量
试卷更新日期:2024-02-23 类型:二轮复习
一、选择题
-
1. 各相关物质的燃烧热数据如下表。下列热化学方程式正确的是( )
物质
A、 B、 C、 D、2. 二氧化碳加氢制甲烷过程中的主要反应为在密闭容器中,、时,平衡转化率、在催化剂作用下反应相同时间所测得的实际转化率随温度的变化如题图所示。的选择性可表示为。下列说法正确的是( )
 A、反应的焓变 B、的平衡选择性随着温度的升高而增加 C、用该催化剂催化二氧化碳反应的最佳温度范围约为480~530℃ D、450℃时,提高的值或增大压强,均能使平衡转化率达到X点的值3. 一定条件下,苯基丙炔()可与发生催化加成,反应如下:
A、反应的焓变 B、的平衡选择性随着温度的升高而增加 C、用该催化剂催化二氧化碳反应的最佳温度范围约为480~530℃ D、450℃时,提高的值或增大压强,均能使平衡转化率达到X点的值3. 一定条件下,苯基丙炔()可与发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确的是
A、反应焓变:反应I>反应Ⅱ B、反应活化能:反应I<反应Ⅱ C、增加浓度可增加平衡时产物Ⅱ和产物I的比例 D、选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ4. 一定条件下,与HCl发生加成反应有①、②两种可能,反应进程中能量变化如图所示。下列说法中不正确的是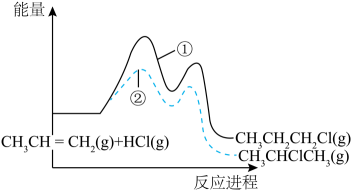 A、反应①、②焓变不同,与产物稳定性有关,与反应的中间状态无关 B、反应①、②均经过两步反应完成,对应的分步反应过程中均放出能量 C、其他条件不变,适当提高反应温度,可以提高产物中的比例 D、相同条件下,的生成速率大于5. 火箭发射时可以用液态肼作燃料,作氧化剂。相关物质的能量转化关系如下。已知 , 则的反应热为
A、反应①、②焓变不同,与产物稳定性有关,与反应的中间状态无关 B、反应①、②均经过两步反应完成,对应的分步反应过程中均放出能量 C、其他条件不变,适当提高反应温度,可以提高产物中的比例 D、相同条件下,的生成速率大于5. 火箭发射时可以用液态肼作燃料,作氧化剂。相关物质的能量转化关系如下。已知 , 则的反应热为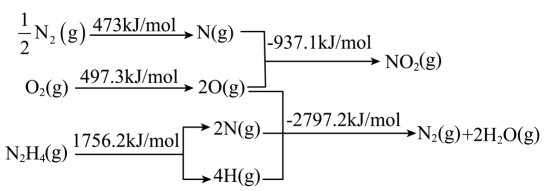 A、 B、 C、 D、6. 我国学者利用催化剂催化丙烷氧化脱氢的历程如图(吸附在催化剂表面的物质用标注)。下列说法正确的是
A、 B、 C、 D、6. 我国学者利用催化剂催化丙烷氧化脱氢的历程如图(吸附在催化剂表面的物质用标注)。下列说法正确的是 A、反应历程中第一步化学反应为决速步骤 B、催化剂改变了丙烷氧化脱氢的焓变() C、过渡态物质的稳定性:过渡态2小于过渡态1 D、吸附过程为吸热过程7. 活泼自由基与氧气的反应一直是关注的热点。自由基与反应过程的能量变化如下图所示,已知升高温度,活化能大的反应速率增大的程度越大。下列说法正确的是
A、反应历程中第一步化学反应为决速步骤 B、催化剂改变了丙烷氧化脱氢的焓变() C、过渡态物质的稳定性:过渡态2小于过渡态1 D、吸附过程为吸热过程7. 活泼自由基与氧气的反应一直是关注的热点。自由基与反应过程的能量变化如下图所示,已知升高温度,活化能大的反应速率增大的程度越大。下列说法正确的是 A、比稳定 B、升高温度,生成的反应速率增大的程度更大 C、该历程中最小正反应的活化能为 D、改变催化剂可以改变生成的反应焓变8. 气态有机物①~④分别与氢气发生加成反应生成1mol气态环己烷(
A、比稳定 B、升高温度,生成的反应速率增大的程度更大 C、该历程中最小正反应的活化能为 D、改变催化剂可以改变生成的反应焓变8. 气态有机物①~④分别与氢气发生加成反应生成1mol气态环己烷( )的能量变化如图所示。下列说法错误的是
)的能量变化如图所示。下列说法错误的是 A、物质的热稳定性:②<③ B、物质④中不存在碳碳双键 C、物质①~④与氢气的加成反应都是放热反应 D、物质③脱氢生成④的热化学方程式为:
A、物质的热稳定性:②<③ B、物质④中不存在碳碳双键 C、物质①~④与氢气的加成反应都是放热反应 D、物质③脱氢生成④的热化学方程式为: (g)
(g) (g)+H2(g)-21kJ
9. 常温常压下,1mol CH3OH与O2发生反应时,生成CO或HCHO的能量变化如图(反应物O2和生成物水略去),下列说法正确的是
(g)+H2(g)-21kJ
9. 常温常压下,1mol CH3OH与O2发生反应时,生成CO或HCHO的能量变化如图(反应物O2和生成物水略去),下列说法正确的是 A、加入催化剂后,生成CO的热效应变大,生成HCHO的热效应变小 B、加入催化剂后,生成HCHO的速率变大,单位时间内生成HCHO量变多 C、1mol CH3OH完全燃烧生成液态水和二氧化碳(g)放出393kJ的热量 D、生成HCHO的热化学方程式为2CH3OH+O2=2HCHO+2H2O+316kJ10. 一定条件下,在密闭容器中,氮气与氢气合成氨气,能量变化曲线如图所示。下列说法正确的是
A、加入催化剂后,生成CO的热效应变大,生成HCHO的热效应变小 B、加入催化剂后,生成HCHO的速率变大,单位时间内生成HCHO量变多 C、1mol CH3OH完全燃烧生成液态水和二氧化碳(g)放出393kJ的热量 D、生成HCHO的热化学方程式为2CH3OH+O2=2HCHO+2H2O+316kJ10. 一定条件下,在密闭容器中,氮气与氢气合成氨气,能量变化曲线如图所示。下列说法正确的是 A、加入催化剂,E1、E2都变小 B、N2(g)+3H2(g)2NH3(g)+600kJ C、升温可以增大该反应的化学平衡常数 D、通入1molN2和3molH2充分反应,放热小于92kJ11. 一定条件下,气态反应物和生成物的相对能量与反应进程如下图所示。下列说法错误的是
A、加入催化剂,E1、E2都变小 B、N2(g)+3H2(g)2NH3(g)+600kJ C、升温可以增大该反应的化学平衡常数 D、通入1molN2和3molH2充分反应,放热小于92kJ11. 一定条件下,气态反应物和生成物的相对能量与反应进程如下图所示。下列说法错误的是 A、 B、为进程II的催化剂 C、相同条件下,进程I、II中的平衡转化率相同 D、两个进程中速率最快的一步反应的12. 甲烷与氯气在光照条件下发生取代反应的部分机理与能量变化如下:
A、 B、为进程II的催化剂 C、相同条件下,进程I、II中的平衡转化率相同 D、两个进程中速率最快的一步反应的12. 甲烷与氯气在光照条件下发生取代反应的部分机理与能量变化如下:链引发: ,
链增长:部分反应进程与势能变化关系如图(所有物质状态为气态)……
链终止: ,
下列说法错误的是
 A、的键能为 B、链增长中反应速率较快的一步的热化学方程式为: C、链增长过程中可能产生 , , D、链终止反应的过程中,还可能会生成少量的乙烷13. 反应过程Ⅰ、Ⅱ都能将反应物(M)转化为产物(N)。其能量与反应进程的关系如下:
A、的键能为 B、链增长中反应速率较快的一步的热化学方程式为: C、链增长过程中可能产生 , , D、链终止反应的过程中,还可能会生成少量的乙烷13. 反应过程Ⅰ、Ⅱ都能将反应物(M)转化为产物(N)。其能量与反应进程的关系如下:
下列有关说法正确的是( )
A、进程Ⅰ是吸热反应 B、X是催化剂 C、M·X比N·X稳定 D、反应热:Ⅰ>Ⅱ14. N2(g)与H2(g)化合生成NH3(g)的过程能量变化如下图所示,有关说法正确的是( ) A、使用催化剂会改变反应的热效应 B、反应的热化学方程式为:N2(g)+3H2(g)2NH3(l)+2bkJ C、1molN(g)和3molH(g)生成1molNH3(g)时,放出bkJ热量 D、1molN2(g)和3molH2(g)的能量之和小于2molNH3(g)的能量15. 相关有机物分别与氢气发生反应生成1mol环己烷(
A、使用催化剂会改变反应的热效应 B、反应的热化学方程式为:N2(g)+3H2(g)2NH3(l)+2bkJ C、1molN(g)和3molH(g)生成1molNH3(g)时,放出bkJ热量 D、1molN2(g)和3molH2(g)的能量之和小于2molNH3(g)的能量15. 相关有机物分别与氢气发生反应生成1mol环己烷( )的能量变化如图所示:
)的能量变化如图所示:
下列叙述错误的是
A、 (g)
(g) (g)为吸热反应
B、
(g)为吸热反应
B、 (g)
(g) (g)
C、相同状况下,等质量的
(g)
C、相同状况下,等质量的 和
和 完全燃烧,
完全燃烧, 放热少
D、 , 可推测苯分子中不存在三个完全独立的碳碳双键
16. 反应A(g)+B(g)→C(g)-Q1(Q1>0)分两步进行:①A(g)+B(g)→X(g)+Q2(Q2>0);②X(g)→C(g)-Q3(Q3>0)。下列图中,能正确表示总反应过程中能量变化的是A、
放热少
D、 , 可推测苯分子中不存在三个完全独立的碳碳双键
16. 反应A(g)+B(g)→C(g)-Q1(Q1>0)分两步进行:①A(g)+B(g)→X(g)+Q2(Q2>0);②X(g)→C(g)-Q3(Q3>0)。下列图中,能正确表示总反应过程中能量变化的是A、 B、
B、 C、
C、 D、
D、 17. 以乙炔和1,2-二氯乙烷为原料生产氯乙烯包括如下反应:
17. 以乙炔和1,2-二氯乙烷为原料生产氯乙烯包括如下反应:反应I:ClCH2CH2Cl(g)→HCl(g)+CH2=CHCl(g) ΔH1=+69.7 kJ•mol-1
反应Ⅱ:HC≡CH(g)+HCl(g)→CH2=CHCl(g) ΔH2=-98.8 kJ•mol-1
1.0×105Pa下,分别用如表三种方式进行投料,不同温度下反应达到平衡时相关数据如图所示。方式
气体投料
平衡时相关数据
甲
ClCH2CH2Cl
ClCH2CH2Cl转化率
乙
n(HC≡CH):n(HCl)=1:1
HC≡CH转化率
丙
n(ClCH2CH2Cl):n(HC≡CH)=1:1
CH2=CHCl产率

下列说法错误的是
A、反应ClCH2CH2Cl(g)+HC≡CH(g)→2CH2=CHCl(g)的ΔH=-29.1 kJ•mol-1 B、曲线①表示平衡时ClCH2CH2Cl转化率随温度的变化 C、按方式丙投料,其他条件不变,移去部分CH2=CHCl可能使CH2=CHCl的产率从X点的值升至Y点的值 D、在催化剂作用下按方式丙投料,反应达到平衡时CH2=CHCl的产率(图中Z点)低于X点的原因可能是催化剂活性降低18. 在生产、生活、科技中,氢能已获得越来越多的关注,是非常重要的能源。已知:
下列推断正确的是
A、H2O(l)吸收能量后,分子中氢氧键断裂而生成H2O(g) B、2H2(g)+O2(g)=2H2O(g) =-484 kJ C、若2H2(g)+O2(g)=2H2O(g)+Q1;2H2(g)+O2(l)=2H2O(g)+Q2;则Q1>Q2 D、将2 mol H2O(g)分解成H2(g)和O2(g),吸收4×463 kJ的热量19. 一定条件下,丙烯与HCl反应生成和的反应历程如图所示。下列说法正确的是 A、丙烯与HCl的反应是吸热反应 B、合成的反应中,第Ⅱ步为反应的决速步 C、其他条件不变,适当升高温度可以提高加成产物中的比例 D、的焓变等于第一步与第二步正反应活化能的差值20. 已知复杂反应的速率由反应历程中活化能最大的一步基元反应决定。卤代烃的取代反应有以下两种反应历程,其反应过程中的能量变化如图所示:
A、丙烯与HCl的反应是吸热反应 B、合成的反应中,第Ⅱ步为反应的决速步 C、其他条件不变,适当升高温度可以提高加成产物中的比例 D、的焓变等于第一步与第二步正反应活化能的差值20. 已知复杂反应的速率由反应历程中活化能最大的一步基元反应决定。卤代烃的取代反应有以下两种反应历程,其反应过程中的能量变化如图所示:
下列说法中错误的是
A、卤代烃的取代为放热反应 B、SN1 反应速率与c(Nu:-)和c(R3CX)相关 C、SN2反应速率与c(RX)和c(Nu:-)相关 D、SN1机理为两步反应,SN2机理为一步反应21. 下图是我国科研工作者研究与作用最终生成与的物质相对能量-反应进程曲线。下列叙述错误的是 A、中间体比更稳定 B、该反应进程中的最大能垒(活化能)为 C、生成的过程中有极性键的断裂和形成 D、总反应的热化学方程式为22. 已知硫的两种晶体形态的相图如图所示(相图:用于描述不同温度、压强下硫单质的转化及存在状态的平衡图像),燃烧的热化学方程式为:
A、中间体比更稳定 B、该反应进程中的最大能垒(活化能)为 C、生成的过程中有极性键的断裂和形成 D、总反应的热化学方程式为22. 已知硫的两种晶体形态的相图如图所示(相图:用于描述不同温度、压强下硫单质的转化及存在状态的平衡图像),燃烧的热化学方程式为:S(斜方,s) ;
S(单斜,s) 。
则下列有关说法中正确的是
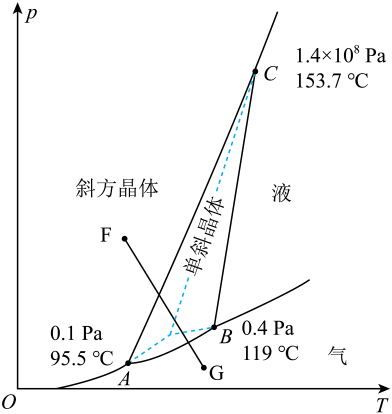 A、温度高于119℃且压强小于 , 单斜硫发生液化现象 B、斜方硫和单斜硫互为同分异构体 C、图中F→G过程为固态硫的气化,该过程只破坏了分子间作用力 D、由上述信息可判断:
A、温度高于119℃且压强小于 , 单斜硫发生液化现象 B、斜方硫和单斜硫互为同分异构体 C、图中F→G过程为固态硫的气化,该过程只破坏了分子间作用力 D、由上述信息可判断:二、非选择题
-
23. 苯乙烯是重要的有机化工原料,可用乙苯为原料制备苯乙烯。制备方法有直接脱氢法和氧化脱氢法。在时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接脱氢:
(ⅱ)氧化脱氢:
回答下列问题:
(1)、①反应的 , 平衡常数(用表示)。②氧化脱氢的反应趋势远大于直接脱氢,其原因是。
③提高氧化脱氢反应平衡转化率的措施有、。
(2)、已知 , 忽略随温度的变化。当时,反应能自发进行。在下,直接脱氢反应的和随温度变化的理论计算结果如图所示。
①直接脱氢反应在常温下(选填“能”或“不能”)自发。
②随温度的变化曲线为(选填“a”或“b”),判断的理由是。
③在某温度、下,向密闭容器中通入气态乙苯发生直接脱氢反应,达到平衡时,混合气体中乙苯和氢气的分压相等,该反应的平衡常数(保留小数点后一位;分压总压物质的量分数)。
(3)、乙苯脱氢制苯乙烯往往伴随副反应,生成苯和甲苯等芳香烃副产物。一定温度和压强条件下,为了提高反应速率和苯乙烯选择性,应当。24. 工业尾气脱硝是减少空气污染的重要举措。回答下列问题:(1)、已知相关反应的热力学数据如下。反应
①脱硝反应的。时,为了提高该反应中NO的平衡转化率,理论上可采取的措施是。
A.恒容时增大的压强 B.减小反应容器的容积
C.移去部分 D.选择合适的催化剂
②另一脱硝反应的。
(2)、模拟工业尾气脱硝:一定条件下,将的气体与Ar混合,匀速通过催化脱硝反应器,测得NO去除率和转化率随反应温度的变化如图。
当温度低于时,NO的去除率随温度升高而升高,可能原因是;高于时,NO的去除率随温度升高而降低,结合(1)的信息分析其可能原因是。
(3)、中国科学家利用Cu催化剂实现电化学脱硝。通过理论计算推测电解池阴极上NO可能的转化机理及转化步骤的活化能分别如下(*表示催化剂表面吸附位,如表示吸附于催化剂表面的NOH)。I.
Ⅱ.
Ⅲ.
Ⅳ.
V.
上述反应机理中,Ⅱ~V中速率最慢的步骤是。若电路中有电子流过,其中生成的选择性为95%,电解池阴极生成的的物质的量为mmol。
25. 聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。(1)、Ⅰ.苯乙烯的制备
已知下列反应的热化学方程式:①
②
③
计算反应④的;
(2)、在某温度、下,向反应器中充入气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入水蒸气作为稀释气(计算时忽略副反应);(3)、在、下,以水蒸气作稀释气。作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:⑤
⑥
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S()随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是 , 理由是;
 (4)、关于本反应体系中催化剂的描述错误的是____;A、X射线衍射技术可测定晶体结构 B、可改变乙苯平衡转化率 C、降低了乙苯脱氢反应的活化能 D、改变颗粒大小不影响反应速率(5)、Ⅱ.苯乙烯的聚合
(4)、关于本反应体系中催化剂的描述错误的是____;A、X射线衍射技术可测定晶体结构 B、可改变乙苯平衡转化率 C、降低了乙苯脱氢反应的活化能 D、改变颗粒大小不影响反应速率(5)、Ⅱ.苯乙烯的聚合苯乙烯聚合有多种方法,其中一种方法的关键步骤是某(Ⅰ)的配合物促进(引发剂,X表示卤素)生成自由基 , 实现苯乙烯可控聚合。
引发剂中活性最高的是;(6)、室温下,①在配体L的水溶液中形成 , 其反应平衡常数为K;②在水中的溶度积常数为。由此可知,在配体L的水溶液中溶解反应的平衡常数为(所有方程式中计量系数关系均为最简整数比)。26. 镁基储氢材料MgH2具有储氢量高、成本低廉等优点,发展前景广阔。Ⅰ.MgH2热分解放出H2
MgH2(s)Mg(s)+H2(g) ΔH=+75kJ/mol
该反应的能量变化如图。
 (1)、E1=。(2)、提高H2平衡产率的措施有(答2条)。(3)、Ⅱ.MgH2水解制备H2
(1)、E1=。(2)、提高H2平衡产率的措施有(答2条)。(3)、Ⅱ.MgH2水解制备H2MgH2与H2O反应制备H2的化学方程式是。
(4)、MgH2与H2O反应时,最初生成H2的速率很快,但随后变得很缓慢,原因是。(5)、MgCl2、NiCl2、CuCl2等盐溶液能提升MgH2的水解性能。1mol/L的几种盐溶液对MgH2水解制备H2的性能曲线如图。
已知:ⅰ.
物质
Mg(OH)2
Ni(OH)2
Cu(OH)2
Ksp
5.6×10-12
5.5×10-16
2.2×10-20
ⅱ.MgH2在MCl2(M代表Mg、Ni、Cu)溶液中水解的示意图如图。

①NiCl2溶液制备H2的性能优于MgCl2溶液,原因是。
②MgH2在MgCl2溶液中制备H2的性能不如在NiCl2溶液中优异,但使用MgCl2溶液利于发展“镁-氢”循环经济,原因是。
③CuCl2溶液制备H2的性能不如NiCl2溶液,可能的原因是。